Kurze Beschreibung von zwei Arten des programmierten Zelltods: Apoptose und Autophagie
Apoptose oder Typ I programmierter Zelltod ist die am weitesten untersuchte Form des Zelltods. Seine morphologischen Eigenschaften können unter Lichtmikroskopie identifiziert werden und umfassen Zellschrumpfung, Verdichtung des Chromatins, Blebbing der Zytoplasmamembran und schließlich die Bildung apoptotischer Körper (Abbildung 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
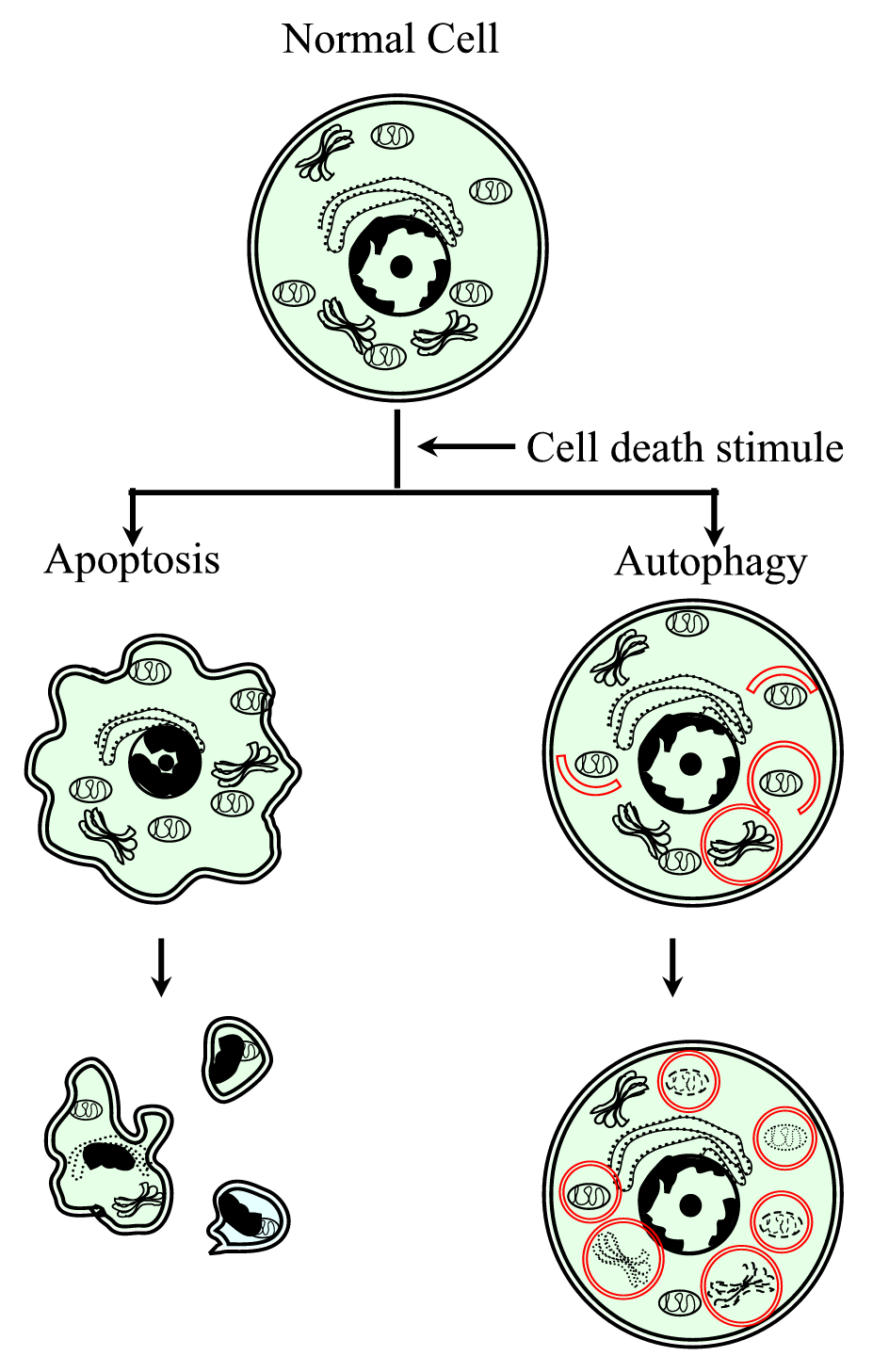
Figure 1.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceSchematische Darstellung des programmierten Zelltodprozesses Typ I (Apoptose) und Typ II (Autophagie). Die Apoptose ist durch eine zelluläre Kontraktion, Chromatinverdichtung, membranöse Bläschen und die Bildung apoptotischer Körper gekennzeichnet. Autophagie ist durch das Vorhandensein einer großen Anzahl von Autophagosomen mit zytoplasmatischem Gehalt gekennzeichnet. Beide Arten des Zelltods erzeugen keine Entzündungsreaktion, da die Zytoplasmamembran konserviert wird, bis die Zelltrümmer durch Mikroben oder durch spezialisierte eliminiert werden.
Caspasen sind Cysteinyl-Aspartat-spezifische Proteasen, die in inaktiver Form als Zymogene, sogenannte Pro-Caspasen, synthetisiert werden (Abbildung 2). Es ist diese inaktive Form, die die kontrollierte Ausführung des Zelltodprozesses ermöglicht. Caspasen wurden zuerst im Nematoden Ceanorhabditis elegans identifiziert, aber homologe Formen sind in Säugetieren vorhanden .
Die Kennzeichen der Apoptose, wie DNA-Fragmentierung und verdichtetes Chromatin, resultieren aus der Caspase-Aktivität. Während der Apoptose wird DNA in Nukleosomengröße (200 bp) fragmentiert . Der für die DNA-Fragmentierung während der Apoptose verantwortliche Faktor ist eine spezifische DNase (CAD, Caspase-activated DNase), die durch aktive Caspase-3 aktiviert wird . Aktive Caspase-3 wiederum ist an morphologischen Zellveränderungen während der Apoptose beteiligt, wo sie rho-assoziierte Kinase-1 (ROCK-1) spaltet, um sie zu aktivieren, und dies beeinflusst schließlich die Zytoskelettanordnung, die die apoptotische Schrumpfungsmorphologie verursacht .

Abbildung 2.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceCaspasen, die am apoptotischen Prozess beteiligt sind, werden in inaktiver Form als Zymogene synthetisiert und bestehen aus einer Pro-Domäne, einer großen Untereinheit und einer kleinen Untereinheit. Die Zymogene werden zu Tetrameren aktiviert.
Der apoptotische Zelltod wird von Mitgliedern der B-Zell-Lymphom-2-Familie (Bcl-2) stark reguliert . Mitglieder der Bcl-2-Familie wurden nach ihrer Bcl-2-Homologie (BH) und Domänenorganisation als anti-apoptotische und pro-apoptotische Proteine klassifiziert (Abbildung 3). Das Vorhandensein der Domänen BH1, BH2, BH3 und BH4 entspricht der Gruppe, die die Apoptose hemmt. Die pro-apoptotische Gruppe ist im Gegensatz dazu in zwei Gruppen unterteilt: diejenigen mit den Domänen BH1, BH2 und BH3 und diejenigen mit nur den BH3-Domänen (definiert als nur BH3; siehe die Überprüfung in ). Diese Proteinfamilie erfüllt ihre Funktionen auf intrazellulärer Ebene innerhalb der Mitochondrien, einem Schlüsselelement der Apoptose.

Abbildung 3.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceProteine der B-Zell-Lymphom-2-Familie (Bcl-2). A) Allgemeine Schematisierung der Struktur von Bcl-2-Proteinen. B) Die anti-apoptotischen Mitglieder – sie besitzen alle vier BH-Domänen. C) Die pro-apoptotischen Mitglieder, die wiederum in zwei Gruppen unterteilt sind: Multidomain und nur BH3.
Apoptose kann auf zwei gut beschriebenen Wegen ausgelöst werden: dem extrinsischen und dem intrinsischen Weg (Abbildung 4). Die extrinsische Aktivierung erfolgt durch die Beteiligung von Todesliganden (wie dem Tumornekrosefaktor – TNF – Superfamilie und TNF-verwandten Apoptose-induzierten Liganden oder TRAIL) mit ihren verwandten Zelloberflächentodrezeptoren (wie TNF-Rezeptor 1, Fas, TRAIL-Rezeptor 1 oder TRAIL-Rezeptor 2) (überprüft in ). Sobald der Ligand seinen Rezeptor erkennt und bindet, wird eine Reihe intrazellulärer Komplexe gebildet, um die Initiator-Caspasen (wie -8 und -10) zu aktivieren, die dann die Executioner-Caspasen (wie -3, -6 und -7) aktivieren. In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Die Ligand-Rezeptor-Interaktion induziert die Assemblierung des Death-inducing Signaling Complex (DISC), um die Aktivierung von Caspase-8 zu fördern, die wiederum in der Lage ist, die Executor-Caspase -3, -6 oder -7 zu aktivieren, was zu den morphologischen Veränderungen der Apoptose führt. Der intrinsische Weg wird durch die mitochondriale äußere Membranpermeabilisierung gelenkt, die die Freisetzung von pro-apoptotischen Elementen als Cytochrom-C ermöglicht. Cytochrom-C induziert den Apoptose-Protease-aktivierenden Faktor 1 (Apaf-1), um die Aktivierung von Caspase-9 zum Zusammenbau des Apoptosoms zu fördern. Das Apoptosom ist in der Lage, die Executor-Caspasen zu aktivieren.
Der intrinsische apoptotische Weg kann im Gegensatz dazu durch verschiedene Reize aktiviert werden, einschließlich DNA-Schäden, Wachstumsfaktormangel und oxidativem Stress . Während der Exposition von Zellen gegenüber diesen Reizen sind die Mitochondrien betroffen, da mehrere Mitglieder der Bcl-2-Familie aktiviert werden und die äußere Membranpermeabilisierung (MOMP) der Mitochondrien fördern. Die permeierte externe Mitochondrienmembran ermöglicht die Freisetzung von Cytochrom c (Cyt c), das mit dem Apaf-1-Protein assoziiert ist. Die Vereinigung von Cyt c und Apaf-1 bindet dann an die Initiator-Caspase-9, um den Komplex zu bilden, der das Apoptosom ausmacht, das die Fähigkeit hat, die Initiator-Caspasen zu aktivieren, die ihre Funktionen durch Spaltung spezifischer zellulärer Substrate erfüllen.Der zweite Prozess des Zelltods, die Autophagie, ist ein genetisch programmierter und evolutionär konservierter Prozess, der den Abbau veralteter Organellen und Proteine bewirkt. Es wird durch extrazelluläre Reize wie Nährstoffmangel, Hypoxie, hohe Temperaturen und veränderte intrazelluläre Bedingungen aktiviert, einschließlich der Ansammlung beschädigter oder überflüssiger Organellen (überprüft in ).In eukaryotischen Organismen wurden drei Arten von Autophagie beschrieben: Mikroautophagie, Makroautophagie (allgemein einfach Autophagie genannt) und Chaperon-vermittelte Autophagie (Abbildung 5). Bei der Mikroautophagie werden zytoplasmatische Komponenten direkt auf der Ebene des Lysosoms mittels eines Invaginationsprozesses verschlungen, während bei der Makroautophagie Doppelmembranvesikel gebildet werden, die zelluläre Komponenten enthalten, die mit Lysosomen zu einem Autophagolysosom verschmelzen. Innerhalb des Autophagolysosoms werden die intravesikulären Komponenten abgebaut und, wenn möglich, von der Zelle recycelt (eingefüllt ). Die chaperonvermittelte Autophagie beinhaltet schließlich die Beteiligung von Chaperonen an der Erkennung der Proteine, die zur Eliminierung durch die Lysosomen bestimmt sind .

Abbildung 5.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceSchematische Darstellungen der verschiedenen Mechanismen der Autophagie. Makroautophagie – Autophagie- impliziert die Bildung eines Doppelmembranvesikels, das den zytoplasmatischen Inhalt verschlingt, der zum Abbau des Lysosoms geleitet wird. Die Mikroautophagie ist durch direktes Verschlingen von zytoplasmatischen Komponenten durch das Lysosom gekennzeichnet. Dieser Prozess beinhaltet die Umgestaltung der Membran der Organelle durch Bildung einer lysosomalen Membraninvagination. Während der Chaperon-vermittelten Autophagie werden die abzubauenden Proteine auf ein Hsp70 gerichtet, das wiederum die Zielladung zum Lysosom transportiert.
Autophagie wird durch Atg-Gene(Autophagie-verwandte Gene) gesteuert, die erforderlich sind, um den Signalkomplex zu aktivieren, der die Bildung von Autophagosomen auslöst . Atggene wurden in Hefe entdeckt, aber viele haben Orthologe in höheren Eukaryoten (Abbildung 6). Die Bildung von Autophagosomen beinhaltet die Beteiligung des zytoplasmatischen Proteins LC3 (Atg8), das durch Phosphatidylethanolamin lipidiert wird und dann in die entstehende Autophagosomenmembran rekrutiert wird (Abbildung 7). Die Akkumulation von lipidiertem LC3-Protein (bekannt als LC3-II) wird als Marker für die Autophagie verwendet .

Abbildung 6.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=“http://www.w3.org/1999/xlink“ xmlns:mml=“http://www.w3.org/1998/Math/MathML“ xmlns:xsi=“http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. LC3-Protein wird durch das Phosphatidylethanolamin lipidiert.
Der autophagische Zelltod oder der programmierte Zelltod vom Typ II ist durch ein massives Verschlingen des Zytoplasmas durch autophagische Vesikel gekennzeichnet. Diese intensive autophagische Aktivität unterscheidet sich wesentlich von der Autophagie, die kontinuierlich auf Basalebene auftritt. Ultrastrukturelle Studien an Drosophila haben die Ansammlung von autophagischen Vakuolen in den meisten Larvengeweben gezeigt. Diese Art des programmierten Zelltods beginnt mit dem Abbau von zytoplasmatischen Organellen durch Autophagie, obwohl die Zytoskelettelemente bis in die späten Stadien des Prozesses konserviert werden (siehe in ).
