Lernziele
- Beschreiben Sie die grundlegende Struktur einer Aminosäure
- Beschreiben Sie die chemischen Strukturen von Proteinen
- Fassen Sie die einzigartigen Eigenschaften von Proteinen zusammen
Zu Beginn dieses Kapitels wurde ein berühmtes Experiment beschrieben, bei dem Wissenschaftler Aminosäuren unter Bedingungen synthetisierten, die die auf der Erde vorhandenen lange vor der Evolution des Lebens, wie wir es kennen, simulierten. Diese Verbindungen sind in der Lage, sich in im Wesentlichen beliebiger Anzahl miteinander zu verbinden, wodurch Moleküle von im Wesentlichen beliebiger Größe erhalten werden, die eine breite Palette physikalischer und chemischer Eigenschaften besitzen und zahlreiche Funktionen erfüllen, die für alle Organismen lebenswichtig sind. Die von Aminosäuren abgeleiteten Moleküle können als strukturelle Komponenten von Zellen und subzellulären Einheiten, als Nährstoffquellen, als Atom- und Energiespeicherreservoirs und als funktionelle Spezies wie Hormone, Enzyme, Rezeptoren und Transportmoleküle fungieren.
Aminosäuren und Peptidbindungen

Abbildung 1.
Eine Aminosäure ist ein organisches Molekül, in dem ein Wasserstoffatom, eine Carboxylgruppe (–COOH) und eine Aminogruppe (–NH2) alle an dasselbe Kohlenstoffatom, den sogenannten α-Kohlenstoff, gebunden sind. Die vierte Gruppe, die an den α-Kohlenstoff gebunden ist, variiert zwischen den verschiedenen Aminosäuren und wird als Rest oder Seitenkette bezeichnet, die in Strukturformeln durch den Buchstaben R dargestellt wird. Die Primärstruktur eines Proteins, eine Peptidkette, besteht aus Aminosäureresten. Die einzigartigen Eigenschaften der funktionellen Gruppen und R-Gruppen ermöglichen es diesen Komponenten der Aminosäuren, Wasserstoff-, Ionen- und Disulfidbindungen sowie polare / unpolare Wechselwirkungen zu bilden, die zur Bildung sekundärer, tertiärer und quaternärer Proteinstrukturen erforderlich sind. Diese Gruppen bestehen hauptsächlich aus Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff und Schwefel in Form von Kohlenwasserstoffen, Säuren, Amiden, Alkoholen und Aminen. Einige Beispiele, die diese Möglichkeiten veranschaulichen, sind in Abbildung 1 dargestellt.Aminosäuren können durch Reaktion der Carbonsäuregruppe eines Moleküls mit der Amingruppe eines anderen Moleküls chemisch miteinander verbunden werden. Diese Reaktion bildet eine Peptidbindung und ein Wassermolekül und ist ein weiteres Beispiel für die Dehydratisierungssynthese (Abbildung 2). Moleküle, die durch chemische Verknüpfung einer relativ bescheidenen Anzahl von Aminosäuren (ungefähr 50 oder weniger) gebildet werden, werden Peptide genannt, und Präfixe werden häufig verwendet, um diese Zahlen anzugeben: Dipeptide (zwei Aminosäuren), Tripeptide (drei Aminosäuren) und so weiter. Allgemeiner wird die ungefähre Anzahl von Aminosäuren bezeichnet: Oligopeptide werden durch die Verbindung von bis zu etwa 20 Aminosäuren gebildet, während Polypeptide aus bis zu etwa 50 Aminosäuren synthetisiert werden. Wenn die Anzahl der miteinander verknüpften Aminosäuren sehr groß wird oder wenn mehrere Polypeptide als Bauuntereinheiten verwendet werden, werden die resultierenden Makromoleküle Proteine genannt. Die kontinuierlich variable Länge (die Anzahl der Monomere) dieser Biopolymere, zusammen mit der Vielfalt der möglichen R-Gruppen an jeder Aminosäure, ermöglicht eine nahezu unbegrenzte Vielfalt der Arten von Proteinen, die gebildet werden können.

Abbildung 2. Die Bildung von Peptidbindungen ist eine Dehydrationssynthesereaktion. Die Carboxylgruppe der ersten Aminosäure (Alanin) ist mit der Aminogruppe der ankommenden zweiten Aminosäure (Alanin) verknüpft. Dabei wird ein Molekül Wasser freigesetzt.
Denken Sie darüber nach
- Wie viele Aminosäuren sind in Polypeptiden?
Proteinstruktur
Die Größe (Länge) und die spezifische Aminosäuresequenz eines Proteins sind wichtige Determinanten seiner Form, und die Form eines Proteins ist entscheidend für seine Funktion. Bei der biologischen Stickstofffixierung (siehe biogeochemische Kreisläufe) interagieren Bodenmikroorganismen, die gemeinsam als Rhizobien bekannt sind, symbiotisch mit Wurzeln von Hülsenfrüchten wie Sojabohnen, Erdnüssen oder Bohnen, um eine neuartige Struktur zu bilden, die als Knoten an den Pflanzenwurzeln bezeichnet wird. Die Pflanze produziert dann ein Trägerprotein namens Leghämoglobin, ein Protein, das Stickstoff oder Sauerstoff transportiert. Leghämoglobin bindet mit einer sehr hohen Affinität an seinen Substratsauerstoff an einer bestimmten Region des Proteins, in der Form und Aminosäuresequenz angemessen sind (das aktive Zentrum). Wenn die Form oder die chemische Umgebung des aktiven Zentrums auch nur geringfügig verändert wird, kann das Substrat möglicherweise nicht so stark oder gar nicht binden. Damit das Protein vollständig aktiv ist, muss es die für seine Funktion geeignete Form haben.
Die Proteinstruktur wird in vier Stufen eingeteilt: primär, sekundär, tertiär und quartär. Die Primärstruktur ist einfach die Sequenz von Aminosäuren, aus denen die Polypeptidkette besteht. Abbildung 3 zeigt die Primärstruktur eines Proteins.
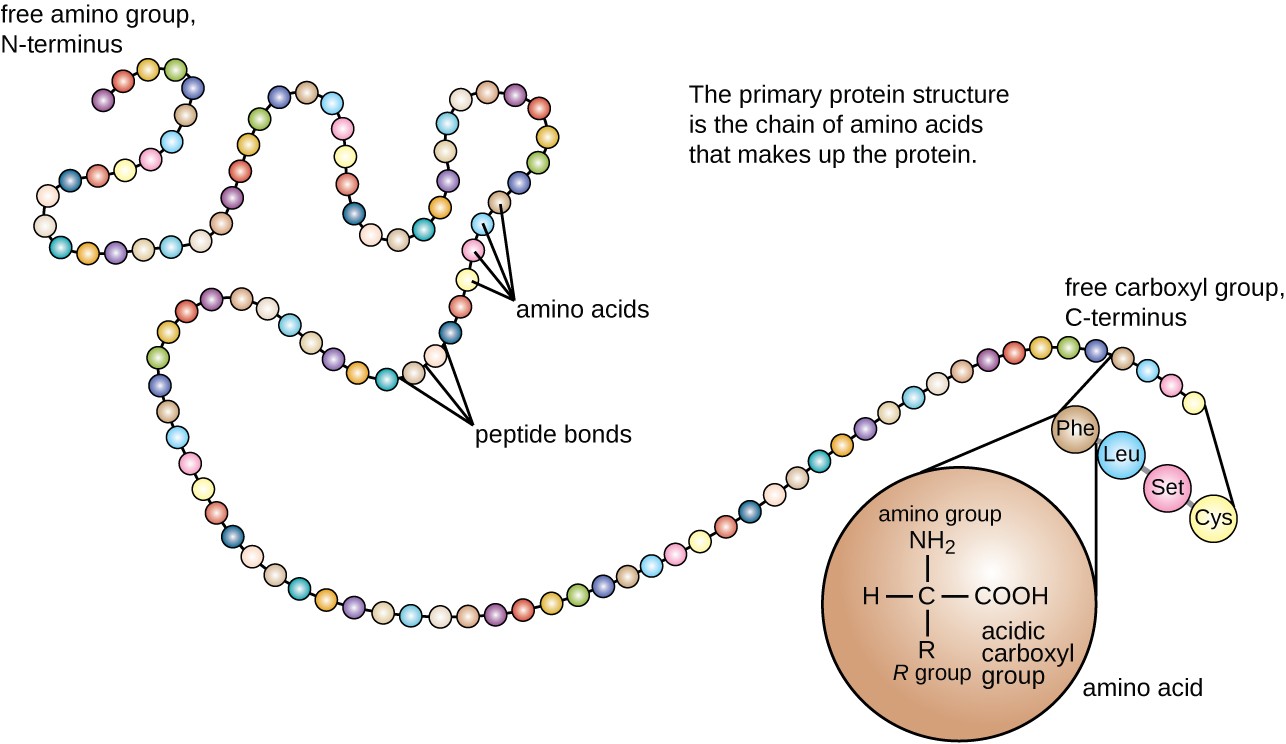
Abbildung 3. Klicken Sie, um ein größeres Bild anzuzeigen. Die Primärstruktur eines Proteins ist die Sequenz von Aminosäuren. (credit: modification of work by National Human Genome Research Institute)
Die Aminosäurenkette, die die Primärstruktur eines Proteins definiert, ist nicht starr, sondern aufgrund der Art der Bindungen, die die Aminosäuren zusammenhalten, flexibel. Wenn die Kette ausreichend lang ist, kann eine Wasserstoffbindung zwischen Amin- und carbonylfunktionellen Gruppen innerhalb des Peptidrückgrats (mit Ausnahme der R-Seitengruppe) auftreten, was zu einer lokalisierten Faltung der Polypeptidkette in Helices und Blätter führt. Diese Formen bilden die Sekundärstruktur eines Proteins. Die häufigsten Sekundärstrukturen sind die α-Helix und β-Plissee. In der α-Helix-Struktur wird die Helix durch Wasserstoffbrückenbindungen zwischen dem Sauerstoffatom in einer Carbonylgruppe einer Aminosäure und dem Wasserstoffatom der Aminogruppe, die nur vier Aminosäureeinheiten weiter entlang der Kette ist, gehalten. In der β-plissierten Folie werden die Falten durch ähnliche Wasserstoffbrückenbindungen zwischen kontinuierlichen Sequenzen von Carbonyl- und Aminogruppen gebildet, die weiter am Rückgrat der Polypeptidkette getrennt sind (Abbildung 4).

Abbildung 4. Die Sekundärstruktur eines Proteins kann eine α-Helix oder ein β-Faltblatt oder beides sein.
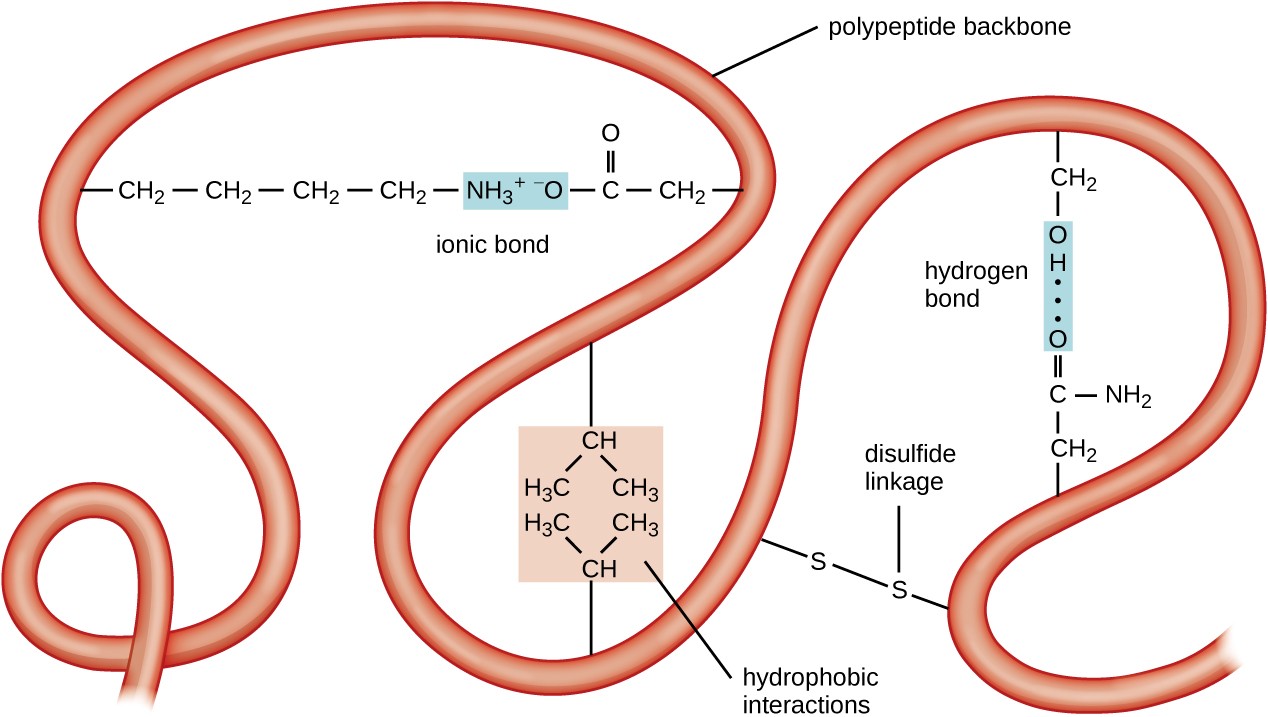
Abbildung 5. Klicken Sie hier, um das Bild zu vergrößern. Die Tertiärstruktur von Proteinen wird durch eine Vielzahl von Anziehungskräften bestimmt, einschließlich hydrophober Wechselwirkungen, Ionenbindung, Wasserstoffbindung und Disulfidbindungen.
Die nächste Ebene der Proteinorganisation ist die Tertiärstruktur, die die großräumige dreidimensionale Form einer einzelnen Polypeptidkette darstellt. Die Tertiärstruktur wird durch Wechselwirkungen zwischen Aminosäureresten bestimmt, die in der Kette weit voneinander entfernt sind. Eine Vielzahl von Wechselwirkungen führt zu einer Proteintertiärstruktur, wie Disulfidbrücken, bei denen es sich um Bindungen zwischen den Sulfhydryl (–SH) -funktionellen Gruppen an Aminosäureseitengruppen handelt; Wasserstoffbrücken; Ionenbindungen; und hydrophobe Wechselwirkungen zwischen unpolaren Seitenketten. Alle diese schwachen und starken Wechselwirkungen bestimmen zusammen die endgültige dreidimensionale Form des Proteins und seine Funktion (Abbildung 5).
Der Prozess, bei dem eine Polypeptidkette eine großflächige, dreidimensionale Form annimmt, wird als Proteinfaltung bezeichnet. Gefaltete Proteine, die in ihrer normalen biologischen Rolle voll funktionsfähig sind, sollen eine native Struktur besitzen. Wenn ein Protein seine dreidimensionale Form verliert, ist es möglicherweise nicht mehr funktionsfähig. Diese entfalteten Proteine werden denaturiert. Denaturierung bedeutet den Verlust der Sekundärstruktur und der Tertiärstruktur (und, falls vorhanden, der Quartärstruktur) ohne den Verlust der Primärstruktur.
Einige Proteine bestehen aus mehreren separaten Polypeptiden, die auch als Proteinuntereinheiten bezeichnet werden. Diese Proteine funktionieren nur dann ausreichend, wenn alle Untereinheiten vorhanden und entsprechend konfiguriert sind. Die Wechselwirkungen, die diese Untereinheiten zusammenhalten, bilden die quartäre Struktur des Proteins. Die gesamte quartäre Struktur wird durch relativ schwache Wechselwirkungen stabilisiert. Hämoglobin zum Beispiel hat eine quaternäre Struktur von vier globulären Proteinuntereinheiten: zwei α- und zwei β-Polypeptide, die jeweils ein Häm auf Eisenbasis enthalten (Abbildung 6).

Abbildung 6. Ein Hämoglobinmolekül hat zwei α- und zwei β-Polypeptide zusammen mit vier Häm-Gruppen.
Eine weitere wichtige Klasse von Proteinen sind die konjugierten Proteine, die einen Nichtproteinanteil haben. Wenn an das konjugierte Protein ein Kohlenhydrat gebunden ist, spricht man von einem Glykoprotein. Wenn es ein Lipid gebunden hat, wird es ein Lipoprotein genannt. Diese Proteine sind wichtige Bestandteile von Membranen. Abbildung 7 fasst die vier Ebenen der Proteinstruktur zusammen.

Abbildung 7. Die Proteinstruktur hat vier Organisationsebenen. (credit: modification of work by National Human Genome Research Institute)
Denken Sie darüber nach
- Was kann passieren, wenn die primäre, sekundäre, tertiäre oder quaternäre Struktur eines Proteins verändert wird?
Primärstruktur, dysfunktionale Proteine und Mukoviszidose

Abbildung 8. Klicken Sie, um ein größeres Bild anzuzeigen. Das normale CFTR-Protein ist ein Kanalprotein, das Salz (Natriumchlorid) hilft, sich in Zellen hinein und aus ihnen heraus zu bewegen.
Proteine, die mit biologischen Membranen assoziiert sind, werden als extrinsisch oder intrinsisch klassifiziert. Extrinsische Proteine, auch periphere Proteine genannt, sind lose mit einer Seite der Membran assoziiert. Intrinsische Proteine oder integrale Proteine sind in die Membran eingebettet und fungieren häufig als Teil von Transportsystemen als Transmembranproteine. Mukoviszidose (CF) ist eine humane genetische Störung, die durch eine Veränderung des Transmembranproteins verursacht wird. Es betrifft hauptsächlich die Lunge, kann aber auch Bauchspeicheldrüse, Leber, Nieren und Darm betreffen. CF wird durch einen Verlust der Aminosäure Phenylalanin in einem Mukoviszidose-Transmembranprotein (CFTR) verursacht. Der Verlust einer Aminosäure verändert die Primärstruktur eines Proteins, das normalerweise beim Transport von Salz und Wasser in und aus Zellen hilft (Abbildung 8).
Die Veränderung der Primärstruktur verhindert, dass das Protein richtig funktioniert, wodurch der Körper ungewöhnlich dicken Schleim produziert, der die Lunge verstopft und zur Ansammlung von klebrigem Schleim führt. Der Schleim verstopft die Bauchspeicheldrüse und verhindert, dass natürliche Enzyme dem Körper helfen, Nahrung abzubauen und lebenswichtige Nährstoffe aufzunehmen.In der Lunge von Menschen mit Mukoviszidose bietet der veränderte Schleim eine Umgebung, in der Bakterien gedeihen können. Diese Besiedlung führt zur Bildung von Biofilmen in den kleinen Atemwegen der Lunge. Die häufigsten Erreger in der Lunge von Patienten mit Mukoviszidose sind Pseudomonas aeruginosa (Abbildung 9a) und Burkholderia cepacia. Pseudomonas differenziert sich innerhalb des Biofilms in der Lunge und bildet große Kolonien, die als „mukoide“ Pseudomonas bezeichnet werden. Die Kolonien haben eine einzigartige Pigmentierung, die sich in Labortests zeigt (Abbildung 9b) und Ärzten den ersten Hinweis darauf gibt, dass der Patient CF hat (solche Kolonien sind bei gesunden Personen selten).

Abbildung 9. (a) Eine rasterelektronenmikroskopische Aufnahme zeigt das opportunistische Bakterium Pseudomonas aeruginosa. (b) Pigmentproduzierendes P. aeruginosa auf Cetrimid-Agar zeigt das grüne Pigment Pyocyanin. (credit a: Modifikation der Arbeit der Zentren für die Kontrolle und Prävention von Krankheiten)
Schlüsselkonzepte und Zusammenfassung
- Aminosäuren sind kleine Moleküle, die für alles Leben essentiell sind. Jeder hat einen α-Kohlenstoff, an den ein Wasserstoffatom, eine Carboxylgruppe und eine Amingruppe gebunden sind. Die vierte gebundene Gruppe, dargestellt durch R, variiert in der chemischen Zusammensetzung, Größe, Polarität und Ladung zwischen verschiedenen Aminosäuren, was zu unterschiedlichen Eigenschaften führt.
- Peptide sind Polymere, die durch die Verknüpfung von Aminosäuren durch Dehydrationssynthese gebildet werden. Die Bindungen zwischen den verknüpften Aminosäuren werden Peptidbindungen genannt. Die Anzahl der miteinander verbundenen Aminosäuren kann von wenigen bis zu vielen variieren.
- Proteine sind Polymere, die durch die Verknüpfung einer sehr großen Anzahl von Aminosäuren gebildet werden. Sie erfüllen viele wichtige Funktionen in einer Zelle und dienen als Nährstoffe und Enzyme; speichermoleküle für Kohlenstoff, Stickstoff und Energie; und Strukturkomponenten.
- Die Struktur eines Proteins ist eine kritische Determinante seiner Funktion und wird durch eine abgestufte Klassifikation beschrieben: primär, sekundär, tertiär und quartär. Die native Struktur eines Proteins kann durch Denaturierung gestört werden, was zum Verlust seiner Struktur höherer Ordnung und seiner biologischen Funktion führt.
- Einige Proteine werden von mehreren separaten Proteinuntereinheiten gebildet, wobei die Wechselwirkung dieser Untereinheiten die quartäre Struktur des Proteinkomplexes bildet.
- Konjugierte Proteine haben einen Nichtpolypeptidanteil, der ein Kohlenhydrat (ein Glykoprotein bildend) oder eine Lipidfraktion (ein Lipoprotein bildend) sein kann. Diese Proteine sind wichtige Bestandteile von Membranen.
Multiple Choice
Welche der folgenden Gruppen variiert zwischen verschiedenen Aminosäuren?
- Wasserstoffatom
- Carboxylgruppe
- R-Gruppe
- Aminogruppe
Die in Proteinen vorhandenen Aminosäuren unterscheiden sich in welcher der folgenden?
- Größe
- Form
- Seitengruppen
- alle oben genannten
Welche der folgenden Bindungen sind nicht an der Tertiärstruktur beteiligt?
- Peptidbindungen
- ionische Bindungen
- hydrophobe Wechselwirkungen
- Wasserstoffbindungen
Füllen Sie die Lücke aus
Die Sequenz der Aminosäuren in einem Protein wird als __________.
Denaturierung bedeutet den Verlust der __________ und __________ strukturen ohne den Verlust der __________ struktur.
True/False
Eine Veränderung einer Aminosäure in einer Proteinsequenz führt immer zu einem Funktionsverlust.
Denken Sie darüber nach
- Wenn Sie ein Protein ausreichend erhitzen, kann es denaturieren. Was sagt diese Aussage unter Berücksichtigung der Definition der Denaturierung über die Stärken von Peptidbindungen im Vergleich zu Wasserstoffbrückenbindungen aus?
- Das gezeigte Bild stellt ein Tetrapeptid dar.

- Wie viele Peptidbindungen sind in diesem Molekül?
- Identifizieren Sie die Seitengruppen der vier Aminosäuren, aus denen dieses Peptid besteht.
