
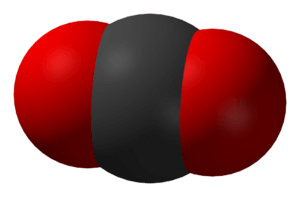
Kohlendioxid (CO2) ist eine chemische Verbindung. Es ist ein Gas bei Raumtemperatur. Es besteht aus einem Kohlenstoff- und zwei Sauerstoffatomen. Menschen und Tiere setzen beim Ausatmen Kohlendioxid frei. Auch jedes Mal, wenn etwas Organisches verbrannt wird (oder ein Feuer gemacht wird), macht es Kohlendioxid. Pflanzen verwenden Kohlendioxid, um Nahrung herzustellen. Dieser Prozess wird Photosynthese genannt. Die Eigenschaften von Kohlendioxid wurden in den 1750er Jahren vom schottischen Wissenschaftler Joseph Black untersucht.
Kohlendioxid ist ein Treibhausgas. Treibhausgase fangen Wärmeenergie ein. Treibhausgase verändern Klima und Wetter auf unserem Planeten Erde. Das nennt man Klimawandel. Treibhausgase sind eine Ursache der globalen Erwärmung, des Anstiegs der Erdoberflächentemperatur.
Biologische Rolle
Kohlendioxid ist ein Endprodukt in Organismen, die im Rahmen ihres Stoffwechsels Energie aus dem Abbau von Zuckern, Fetten und Aminosäuren mit Sauerstoff gewinnen. Dies ist ein Prozess, der als Zellatmung bekannt ist. Dazu gehören alle Pflanzen, Tiere, viele Pilze und einige Bakterien. Bei höheren Tieren wandert das Kohlendioxid im Blut aus dem Körpergewebe in die Lunge, wo es ausgeatmet wird. Pflanzen nehmen Kohlendioxid aus der Atmosphäre auf, um es für die Photosynthese zu verwenden.
Trockeneis
Trockeneis oder festes Kohlendioxid ist der feste Zustand von CO2-Gas unter -78,5 ° C (-109,3 ° F). Trockeneis kommt auf der Erde nicht natürlich vor, sondern wird vom Menschen hergestellt. Es ist farblos. Menschen benutzen Trockeneis, um Dinge kalt zu machen und Getränke sprudelnd zu machen, Gopher zu töten und Warzen einzufrieren. Der Dampf von Trockeneis verursacht Erstickung und schließlich den Tod. Vorsicht und professionelle Hilfe wird empfohlen, wenn Trockeneis verwendet wird.

Bei üblichem Druck schmilzt es nicht von einem Feststoff zu einer Flüssigkeit, sondern wechselt direkt von einem Feststoff zu einem Gas. Dies nennt man Sublimation. Es ändert sich direkt von einem Feststoff zu einem Gas bei jeder Temperatur, die höher ist als extrem kalte Temperaturen. Trockeneis sublimiert bei normaler Lufttemperatur. Trockeneis, das normaler Luft ausgesetzt ist, gibt Kohlendioxidgas ab, das keine Farbe hat. Kohlendioxid kann bei einem Druck über 5,1 Atmosphären verflüssigt werden.
Kohlendioxidgas, das aus Trockeneis austritt, ist so kalt, dass es beim Mischen mit Luft den Wasserdampf in der Luft zu Nebel abkühlt, der wie ein dicker weißer Rauch aussieht. Es wird oft im Theater verwendet, um das Aussehen von Nebel oder Rauch zu erzeugen.
Isolierung und Produktion
Chemiker können Kohlendioxid aus Kühlluft gewinnen. Sie nennen das Luftdestillation. Diese Methode ist ineffizient, da eine große Menge Luft gekühlt werden muss, um eine kleine Menge CO2 zu extrahieren. Chemiker können auch verschiedene chemische Reaktionen verwenden, um Kohlendioxid abzutrennen. Kohlendioxid entsteht in den Reaktionen zwischen den meisten Säuren und den meisten Metallcarbonaten. Zum Beispiel macht die Reaktion zwischen Salzsäure und Calciumcarbonat (Kalkstein oder Kreide) Kohlendioxid:
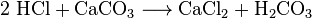
Die Kohlensäure (H2CO3) zersetzt sich dann zu Wasser und CO2. Solche Reaktionen verursachen Schaumbildung oder Blasenbildung oder beides. In der Industrie werden solche Reaktionen vielfach zur Neutralisation von Abfallsäureströmen eingesetzt.
Branntkalk (CaO), eine weit verbreitete Chemikalie, kann aus Kalkstein auf etwa 850 ° C erhitzt werden. Diese Reaktion macht auch CO2:
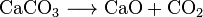
Kohlendioxid entsteht auch bei der Verbrennung aller kohlenstoffhaltigen Brennstoffe, wie Methan (Erdgas), Erdöldestillate (Benzin, Diesel, Kerosin, Propan), Kohle oder Holz. In den meisten Fällen wird auch Wasser freigesetzt. Als Beispiel ist die chemische Reaktion zwischen Methan und Sauerstoff:
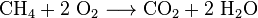
Kohlendioxid wird in Stahlwerken hergestellt. Eisen wird in einem Hochofen mit Koks aus seinen Oxiden reduziert, wodurch Roheisen und Kohlendioxid entstehen:

Hefe verstoffwechselt Zucker zu Kohlendioxid und Ethanol, auch bekannt als Alkohol, bei der Herstellung von Weinen, Bieren und anderen Spirituosen, aber auch bei der Herstellung von Bioethanol:
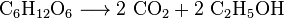
Alle aeroben Organismen produzieren CO2, wenn sie Kohlenhydrate, Fettsäuren und Proteine in den Mitochondrien von Zellen oxidieren. Die Vielzahl der beteiligten Reaktionen ist äußerst komplex und nicht einfach zu beschreiben. (Sie umfassen Zellatmung, anaerobe Atmung und Photosynthese). Photoautotrophe (d. H. Pflanzen, Cyanobakterien) verwenden eine andere Reaktion: Pflanzen absorbieren CO2 aus der Luft und reagieren zusammen mit Wasser zu Kohlenhydraten:
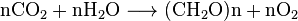
Kohlendioxid ist in Wasser löslich, in dem es spontan zwischen CO2 und H2CO3 (kohlensäure). Die relativen Konzentrationen von CO2, H2CO3 und den deprotonierten Formen HCO−
3 (Bicarbonat) und CO2−
3 (Carbonat) hängen von der Acidität (pH) ab. In neutralem oder leicht alkalischem Wasser (pH > 6, 5) überwiegt die Bikarbonatform (>50%) und wird am häufigsten (>95%) beim pH-Wert von Meerwasser, während in sehr alkalischem Wasser (pH > 10.4) Die vorherrschende (>50%) Form ist Carbonat. Die Bicarbonat- und Carbonatformen sind sehr löslich. So enthält luftausgeglichenes Ozeanwasser (mild alkalisch mit typischem pH = 8,2–8,5) etwa 120 mg Bicarbonat pro Liter.
Industrielle Produktion
Industrielles Kohlendioxid wird hauptsächlich aus sechs Prozessen hergestellt:
- Durch Abscheidung natürlicher Kohlendioxidquellen, wo es durch Einwirkung von angesäuertem Wasser auf Kalkstein oder Dolomit entsteht.
- Als Nebenprodukt von Wasserstoffproduktionsanlagen, bei denen Methan in CO2 umgewandelt wird;
- Aus der Verbrennung fossiler Brennstoffe oder Holz;
- Als Nebenprodukt der Fermentation von Zucker beim Brauen von Bier, Whisky und anderen alkoholischen Getränken;
- Aus der thermischen Zersetzung von Kalkstein, CaCO3, bei der Herstellung von Kalk (Calciumoxid, CaO);
Chemische Reaktion
Kohlendioxid kann durch eine einfache chemische Reaktion:
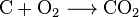 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of „dry ice“, a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

In Meerwasser gelöste Pterapodenhülle angepasst an eine für das Jahr 2100 prognostizierte Ozeanchemie.
-

Überblick über Photosynthese und Atmung. Kohlendioxid (rechts) bildet zusammen mit Wasser durch Photosynthese Sauerstoff und organische Verbindungen (links), die zu Wasser und (CO2) respiriert werden können.
-

Steigende CO2-Werte bedrohten die Apollo 13-Astronauten, die Patronen aus dem Kommandomodul anpassen mussten, um den Kohlendioxidwäscher in der Mondlandefähre zu versorgen, den sie als Rettungsboot benutzten.
-

CO2 concentration meter using a nondispersive infrared sensor
