Angiotensin II verursacht einen Anstieg des Blutdrucks durch Wirkungen an verschiedenen Stellen:
- Nebennieren: Angiotensin II verstärkt die Freisetzung des Steroidhormons Aldosteron, das lokal wirkt, um die Natriumretention und die Kaliumsekretion aus der Niere zu erhöhen. Der Nettoeffekt davon ist die Wasserretention, wodurch der Flüssigkeitshaushalt wiederhergestellt wird.
- Nieren: Angiotensin II erhöht auch die Natriumretention durch direkte Wirkungen auf die proximalen Nierentubuli sowie durch Beeinflussung der glomerulären Filtrationsrate und des renalen Blutflusses.
- Herz-Kreislauf-System: Angiotensin II ist ein potenter endogener Vasokonstriktor, der die Arterien und Venen verengt und den Blutdruck erhöht. Darüber hinaus fördert ein längerer Anstieg von Angiotensin II sowohl in den Blutgefäßen als auch im Herzen das Zellwachstum und die daraus resultierende Hypertrophie.
- Zentrales Nervensystem: Im Gehirn wirkt Angiotensin II auf die hintere Hypophyse und stimuliert die Freisetzung des antidiuretischen Hormons (ADH, auch bekannt als Arginin-Vasopressin (AVP)). ADH erhöht die Wasserresorption in den Nierensammelkanälen. Angiotensin II wirkt auch auf das subfornikale Organ im Gehirn, um einen erhöhten Durst zu verursachen und die Wasseraufnahme zu fördern.
Eine chronische Aktivierung des RAAS-Systems kann zu einem schädlichen Umbau und einer verstärkten Entzündung von Herz, Gefäßen und Nieren sowie zu Bluthochdruck und chronischen Nierenerkrankungen führen.
Neuronale Kontrolle des Herz-Kreislauf-Systems
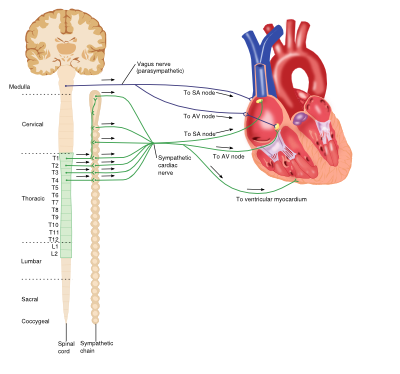
Interaktion zwischen dem sympathischen und parasympathischen Nervensystem und dem Herzen
Sympathisches (adrenerges) Nervensystem
Das adrenerge Nervensystem ist ein wichtiger Bestandteil vieler Prozesse im ganzen Körper, einschließlich des Herz-Kreislauf-Systems. Zirkulierende Katecholamine (z. B. Adrenalin und Noradrenalin) binden an adrenerge Rezeptoren auf Zellmembranen und aktivieren diese. Adrenerge Rezeptoren sind eine Klasse von G-Protein-gekoppelten Rezeptoren, die eine Vielzahl von gewebespezifischen Effekten hervorrufen und in mehreren Subtypen existieren.
Gefäßsystem
Der vorherrschende Rezeptorsubtyp in Blutgefäßen ist der a1-adrenerge Rezeptor, dessen Aktivierung durch Katecholaminbindung die Aktivierung des intrazellulären Signalwegs Phospholipase-C (PLC), Inositoltriphosphat (IP3) und Diacylglycerin (DAG) bewirkt. Dies führt letztendlich zu einer Kontraktion der Myozyten, einer Vasokonstriktion und einem daraus resultierenden Anstieg des systemischen Blutdrucks.
Herz
Obwohl das Herz myogen ist, dh der Kontraktionsimpuls selbst initiiert wird, wird die Leistung des Herzens vom Zentralnervensystem beeinflusst. Der Nettoeffekt des sympathischen Systems auf das Herz besteht darin, das Herzzeitvolumen zu erhöhen. Die im Herzen vorkommenden adrenergen Rezeptoren gehören zur ß-Rezeptor-Unterfamilie und umfassen ß1- und ß3-Rezeptoren. Die Bindung von Katecholamin an ß1-Rezeptoren im Herzen führt über eine Reihe von Mechanismen zu einer Erhöhung des Herzzeitvolumens: positive chronotrope Effekte, positive inotrope Effekte erhöhten die Automatik und Überleitung sowohl in ventrikulären Myozyten als auch im atrioventrikulären (AV) Knoten. Die ß3-Rezeptoraktivierung antagonisiert jedoch diese Wirkungen, erzeugt einen negativen inotropen Effekt und stellt ein eingebautes Kontrollsystem im Herzen bereit.Ein längerer Anstieg des Katecholaminspiegels im Kreislauf (z. B. bei Sekretion aus Nebennierentumoren oder in Zeiten von Stress) kann zu chronischen Herz-Kreislauf-Problemen wie Bluthochdruck und Herzrhythmusstörungen führen.
Parasympathisches Nervensystem
Das parasympathische System beruht auf der Bindung des Neurotransmitters Acetylcholin (Ach) an Muskarinrezeptoren und spielt im ganzen Körper verschiedene Rollen.
Gefäßsystem
Obwohl Blutgefäße Muskarinrezeptoren exprimieren, erhalten sie keine cholinerge Innervation; Die Anwendung von exogenem Ach führt jedoch zu einer schnellen und tiefgreifenden Vasodilatation.
Herz
Die Aktivierung von Muskarinrezeptoren (M2-Subtyp) im Herzen durch Ach, das vom Vagusnerv freigesetzt wird, bewirkt eine Verringerung des Herzzeitvolumens durch entgegengesetzte Effekte zur adrenergen Stimulation: negative chronotrope Effekte und Abnahme der AV-Knotenleitung sowie Verringerung der Kraft der Vorhofkontraktionen.
Thrombozyten- / Gerinnungssystem
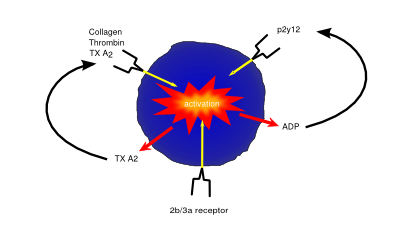
Die Aktivierung und Hemmung von Blutplättchen erfolgt über Oberflächenrezeptoren auf Blutplättchen. Rückkopplungsschleifen verstärken die Thrombozytenaktivierung (z. ADP, das von Thrombozyten freigesetzt wird, erhöht die Thrombozytenaktivierung durch den ADP-Rezeptor)
Thrombozyten (auch Thrombozyten genannt) sind kleine Zellen ohne Kerne, die für die Hämostase oder Blutgerinnung verantwortlich sind. Es werden Schäden oder Verletzungen festgestellt, die zu Blutverlust und Exposition von extrazellulären Kollagenfasern führen, wodurch Blutplättchen aktiviert werden. Einmal aktiviert, werden Blutplättchen adhäsiv, kleben sowohl an der beschädigten Gefäßwand als auch aneinander und bilden einen Zellklumpen oder ein Gerinnsel, das hilft, das Gefäßleck zu beschädigen. Sie beginnen dann, Zytokine abzusondern, die die Invasion von Fibroblasten im umgebenden Gewebe fördern, die ein dauerhafteres Pflaster bilden, indem sie entweder gesundes Gewebe erzeugen oder extrazelluläre Matrix ablagern, um eine Narbe zu bilden.
Es gibt verschiedene Zustände, bei denen eine abnormale Gerinnung den Körper schädigen kann; Eine übermäßige Gerinnung kann zu Gefäßblockaden und Ischämie oder Schlaganfall führen; Seltener kann eine mangelhafte Gerinnung zu einem übermäßigen Blutverlust führen, beispielsweise bei Hämophilie. Um diese Krankheiten zu bekämpfen, gibt es Medikamente, die den Gerinnungsprozess modulieren.
Antikoagulanzien
gerinnungshemmende Medikamente (Antikoagulanzien) sind wichtig bei Patienten mit einem erhöhten Risiko für gerinnungsbedingte Schäden wie Schlaganfall oder Ischämie.Aspirin ist nicht nur ein Analgetikum und Antipyretikum, sondern auch ein Antithrombotikum, das in niedrigen Dosen an Personen verabreicht wird, bei denen das Risiko einer Gerinnungsschädigung besteht (z. B. nach einem Herzinfarkt). Die gerinnungshemmenden Wirkungen von Aspirin beruhen auf der Unterdrückung wichtiger gerinnungsfördernder Faktoren wie Prostaglandine und Thromboxane durch irreversible Inaktivierung des PTGS-Cyclooxygenase-Enzyms. Diese Unterdrückung von Faktoren wie Thromboxan A2 reduziert die Thrombozytenaggregation und verhindert so die Gerinnselbildung.
P2Y12-Inhibitoren wie Clopidogrel üben ihre gerinnungshemmende Wirkung über die Hemmung des P2Y12-Subtyps des Plättchen-ADP-Rezeptors aus. Durch die Blockierung von P2Y12 verhindern diese Arzneimittel die Aktivierung von Blutplättchen und die Bildung des für die Gerinnung erforderlichen Fibrinnetzwerks.
Arzneimittel wie Abciximab und Tirofiban verhindern die Gerinnung durch Hemmung des Glykoprotein-IIb / IIIa-Rezeptors, wodurch sowohl die Thrombozytenaktivierung als auch die Aggregation verhindert werden.
Pharmakokinetik
Bei der Verabreichung von Arzneimitteln an einen Patienten ist es wichtig, mehrere Fakten über das Arzneimittel zu kennen, um die Wirksamkeit zu maximieren und Nebenwirkungen / Toxizität zu minimieren. Dazu gehören Informationen darüber, welche Dosis wirksam ist, wie lange das Medikament im Körper aktiv bleibt, wie schnell es abgebaut / aus dem Körper entfernt wird und wie leicht der Körper dieses Medikament aufnehmen / verwenden kann. In der folgenden Tabelle sind diese pharmakokinetischen Eigenschaften und ihre Berechnung aufgeführt:
| Eigenschaft | Beschreibung | Standardeinheiten (Abkürzung) | Formel |
|---|---|---|---|
| Dosis | Menge des dem Patienten verabreichten Wirkstoffs | mg (D) | Arzneimittelspezifisch (Aus klinischen Studien) |
| Konzentration | Menge des Arzneimittels in einem bestimmten Plasmavolumen | µg/ ml (C) | = D / Vd |
| EC50 | Die Konzentration des Arzneimittels, die benötigt wird, um eine Reaktion auf halbem Weg zwischen null und maximalem Ansprechen hervorzurufen. | µg/ ml (EC50) | y = unten + (Oben-unten)/(1+ Hill-Koeffizient) |
| Verteilungsvolumen | Das theoretische Volumen, das das Arzneimittel einnehmen würde, wenn es gleichmäßig im Gewebe verteilt wäre, um die aktuelle Plasmakonzentration zu ermitteln. | L (Vd) | D / C |
| Eliminationskonstante (Rate) | Die Rate, mit der das Medikament aus dem Körper entfernt wird. | h-1 (Ke) | ln(2) / t1/2 oder CL / Vd |
| Bioverfügbarkeit | Wie viel der verabreichten Dosis für die tatsächliche Verwendung durch den Körper verfügbar ist. | keine Einheiten als Ausdruck einer Fraktion (f) | 100 × (AUC (po)×D (iv))/(AUC (iv)×D (po))
AUC = Fläche unter der Kurve po = orale Verabreichung iv = intravenöse Verabreichung |
| Cmax oder Cmin | Die maximale (Cmax) / minimale (Cmin) Plasmakonzentration, die nach Verabreichung des Arzneimittels erreicht wurde | µg/ml (Cmax oder Cmin) | Identifiziert durch direkte Messung von Plasma C |
| tmax | Die Zeit, die ein Arzneimittel benötigt, um nach der Verabreichung Cmax zu erreichen | h (tmax) | Identifiziert durch direkte Messung von Plasma C über zeit |
| Halbwertszeit | Die Zeit, die ein Arzneimittel benötigt, um die Hälfte seiner ursprünglichen Konzentration zu erreichen | h (t1/2) | ln(2) / Ke |
| Arzneimittelclearance | Das Volumen des Plasmas, das über eine festgelegte Zeit vom Arzneimittel gelöscht wurde | l/h (CL) | Vd x Ke oder D / Fläche unter Kurve |
Häufige Arzneimittel-Arzneimittel-Wechselwirkungen
Es ist wichtig, sich der Wechselwirkungen bewusst zu sein, die zwischen gleichzeitig verabreichten Arzneimitteln auftreten können, da sie die Wirksamkeit und / oder Toxizität beeinträchtigen oder unerwünschte Nebenwirkungen Effects. Solche Wechselwirkungen könnten beispielsweise die Arzneimittelabsorption, die Bioverfügbarkeit oder Wirksamkeit von Arzneimitteln beeinflussen oder sich zu unerwünschten Metaboliten verbinden und möglicherweise Auswirkungen auf klinische Analysen haben. Wenn eine Kombination von zwei Arzneimitteln die Wirkung eines oder beider Arzneimittel verringert, wird die Wechselwirkung als antagonistische Wirkung bezeichnet; Wenn jedoch umgekehrt eine Kombination von zwei Arzneimitteln die Wirkung eines oder beider Arzneimittel verstärkt, wird die Wechselwirkung als synergistische Wirkung bezeichnet. Medikamente, die auf das Herz-Kreislauf-System wirken, haben eine hohe Interaktivität, was ein Problem darstellt, da Herz-Kreislauf-Patienten normalerweise mehr als ein Medikament erhalten. Einige häufige Arzneimittelwechselwirkungen im Zusammenhang mit Herz-Kreislauf-Medikamenten sind unten aufgeführt:
| Drug | Drugs that drug action | Drugs that ↓ drug action |
|---|---|---|
| Digoxin |
|
|
| Warfarin |
|
|
| Clopidogrel |
|
|
| Furosemide |
|
|
| ACE Inhibitors |
|
|
| ß-blockers |
|
|
| Statine |
|
|
Es gibt mehrere Mechanismen, durch die Medikamente vom Körper abgebaut werden, normalerweise durch Abbau durch Enzyme. Eine gemeinsame Familie von Enzymen, die am Arzneimittelstoffwechsel beteiligt sind, ist die Cytochrom-P450 (CYP) -Familie; eine große, vielfältige Gruppe von Enzymen, die die Oxidation einer Vielzahl von Substraten fördern, sowohl endogen (z. steroidhormone) und exogene (z. B. Toxine und Drogen). CYP-Enzyme machen bis zu 75% des Arzneimittelstoffwechsels aus und unterstützen einige Arzneimittel bei der Bildung ihrer Wirkstoffe, deaktivieren Arzneimittel jedoch hauptsächlich in inaktive Metaboliten, die ausgeschieden werden sollen. CYP-Enzyme können Arzneimittelwirkungen auf verschiedene Arten beeinflussen; Sie können den Arzneimittelstoffwechsel erhöhen (entweder die Wirkung durch Bildung des aktiven Nebenprodukts erhöhen oder die Wirkung durch Metabolisierung des aktiven Arzneimittels verringern) oder ihre Wirkung kann durch Arzneimittel gehemmt werden, die um den Zugang zum aktiven Zentrum des CYP-Enzyms konkurrieren, wodurch die normale Wechselwirkung zwischen Arzneimittel und Enzym verhindert wird. Viele Medikamente üben ihre Wechselwirkungen mit anderen Medikamenten überinterferenz mit dem CYP-System. Wenn beispielsweise Arzneimittel A durch CYP metabolisiert wird und Arzneimittel B die CYP-Aktivität hemmt, führt die gleichzeitige Verabreichung zu einer verminderten Bioverfügbarkeit von Arzneimittel A. Beim Menschen gibt es 18 Familien und 43 Unterfamilien der CYP-Gruppe von Enzymen, die auf verschiedene Substrate abzielen. Einige in der kardiovaskulären Medizin wichtige CYP-Enzyme, ihre kardiovaskulären Arzneimittelsubstrate und einige ihrer Wechselwirkungen sind in der folgenden Tabelle aufgeführt:
| Enzym | Substrate (z.B.) | Inhibitoren (z.B.) | Induktoren (z.B.) |
|---|---|---|---|
| c |
|
Anti-convulsants (Valproate) |
|
| c | c |
|
|
| CYP2C9 |
|
|
|
| CYP2D6 |
|
|
|
Zusätzlich zu Arzneimittelwechselwirkungen werden die Wirkungen vieler Arzneimittel auch durch Lebensmittel oder Getränke beeinflusst. Zum Beispiel sollte beim Alkoholkonsum mit vielen Arten von Drogen Vorsicht walten gelassen werden, da dies die Leber belasten kann, die bereits hart daran arbeitet, Medikamente im Körper zu verstoffwechseln. Grapefruitsaft kann auch Probleme verursachen, da bekannt ist, dass er CYP3a hemmt. Weitere Informationen zu Wechselwirkungen zwischen Medikamenten und Lebensmitteln / Getränken finden Sie in diesem Handbuch: Allgemeine Verwendung der Medizin
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Böhm M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T, Køber L, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA, Rønnevik PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J , Trindade PT, Voors AA, Zannad F, Zeiher A, und Ausschuss für Praxisrichtlinien.. ESC-Leitlinien für die Diagnose und Behandlung von akuter und chronischer Herzinsuffizienz 2012: Die Task Force für die Diagnose und Behandlung von akuter und chronischer Herzinsuffizienz 2012 der Europäischen Gesellschaft für Kardiologie. Entwickelt in Zusammenarbeit mit der Heart Failure Association (HFA) des ESC. Eur Herz J. 2012 Juli;33(14): 1787-847. DOI:10.1093/eurheartj/ehs104 / PubMed IDENTIFIKATION:22611136
- Rydén L, Standl E, Bartnik M, Van den Berghe G, Betteridge J, de Boer MJ, Cosentino F, Jönsson B, Laakso M, Malmberg K, Priori S, Ostergren J, Tuomilehto J, Thrainsdottir I, Vanhorebeek I, Stramba-Badiale M, Lindgren P, Qiao Q, Priori SG, Blanc JJ, Budaj A, Camm J, Dean V, Deckers J, Dickstein K, Lekakis J, McGregor K, Metra M, Morais J, Osterspey A, Tamargo J, Zamorano JL, Deckers JW, Bertrand M, Charbonnel B, Erdmann E, Ferrannini E, Flyvbjerg A, Gohlke H, Juanatey JR, Graham I, Monteiro PF, Parhofer K, Pyörälä K, Raz I, Schernthaner G, Volpe M, Wood D, Task Force on Diabetes und Herz-Kreislauf-Erkrankungen der Europäischen Gesellschaft für Kardiologie (ESC). und der European Association for the Study of Diabetes (EASD).. Richtlinien zu Diabetes, Prädiabetes und Herz-Kreislauf-Erkrankungen: Zusammenfassung. Die Task Force on Diabetes and Cardiovascular Diseases der Europäischen Gesellschaft für Kardiologie (ESC) und der European Association for the Study of Diabetes (EASD). Eur Herz J. 2007 Jan;28(1):88-136. DOI:10.1093/eurheartj/ehl260 / PubMed IDENTIFIKATION:17220161
- Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren M, Albus C, Benlian P, Boysen G, Cifkova R, Deaton C, Ebrahim S, Fischer M, Germano G, Hobbs R, Hoes A, Karadeniz S, Mezzani A, Prescott E, Ryden L, Scherer M, Syvänne M, Scholte op Reimer WJ, Vrints C, Holz D, Zamorano JL, Zannad F, Europäische Vereinigung für kardiovaskuläre Prävention & Rehabilitation (EACPR)., und Ausschuss für Praxisrichtlinien (CPG).. Europäische Leitlinien zur Prävention kardiovaskulärer Erkrankungen in der klinischen Praxis (Version 2012). Die fünfte Gemeinsame Task Force der Europäischen Gesellschaft für Kardiologie und anderer Gesellschaften zur Prävention kardiovaskulärer Erkrankungen in der klinischen Praxis (bestehend aus Vertretern von neun Gesellschaften und eingeladenen Experten). Eur Herz J. 2012 Juli;33(13): 1635-701. DOI: 10.1093/ eurheartj/ ehs092 / PubMed ID: 22555213
- Task Force zur Behandlung des akuten Myokardinfarkts mit ST-Segmenterhöhung der Europäischen Gesellschaft für Kardiologie (ESC)., Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati A, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, van ‚t Hof A, Widimsky P, und Zahger D. ESC Richtlinien für die Behandlung des akuten Myokardinfarkts bei Patienten mit ST-Segmenterhöhung. Eur Herz J. 2012 Oktober;33(20): 2569-619. DOI:10.1093/eurheartj/ehs215 / PubMed IDENTIFIKATION:22922416
- Blomström-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, Camm AJ, Campbell WB, Haines DE, Kuck KH, Lerman BB, Miller DD, Shaeffer CW Jr, Stevenson WG, Tomaselli GF, Antman EM, Smith SC Jr., Alpert JS, Faxon DP, Fuster V, Gibbons RJ, Gregoratos G, Hiratzka LF, Hunt SA , Jacobs AK, Russell RO Jr, Priori SG, Blanc JJ, Budaj A, Burgos EF, Cowie M, Deckers JW, Garcia MA, Klein WW, Lekakis J, Lindahl B, Mazzotta G, Morais JC, Oto A, Smiseth O, Trappe HJ, Amerikanisches College für Kardiologie., American Heart Association Task Force für Praxisrichtlinien., und Ausschuss der Europäischen Gesellschaft für Kardiologie für Praxisrichtlinien. Schreibausschuss zur Entwicklung von Richtlinien für die Behandlung von Patienten mit supraventrikulären Arrhythmien.. ACC / AHA / ESC-Richtlinien für das Management von Patienten mit supraventrikulären Arrhythmien – Zusammenfassung: ein Bericht des American College of Cardiology / American Heart Association Task Force für Praxisrichtlinien und des Ausschusses der Europäischen Gesellschaft für Kardiologie für Praxisrichtlinien (Schreibausschuss zur Entwicklung von Richtlinien für das Management von Patienten mit supraventrikulären Arrhythmien). Durchblutung. 2003 Oktober 14;108(15): 1871-909. DOI:10.1161/01.CIR.0000091380.04100.84 / PubMed ID:14557344
- Europäische Vereinigung für kardiovaskuläre Prävention & Rehabilitation., Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, Agewall S, Alegria E, Chapman MJ, Durrington P, Erdine S, Halcox J, Hobbs R, Kjekshus J, Filardi PP, Riccardi G, Storey RF, Holz D, und ESC Ausschuss für Praxisrichtlinien (CPG) 2008-2010 und 2010-2012 Ausschüsse.. ESC/EAS-Leitlinien für die Behandlung von Dyslipidämien: die Task Force für das Management von Dyslipidämien der Europäischen Gesellschaft für Kardiologie (ESC) und der Europäischen Atherosklerose-Gesellschaft (EAS). Eur Herz J. 2011 Juli;32(14): 1769-818. DOI:10.1093/eurheartj/ehr158 / PubMed ID:21712404
Alle Medline-Abstracts: PubMed
