Einleitung
Zytotoxische Zellen sind integraler Bestandteil im Kampf gegen virusinfizierte und Krebszellen. Diese Zellen töten durch drei verschiedene Wege, die Freisetzung von lytischen Granulaten, den Fas-Rezeptor-Ligand-Weg oder den TRAIL–TRAIL-Rezeptor-Weg. Für den Zweck dieses Papiers, Wir werden uns auf die Degranulation konzentrieren. Wenn eine zytotoxische Zelle auf eine Zielzelle trifft, haftet sie fest daran und bildet die Immunsynapse. Das lytische Granulat wird dann in Richtung der immunologischen Synapse polarisiert und aus der auf das Ziel (1) gerichteten zytotoxischen Zelle freigesetzt. Diese Granulate enthalten verschiedene zytotoxische Mediatoren wie Perforin und Granzyme. Freigesetztes Perforin kann vorübergehende Poren innerhalb der Zielzellmembran bilden, so dass Granzyme in die Zielzelle gelangen können. Der Eintritt wird wahrscheinlich auch durch Perforinoligomere vermittelt, die unvollständige Poren (Bögen) bilden (2), und es wurde auch vorgeschlagen, dass Granzyme und Perforin über den endosomalen Weg in die Zielzellen aufgenommen werden können (3, 4). Die Daten hinter diesen vorgeschlagenen Mechanismen wurden kürzlich ausführlich diskutiert (5). Wenn Granzyme in Zielzellen gelangen, wird der Caspaseweg aktiviert, was zu Apoptose führt (6, 7). Die Membran dieser zytotoxischen Granula enthält lysosomal-assoziiertes Membranglykoprotein-1 (LAMP1), auch bekannt als CD107a (8). Der luminale Teil von Ratten-CD107a wird nach Degranulation vorübergehend der extrazellulären Seite der Zellmembran ausgesetzt, bevor er wieder internalisiert wird. Daher zeigt die CD107a-Färbung an, dass ein Degranulationsereignis aufgetreten ist (9). Während die Rolle für CD107a noch bestimmt wird, haben siRNA-Studien gegen CD107a gezeigt, dass es für den Perforinhandel innerhalb der Vesikel essentiell ist, da die Abgabe von Perforin an lytische Granula in Abwesenheit von CD107A gehemmt wird (10). Es wurde auch gezeigt, dass CD107a eine Rolle beim Schutz zytotoxischer Zellen vor dem Tod spielt, indem es an Perforin bindet und die Insertion in die Zellmembran verhindert (11).
Es gibt zwei Haupttypen von zytotoxischen Lymphozyten, natürliche Killerzellen (NK) und CD8-T-Zellen. Beide Zelltypen töten durch die Freisetzung von lytischen Granula den Fas-Rezeptor / Fas-Ligandenweg und den TRAIL / TRAIL-Rezeptorenweg ab, aber der zur Aktivierung dieser beiden Zellgruppen erforderliche Stimulus ist unterschiedlich. T-Zellen erkennen das von MHC-Klasse-I-Molekülen präsentierte Antigen über ihren aktivierenden T-Zell-Rezeptor (TCR), während NK-Zellen Zielzellantigene über verschiedene inhibitorische und aktivierende Rezeptoren erkennen. Hemmende Rezeptoren sind wichtig, um zu verhindern, dass NK-Zellen gesunde Zellen abtöten, während aktivierende Rezeptoren die Zytotoxizität von NK-Zellen induzieren.
Vor der Identifizierung von CD107a als Marker für die Degranulation in NK-Zellen (12)war der Ausgang für die Messung der zytotoxischen Fähigkeit der Tod der Zielzellen. Der Nachweis von CD107a durch Durchflusszytometrie ermöglichte es den Forschern, die spezifischen Effektorzellen mit zytotoxischer Fähigkeit zu identifizieren. Seit seiner Entdeckung wurde eine breite Palette von Veröffentlichungen von Daten aus Maus- und Humanstudien abgeschlossen, die den Vorteil der Verwendung eines Anti-CD107a-Antikörpers zeigen. Die Ratte ist ein wertvolles immunologisches Tiermodell zur Untersuchung von Krankheiten wie Leukämie und Graft vs. Wirtskrankheit (13), aber funktionelle Auslesungen wurden durch den Mangel an hochwertigen spezifischen Anti-Ratten-CD107a-Antikörpern für die Durchflusszytometrie behindert. Dieses Papier beschreibt die Schaffung eines Antikörpers gegen Ratte CD107a und Charakterisierung der Degranulationsantwort in Ratte NK und CD8 + T-Zellen.
Materialien und Methoden
Tiere
Armenische Inzuchthamster (Cytogen Research and Development Inc., MA, USA) wurden in Übereinstimmung mit institutionellen Richtlinien in der Abteilung für Vergleichende Medizin am Rikshospitalet des Universitätsklinikums Oslo untergebracht. Die Rattenstämme PVG-RT1U, PVG-RT7b, PVG-RT1N und PVG-R23 wurden austauschbar verwendet und über mehr als 20 Generationen gepflegt und in Übereinstimmung mit den Richtlinien des Experimental Animal Board des norwegischen Landwirtschaftsministeriums und des Europäischen Übereinkommens zum Schutz von Wirbeltieren, die für experimentelle und andere wissenschaftliche Zwecke verwendet werden, untergebracht. Ratten wurden im Alter von 8-12 Wochen verwendet. Die Versuchstiereinrichtungen werden einem routinemäßigen Gesundheitsüberwachungsprogramm unterzogen und gemäß einer Änderung der Empfehlungen der Federation of European Laboratory Animal Science Association auf infektiöse Organismen getestet. Tierversuche wurden durch Laborvorschriften geregelt, die im Tierschutzgesetz festgelegt sind, in dem Norwegen der EU-Laborrichtlinie und dem Europäischen Laborübereinkommen folgt.
Abs und Reagenzien
Antikörper gegen NKp46 , NKR-P1A 3.2.3-PB oder unkonjugiert (Bindung nur NKR-P1A, aber nicht NKR-P1B im PVG-Stamm), CD8 (OX8-Biotin), CD2 (OX34, unkonjugiert), TCR (R73-Alexa647), Maus-IgD-b-Allotyp (TIB96-unkonjugiert, verwendet als Maus-IgG-Isotyp) und CD45.2 (His41-FITC, verwendet als Maus-IgG-Isotyp) wurden in unserem Labor hergestellt und konjugiert nach Standardprotokollen. Antikörper gegen CD3 (IF4, unkonjugiert) und dessen Isotyp Maus-IgM (MM-30, unkonjugiert) und dessen Hamster-IgG-Isotyp-Kontrolle (HTK88-FITC) wurden von Biolegend (San Diego, CA, USA) bezogen. Kommerzielle Anti-CD107a-Antikörper wurden von AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) und Lifespan (Seattle, WA, USA) (LS-C8580-unkonjugiert) erworben. LS-C8580 wurde mit Alexa488 NHS Ester (Sigma-Aldrich, St. Louis, MO, USA) zur Verwendung in funktionellen Assays konjugiert. Anti-FLAG-Antikörper (M2, unkonjugiert) und Anti-Maus-IgG (Ziege polyklonal-FITC) wurden von Sigma-Aldrich (St. Louis, MO, USA) gekauft. IL-2 wurde aus einem dialysierten Zellkulturüberstand einer Ovarialzelllinie des chinesischen Hamsters (CHO) erhalten, die stabil mit einem IL-2-Expressionskonstrukt der Ratte transfiziert war. Peridinin Chlorophyll-a Protein (PerCP) konjugiertes Streptavidin, FITC Hamster IgG polyklonale Isotypkontrolle, FITC Maus IgG1 Isotypkontrolle (MOPC-FITC) und GolgiStop wurden von BD Biosciences (Franklin Lakes, NJ, USA) gekauft. Ziegenanti-armenischer Hamster (Polyklonal-FITC) wurde von Jackson Immunoresearch (West Grove, PA, USA) gekauft. Überstände aus den Hybridomen OX41, CD172a (SIRPa), R73 (Anti-Ratten-TCRaß), OX19 (Anti-CD5), OX12 (Anti-Igk-Kette) und OX33 (Anti-CD45RA) wurden im eigenen Haus hergestellt. Kontrollhamsterserum wurde von nicht immunisierten armenischen Hamstern gewonnen.
Klonierung von Ratten-CD107a
Ratten-CD107a wurde PCR-amplifiziert aus cDNA, die aus PVG-Ratten-Splenozyten erzeugt wurde, und in einen pMX-Expressionsvektor subkloniert, der ein Puromycin-Resistenzgen enthielt (ein großzügiges Geschenk von Dr. Michael R. Daws) (14). CD107-Primer wurden basierend auf einer CD107A (LAMP1)-cDNA-Sequenz der Ratte entwickelt (GenBank: NM_012857). Vorwärts Primer: 5′-GCCCCAGCACTGTTCGAGGT-3′; Umgekehrter Primer: 5′-GTTGTTACCGTCCTGTACACACT-3′. Ein anionisches Trypsin-1-Leader-Peptid (MSALLILALVGAAVA) wurde im Expressionsvektor verwendet, und die ursprüngliche CD107-Transmembranregion wurde durch ein CD8-Transmembranfragment ersetzt, um eine hohe Oberflächenexpression zu ermöglichen. Ein FLAG-Tag (DYKDDDDK) wurde an das N-Terminal des CD107-Proteins ligiert, um die Oberflächenexpression detektierbar zu machen. Alle eingefügten Sequenzen und offenen Leserahmen im endgültigen chimären Plasmidkonstrukt wurden untersucht und durch Sanger-DNA-Sequenzierung bestätigt.
BWZ transfizieren.36 Zellen mit pMX-CD107a Plasmid
293T Zellen wurden in eine 6-well Zellkulturplatte mit 4 ml RPMI 1640 Medium ausgesät, mit 7,5 µl FuGENE6 Reagenz (Roche, manufacturer’s protocol) transfiziert und bei 37°C mit 5% CO2 inkubiert. Das FuGENE6-Reagenz wurde mit Opti-MEM (Gibco) vorverdünnt und mit 1,5 µg PMX-CD107a-Plasmid und 1 µg pCL-ECO nagetierspezifischem retroviralem Verpackungsplasmid (Addgene #12371) gemischt. Vierundzwanzig Stunden nach der Transfektion wurde der Überstand descantiert und durch RPMI1640-Medium mit 2% FBS ersetzt und zur retroviralen Produktion auf 32 ° C überführt. Achtundvierzig Stunden später wurde der Überstand geerntet und mit einem 0,2 µm Filtropur S-Filter (Sarstedt) filtriert und bei -80 °C für die retrovirale Transduktion aufbewahrt.
Der 105 BWZ.36 Zellen wurden pro Well in eine 24-Well Zellkulturplatte (Corning) ausgesät und mit frischem RPMI1640 Medium mit 10% FBS über Nacht kultiviert. Der Überstand wurde entfernt und RPMI1640 enthaltend 10% FBS, 16 µg Polybren (bis zu einer Endkonzentration von 8 µg/ml) und 1,5 ml retroviraler Überstand wurde zugegeben und 2 h bei 32°C bei 2400 rpm zentrifugiert. Anschließend wurden die Zellen 1 h bei 32°C inkubiert, der Überstand entfernt und durch frisches RPMI1640-Medium mit 10% FBS ersetzt und 3 Tage bei 37°C mit 5% CO2 kultiviert (am Tag 2 konnte vollständiges Medium mit 1 ng/ml Puromycin verwendet werden). Expandierte BWZ.CD107a-FLAG-Transfektanten wurden auf Oberflächenexpression des FLAG-Tags untersucht und anschließend zur Antikörperimmunisierung oder Antikörperscreening eingesetzt.
Erzeugen von CD107a-exprimierenden Transfektanten
Das chimäre Ratten-CD107a-Plasmid wurde in CHO-Zellen transfiziert. Kurz gesagt wurden CHO-Zellen in vollständigem RPMI1640-Medium (cRPMI; RPMI1640-Medium mit 10% FBS, 1 mm Na-Pyruvat, 50 Μm 2-Mercaptoethanol) kultiviert, bis sie eine Konfluenz von 30% erreichten. Das 2,5 µg Plasmid wurde mit 7,5 µl Fugene 6 Reagenz (Roche) gemischt und auf Zellen getropft. Zwei Tage später wurden die CHO-Zellen mit RPMI1640-Medium, ergänzt mit 2mM EDTA, abgetrennt und in 96-Well-Flachboden-Zellkulturplatten (25 Zellen / Well) mit Selektionsmedium (cRPMI, ergänzt mit 20 µg / ml Puromycin) zur Klonierung stabiler Transfektanten ausgesät. Nach 10-12 Tagen Kultur wurden erwachsene Klone mit Anti-FLAG-Antikörper (M2) gescreent. Einer der Klone, die das höchste Oberflächenniveau von FLAG und CD107a exprimierten, wurde für Immunisierungen verwendet.
Immunisierung und Zellfusion
Die 3 bis 10 Wochen alten männlichen armenischen Inzuchthamster wurden durch intraperitoneale Injektionen (i.p.) mit 2 × 106 CHO.CD107a-FLAG-Zellen einmal wöchentlich für 3 Wochen immunisiert. Ein Boost mit 4 × 106 stabil transfizierten BWZ.CD107a-FLAG Zellen wurde i.p. 32 Tage nach der ersten Immunisierung gegeben und die Seren wurden auf Oberflächenfärbung von CHO.CD107a-FLAG und BWZ analysiert.CD107a-FLAG-Transfektanten. Zwei der drei Tiere waren positiv, und 3 Tage nach der Steigerung wurden Milzzellen geerntet und von den beiden Tieren gepoolt, von denen eines Splenomegalie aufwies. Etwa 2,0×108 Milzzellen und 1,4×108 NS0 Myelomzellen wurden dreimal in DMEM mit Additiven (1mM Natriumpyruvat, 0,05mM 2-Mercaptoethanol und Antibiotikum/Antimykotikum) gewaschen und 10 min bei 90 g zentrifugiert. Ab diesem Zeitpunkt wurde alles bei 37 ° C gehalten, das Pellet durch Klopfen in das Rohr gelöst und vorgewärmtes Polyethylenglykol 1500 (Roche) unter leichtem Rühren für 1 min tropfenweise zugegeben. Drei Milliliter DMEM mit Additiven wurden nach und nach für die nächsten 3 min zugegeben und mit weiteren 7 ml vorzentrifugiert bei 500 g. Das Pellet wurde durch vorsichtiges Spülen (keine Resuspension) mit DMEM mit Additiven und 20% FBS (DMEM-20) gewaschen und über Nacht kultiviert. Die Zellen wurden am folgenden Tag geerntet und 100 ml DMEM-20 mit 2× Hypoxanthin–Aminopterin–Thymidin (SIGMA) und 10% Hybridoma Cloning Supplement (HCS) (PAA) zugegeben. Die Zellsuspension wurde auf 96-Well-Platten transferiert. Nach 12 Tagen wurden Überstände von wachsenden Klonen durchflusszytometrisch auf Färbung von Oberflächenantigenen, die auf BWZ.CD107a-FLAG und CHO.CD107a-FLAG vorhanden waren, aber nicht auf BWZ, getestet.36 Zellen, die mit irrelevanten FLAG-markierten Antigenen als Negativkontrollen transfiziert wurden. Die 9 von 12 positiven Klonen, die spezifische Antikörper produzierten, wurden unter Verwendung von DMEM-20, ergänzt mit Hypoxanthin-Thymidin und HCS, weiter subkloniert. Nur ein Klon (SIM1) produzierte nach der Subklonierung noch Antikörper und dieser wurde noch einmal subkloniert. CD107a-spezifische Hamster-IgG-Antikörper wurden durch FITC anti-Armenian Hamster IgG (Jackson Immunoresearch) nachgewiesen. Anti-CD107a aus dem SIM1-Hybridom wurde mittels HiTrap Protein G HP (GE Healthcare, Life Sciences) gereinigt und FITC-konjugiert nach Standardverfahren oder Alexa488-konjugiert nach Herstellerprotokoll.
Erzeugung von Effektorzellen
Aus der Milz wurden Einzelzellsuspensionen hergestellt. Lymphozyten wurden unter Verwendung eines Lymphoprep-Gradienten isoliert und dann über eine Nylonwollsäule geführt, um B-Zellen und Makrophagen zu entfernen. Zur Erzeugung von IL-2-aktivierten NK-Zellen (LAK) wurden die restlichen Zellen über Nacht in IL-2 kultiviert. Am folgenden Tag wurden nicht adhärente Zellen durch Waschen mit PBS entfernt und die adhärenten NK-Zellen wurden in RPMI gehalten, das mit IL-2, 10% hitzeinaktiviertem FBS, 1% Streptomycin / Penicillin, 1 mm Natriumpyruvat und 50 µM 2-Mercaptoethanol ergänzt wurde. Die Zellen wurden 8-10 Tage kultiviert. Zur Erzeugung von angereicherten NK-Zellen oder sortierten T- und NK-Zellen wurden Zellen nach dem Nylonwollschritt durch negative Selektion angereichert. Zur Anreicherung von NK-Zellen wurden Pan-Maus-IgG-Dynabeads (Invitrogen Dynal) mit Antikörpern gegen Makrophagen (OX41), T-Zellen (R73 und OX19) und B-Zellen (OX12 und OX33) beschichtet. Zur Anreicherung von T-Zellen wurden Pan-Maus-IgG-Dynabeads mit Antikörpern gegen Makrophagen (OX41) und B-Zellen (OX12 und OX33) angefärbt. Die Zellen wurden durch zwei Schritte negativer Selektion mit gefärbten Kügelchen für 30 min bei 4°C angereichert. Angereicherte NK-Zellen hatten eine Reinheit von ungefähr 50-60% und wurden für Degranulationsstudien verwendet. Angereicherte T-Zellen (79-85% Reinheit) wurden mit einem FACS Aria (BD Biosciences) weiter nach TCR+ -Zellen sortiert.
Degranulationstests
Um die Degranulationsreaktion durch Färbung mit Anti-Ratten-CD107a (SIM1) während der Zielzellstimulation zu messen, wurden NK-Effektoren und YAC-Zielzellen in einem Verhältnis von 1 zu 1 von 3 × 105 Zellen / Well (sofern nicht anders angegeben) in Medien inkubiert, die den SIM1-mAk, die anderen kommerziell erhältlichen Anti-CD107a-Antikörper oder die Isotypenkontrolle enthielten. Um die Degranulationsreaktion auf Antikörperstimulation von NK-Zellen zu messen, verwendeten wir 96-Well-Platten mit flachem Boden, die mit unterschiedlichen Konzentrationen von Anti-NKP46 (Wen23), Anti-NKR-P1A (3.2.3) und einer Maus-IgG1-Isotypkontrolle (TIB96) beschichtet waren. Am folgenden Tag wurden die Platten mit PBS gewaschen und mit cRPMI blockiert, bevor pro Vertiefung 3 × 105 angereicherte NK-Zellen, suspendiert in CRPMI enthaltend SIM1, zugegeben wurden. Um die Degranulation von T-Zellen zu messen, wurden sie sortiert und in cRPMI mit IL-2 für 2-3 Tage kultiviert. Die 96-Well-Flachbodenplatten wurden über Nacht mit Antikörpern gegen CD3 (IF4), CD2 (OX34) oder eine IgM-Isotypkontrolle (MM-30) beschichtet. Etwa 3 × 105 T-Zellen wurden pro Vertiefung in CRPMI mit SIM1 zugegeben. Alle Assays wurden für 4 h inkubiert. Golgistop wurde für die letzten 3 h Inkubation zugegeben, um den Abbau von internalisiertem CD107a zu verhindern. Die Zellen wurden dann gewaschen und mit Antikörpern gegen die entsprechenden Oberflächenrezeptoren gefärbt und mit dem FACS Canto oder LSR II (BD Biosciences) analysiert.
Chromium Release Assay
YAC-1-Zielzellen (5 × 106 Zellen/ml cRPMI) mit zusätzlichem 3.7 MBq51Cr wurden 1 h bei 37°C unter Rühren alle 15 min inkubiert. Anschließend wurden die Zellen dreimal mit PBS mit 2% FBS gewaschen und zu 1×105 Zellen/ml in cRPMI resuspendiert. LAK-Effektorzellen und Zielzellen wurden in den angegebenen Verhältnissen in einem Endvolumen von 200 µl plattiert. Die Zellen wurden zentrifugiert und 4 h bei 37°C inkubiert. Die spezifische Freisetzung von 51Cr wurde mit dem Cobra Auto-Gamma (Packard) gemessen.
Ergebnisse
Um einen Antikörper gegen CD107a herzustellen, erstellten wir einen Expressionsvektor, der die extrazelluläre Membranregion von Ratte CD107a, die Transmembranregion von Ratte CD8 und einen 3′-terminalen FLAG-Tag zum Nachweis der Oberflächenexpression enthielt (Abbildung 1A). Der Vektor wurde in CHO-Zellen und die BWZ transfiziert.36 T-Zelllinie und auf CD107a-Expression unter Verwendung eines Anti-FLAG-Antikörpers (M2) gescreent (Abbildung 1B). CD107a stabil transfizierte CHO-Zellen wurden armenischen Inzuchthamstern einmal wöchentlich für 3 Wochen injiziert, wobei CD107a stabil transfizierte BWZ-Zellen 3 Tage vor der Fusion mit der NS0-Myelomzelllinie endgültig verstärkt wurden. Überstände aus den verschiedenen Klonen wurden auf Spezifität gegenüber BWZ.CD107a-FLAG, aber nicht gegenüber FLAG-markiertem BWZ getestet.36 Transfektanten. Es wurde festgestellt, dass ein Klon, SIM1, spezifisch an das CD107a-exprimierende Transfektant bindet, jedoch nicht an die FLAG-transfizierte Kontrolle (Abbildung 1C).

Abbildung 1. Erzeugung eines monoklonalen Anti-Ratten-CD107a-Antikörpers (SIM1). (A) Schematische Vektorkarte des pMX-Expressionsvektors mit Leader-Peptid, FLAG-Tag, CD107a-Insert und der Transmembrandomäne von CD8. (B) Stabil transfizierter Eierstock des chinesischen Hamsters und BWZ.36 Zellen wurden auf Zelloberflächenexpression von FLAG-markiertem CD107a unter Verwendung eines Anti-FLAG-Antikörpers (M2) getestet (schattierte Histogramme). Die Negativkontrolle ist ein sekundärer Antikörper allein (transparentes Histogramm). (C) BWZ-Zellen, die mit CD107a-FLAG oder irrelevantem Antigen (NKR-P1F-FLAG) transfiziert wurden, wurden mit Hamsterkontrollserum, SIM1-Überstand oder einem Anti-FLAG-Antikörper (M2) gefärbt.
Der Klon SIM1 wurde weiter in funktionellen Assays parallel mit zwei kommerziell erhältlichen CD107a Antikörpern getestet, die potentiell mit Ratten-CD107a in der Durchflusszytometrie kreuzreagieren könnten. Die getesteten Antikörperklone waren H4A3 von AbCam (das in der Durchflusszytometrie mit Mensch, Ratte, Maus und Primaten kreuzreagiert) und der Antikörperklon LS-C8580 von LifeSpan BioSciences (der in der Immunhistochemie und Western Blots gemäß der Website des Herstellers mit CD107a von Maus, Mensch und Ratten kreuzreagiert). Unser SIM1-Antikörperklon identifizierte degranulierende Zellen in Gegenwart von Zielzellen und zeigte in Abwesenheit von Zielzellen nur eine geringe Hintergrundfärbung (Abbildung 2A oben). Klon H4A3 färbte den höchsten Prozentsatz an NK-Zellen nach Zielzellstimulation (mittleres Feld). Es gab jedoch auch ein hohes Maß an Hintergrundfärbung in Abwesenheit von Zielzellen, was auf eine unspezifische Bindung hinweist. Mit dem MAB-Klon LS-C8580 (untere Tafel) wurden, falls vorhanden, sehr geringe Degranulationsgrade gemessen. Die Spezifität dieser Antikörper wurde durch positive Färbung des BWZ.CD107a-FLAG-Transfektanten bestätigt, nicht jedoch durch BWZ.NKR-P1F-FLAG-Steuerung (Abbildung 2B). Der Antikörperklon H4A3, von dem gezeigt wurde, dass er an humanes CD107a bindet (16), färbte keine mit Ratten-CD107a transfizierten BWZ-Zellen, was darauf hinweist, dass keine Kreuzreaktion mit Ratten-CD107a vorliegt. Der Anti-Maus-CD107a-Klon ID48 verfärbte auch nicht das Ratten-CD107a-Transfektant. Unkonjugiertes LS-C8580 hingegen zeigte eine spezifische Färbung von CD107a-transfizierten Zellen (Daten nicht gezeigt). Der LS-C8580-Klon ist jedoch nur als unkonjugierter Antikörper erhältlich, der nicht für Degranulationsstudien geeignet ist. Wiederholte Versuche in unserem Labor, LS-C8580 mit Alexa488 zu konjugieren, haben leider keine starken Färbekonjugate geliefert, obwohl die geringe Probengröße und Konzentration von LS-C8580 die Ursache für die schlechte Konjugation sein kann. Konjugiertes LS-C8580 zeigt eine reduzierte, aber spezifische Färbung von CD107a-transfizierten Zellen (Abbildung 2B), aber wie in Abbildung 2A gezeigt, konnten wir degranulierende Zellen während funktioneller Assays mit diesem Konjugat nicht nachweisen. Zusammenfassend färbt der SIM1-mAb nach Stimulation mit Zielzellen spezifisch degranulierende Ratten-NK-Zellen.

Abbildung 2. SIM1 misst die Degranulation von natürlichen Killer- (NK) und CD8-T-Zellen. (A) Prozentuale degranulierende Zellen wurden unter Verwendung der Anti-CD107a-Antikörper SIM1, H4A3 und LS-C8580 mit oder ohne YAC-1-Zielzellen als Stimulus gemessen. Ein repräsentatives Experiment von vier ist gezeigt (B). Färbung der BWZ.CD107a-FLAG-Zelllinie mit SIM1-, H4A3-, LS-C8580- oder ID48-Antikörperklonen. BWZ.36 zellen transfiziert mit einem FLAG-markierten Antigen (BWZ.NKR-P1G-FLAG) wurde als Negativkontrolle eingeschlossen, (C) angereicherte NK-Zellen wurden mit plattengebundenem Anti-NKp46, Anti-NKR-P1A oder Maus-IgG1 als Isotypkontrolle stimuliert, und SIM1 wurde verwendet, um prozentuale degranulierende Zellen zu messen. NKp46+ (Wen23) oder NKR-P1Abright (3.2.3) Zellen wurden mit einem Gatter versehen. (D) TCR+ -Zellen wurden sortiert (Reinheit 99%) und 2-3 Tage in IL-2 kultiviert. Die Zellen wurden dann mit plattengebundener Anti-CD3- und Anti-CD2- oder Maus-IgM-Isotyp-Kontrolle für Anti-CD3 stimuliert. Das untere Panel zeigt die Stimulation mit Anti-CD3 und Anti-CD2 und die Färbung mit einer SIM1-Isotypkontrolle (FITC Hamster IgG polyklonal). T-Zellen wurden unter Verwendung von R73-Alexa647- und 3.2.3−PB-Antikörpern sortiert, wobei R73 + / 3.2.3- Zellen angetastet wurden. Die gezeigten Daten stammen aus einem repräsentativen Experiment von drei separaten unabhängigen Experimenten.
Die direkte Stimulation der Aktivierung von NK-Rezeptoren durch plattengebundene Antikörper ist eine weitere wirksame Methode zur Induzierung der Degranulation. Um den SIM1-Klon in diesem funktionellen Assay zu testen, inkubierten wir angereicherte NK-Zellen auf Platten, die mit Antikörpern gegen die aktivierenden Rezeptoren NKp46 und NKR-P1A beschichtet waren (Abbildung 2C). Als Negativkontrolle wurden Platten mit Maus-IgG1-Isotyp-Kontrolle beschichtet. Die Färbung mit dem SIM1-Antikörper identifizierte 25,5 bzw. 44% degranulierende Zellen nach NK-Zell-Stimulation in Platten, die mit 5 µg/ml Anti-NKp46 bzw. Anti-NKR-P1A beschichtet waren. Der Anteil degranulierender Zellen stieg noch weiter an, wenn die Platten mit einer höheren Konzentration stimulierender Antikörper (10 µg/ml) beschichtet wurden. In Wells, die mit der Maus-IgG1-Isotyp-Kontrolle beschichtet waren, wurde keine Degranulation induziert.
Wir sahen deutlich eine Degranulation in NK-Zellen, die entweder mit Zielzellen oder mit Antikörpern gegen Aktivierungsrezeptoren unter Verwendung unseres SIM1-Antikörpers stimuliert wurden. Wir wollten dies auch in zytotoxischen T-Zellen bestätigen. T-Zellen wurden aus Milzzellen sortiert und 2-3 Tage in IL-2 kultiviert. Die T-Zellen wurden dann mit plattengebundenem Anti-CD3 und Anti-CD2 stimuliert (Abbildung 2D). Die Degranulation wurde an kultivierten CD8 + T-Zellen gemessen, wenn sie an beiden Tagen 2 und 3 mit Anti-CD3 und Anti-CD2 stimuliert wurden. Es wurde keine Degranulation von nicht zytotoxischen CD4-T-Zellen oder nach Stimulation mit Isotyp-Kontroll-Antikörper gemessen, was die Spezifität unseres SIM1-Antikörpers weiter demonstriert.Lymphokin-aktivierte Killer (LAK) -Zellen werden durch Kultivierung von NK-Zellen in IL-2 für 7-10 Tage erzeugt und werden üblicherweise als sehr starke Effektorzellen in Chromfreisetzungstests zur Untersuchung der Zytotoxizität verwendet und sollten daher in der Lage sein, ein hohes Maß an Degranulation zu erzeugen. Um die Degranulation von LAK-Zellen zu messen, Wir verwendeten zunächst a 1:1 Verhältnis von Effektor zu Zielen, jedoch unerwartet niedrige Degranulationsgrade (Daten nicht gezeigt). Bei einer Titration, um optimale Effektor-zu-Ziel-Verhältnisse zu finden, konnten wir jedoch feststellen, dass ein zunehmender Grad an Degranulation erreicht werden konnte, wenn die Effektor-zu-Ziel-Verhältnisse unter 1 lagen (Abbildung 3A). Das optimale Verhältnis für Degranulationstests steht daher im Gegensatz zu Zytotoxizitätstests, bei denen der Grad der Zytotoxizität mit höheren Effektor: Ziel-Verhältnissen zunimmt (Abbildung 3B).
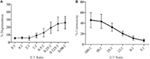
Abbildung 3. Niedriger Effektor:zielverhältnisse sind wichtig, um eine ausreichende Empfindlichkeit in Degranulationstests mit Ratten-NK-Zellen sicherzustellen. (A) Degranulation von LAK-Zellen, die 8-10 Tage in IL-2 gegen YAC-1-Ziele bei unterschiedlichen Effektor: Ziel-Verhältnissen kultiviert wurden. (B) Die Zytotoxizität von IL-2-kultiviertem LAK gegen YAC-1-Zielzellen wurde mit dem an den Tagen 8-10 abgeschlossenen Chromfreisetzungstest bestätigt. Alle Diagramme bestehen aus drei oder mehr separaten Experimenten mit Balken, die SD anzeigen.
Diskussion
Bei den ersten Tests von SIM1 und den verschiedenen kommerziellen CD107a-Antikörpern in Degranulationstests an der Ratte wählten wir einen kleinen Bereich von Effektor- zu-Ziel-Verhältnissen mit einer Neigung zu mehr Effektorzellen als Targets basierend auf der aktuellen Literatur (12, 16, 17). Effektor-zu-Ziel-Zellverhältnisse können von Papier zu Papier variieren, aber frühere Studien, die Effektor-zu-Ziel-Verhältnisse titrierten, haben gezeigt, dass die optimale Degranulation von Maus-NK-Zellen im Verhältnis 4,5: 1 mit YAC-1-Zielzellen ihren Höhepunkt erreichte (18) und menschliche NK-Zellen töteten K562-Zellen am besten in einem Verhältnis von 5: 1 oder 10:1 (12). Bei Verwendung eines größeren Bereichs von Effektor- zu-Ziel-Verhältnissen zeigen wir jedoch, dass die Degranulation mit Ratten-LAK-Zellen effektiver induziert wurde, wenn vier oder mehr Ziele pro Effektorzelle verwendet wurden. Dieser Unterschied im optimalen Effektor: Ziel-Verhältnis zwischen der Ratte und anderen Spezies könnte auf die Art der verwendeten Zielzellen zurückzuführen sein, da die menschlichen und Maus-Effektor-Ziel-Verhältnis-Titrationen in den oben genannten Studien Zielzellen verwendeten, die von derselben Spezies stammten. Die Effektorzellen sind möglicherweise empfindlicher gegenüber Zielzellen derselben Spezies und benötigen daher weniger Zielzellen, um aktiviert zu werden. Die in unserer Studie verwendete YAC-1-Zelllinie ist ein Maus-T-Zell-Lymphom, das seit vielen Jahren der Standard zur Stimulierung der Zytotoxizität von Ratten-NK-Zellen ist. Wir können nicht ausschließen, dass die Verwendung einer Rattenzielzelle zu einer stärkeren Stimulation der NK-Zellen führt und anschließend weniger Zielzellen benötigt werden, um die Degranulation zu induzieren.
Aus dieser Studie geht auch hervor, dass die für Zytotoxizitätstests verwendeten Effektor-Ziel-Verhältnisse nicht gut mit den Verhältnissen korrelieren, die zur Messung der optimalen Degranulationsreaktion in den Effektorzellen erforderlich sind. Dies ist nicht überraschend, da die Ergebnisse für diese beiden Assays unterschiedlich sind, wobei die Zytotoxizität den Zielzelltod misst und die Degranulation die NK-Reaktion auf Ziele misst.
Abschließend haben wir einen Antikörper gegen Ratten-CD107a (SIM1) gezüchtet und seine Fähigkeit charakterisiert, Degranulation in zytotoxischen Lymphozyten in der Ratte nachzuweisen. Wir haben gezeigt, dass SIM1 spezifisch für degranulierende Zellen ist, und durch Optimierung des Degranulationsprotokolls haben wir festgestellt, dass die Verwendung von Effektor: Zielzellverhältnissen von weniger als 1: 4 eine optimale Stimulation von LAK-Zellen gewährleistet. Die Entwicklung von Anti-Ratten-CD107a (SIM1) ermöglicht eine bessere Analyse und Charakterisierung der zytotoxischen Reaktionen von Rattenlymphozyten und wird ein wertvolles Instrument in den vielen Krankheitsmodellen der Ratte sein.
Ethikerklärung
Die Studie ist von der norwegischen Behörde für Tierforschung (FDU) genehmigt (Zulassungsnummer: ID-1698).
Autorenbeiträge
AS war für die Expressionsanalyse, die funktionellen Assays und das Schreiben des Manuskripts verantwortlich. K-ZD hat die cDNA-Klonierung und Erzeugung von Transfektanten durchgeführt. JTV war an der Projektplanung und -überwachung sowie an der Erstellung des Manuskripts beteiligt. LK war verantwortlich für Impfungen, die Hybridoma-Technologie, das Schreiben des Manuskripts und die Projektüberwachung.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Die Autoren danken Ulla Heggelund und Stine Martinsen für die technische Unterstützung im Labor und den Mitarbeitern der Tiereinrichtung der Abteilung für Vergleichende Medizin am Rikshospitalet des Universitätsklinikums Oslo für die Hilfe bei Impfungen. Vielen Dank an Marit Inngjerdingen für die wissenschaftlichen Diskussionen.
Finanzierung
Die Forschung wurde von der Universität Oslo, South-Eastern Norway Regional Health (2009104) und Legatet til Henrik Homans Minde finanziert.
1. Orange JS. Bildung und Funktion der lytischen NK-Zell-Immunsynapse. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Perforinporen in der Endosomenmembran lösen die Freisetzung von endozytiertem Granzym B in das Cytosol von Zielzellen aus. Nat Immunol (2011) 12(8):770-7. doi:10.1038/ni.2050
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforin und Granzyme: Funktion, Dysfunktion und menschliche Pathologie. Nat Rev Immunol (2015) 15(6):388-400. doi:10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. Eine zweite prophylaktische MHC-Mismatched-Knochenmarktransplantation schützt vor akuter myeloischer Leukämie (BNML) bei Ratten ohne tödliche Graft-versus-Host-Erkrankung. Transplantation (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1f
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
14. Es sind keine frei zugänglichen ergänzenden Materialien verfügbar in: Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Anwendungen der retrovirus-vermittelten Expressionsklonierung. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Reduzierte Degranulation von NK-Zellen bei Patienten mit häufig wiederkehrendem Herpes. Clin Vaccine Immunol (2011) 18(9):1410-5. doi:10.1128/CVI.05084-11
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Holz SM, Björkström NK, Lange EO, et al. Funktionelle Analyse von humanen NK-Zellen durch Durchflusszytometrie. Methoden Mol Biol (2010) 612: 335-52. doi:10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
