Einführung des Zellzyklusinhibitors
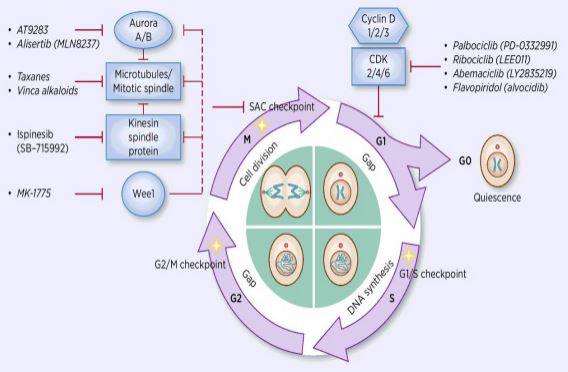
Der Prozess der Zellzyklusregulation ist die Aktivierung oder Inaktivierung verschiedener regulatorischer Faktoren unter der Überwachung von Kontrollpunkten, wodurch der Prozess der Zell-DNA-Replikation und der Teilung in zwei Tochterzellen eingeleitet wird. Unter vielen Zellzyklusregulatoren ist Cyclin-abhängige Kinase (CDK) der Kern, und es ist ein Netzwerksystem, das den Zellzyklus mit Cyclin und Cyclin-abhängigen Kinase-Inhibitoren (CKIs) reguliert. CDKs sind eine Klasse von Serin / Threonin-Kinasen, und derzeit werden 13 Arten gefunden, einschließlich CDK1 ~ 13, die eine Rolle bei der Zellzyklusregulation von CDKs und der Transkriptionsregulation von CDKs spielen. Die Regulation des Zellzyklus ist in der Tat die Regulation von Kontrollpunkten, wobei G1 / S-Regulationspunkte die wichtigsten sind. Wenn der Zellzyklus durch externe Signale wie Wachstumsfaktoren stimuliert wird, bindet die katalytische Untereinheit CDK4 / CDK6 an die regulatorische Untereinheit CyclinD, und die CDKs-Reste werden durch Phosphorylierung / Dephosphorylierung aktiviert. Nach Aktivierung von CDKs wird das Rb-Protein phosphoryliert. Das rb-Gen, auch als Retinoblastom-Gen bekannt, ist das erste klonierte Tumorsuppressorgen, und seine Fähigkeit, nach der Phosphorylierung des Proteins einen Komplex mit Transkriptionsfaktoren (wie E2F) zu bilden, geht verloren. E2F spielt eine wichtige Rolle in der Zellzyklusregulierung und induziert die Expression von Cyclin und CDK2 und bildet einen Cyclin / CDK2-Komplex, der das Protein weiter phosphoryliert und E2F vollständig freisetzt. Anschließend tritt E2F in den Zellkern ein, um eine Reihe von Zellzyklen in die S-Phase zu aktivieren. In der späten Phase der DNA-Replikation während der S-Phase wird CDK2 durch Cyclin aktiviert, das den Transkriptionsfaktor E2F rechtzeitig inaktiviert und Apoptose verhindert, die durch anhaltend aktiviertes E2F verursacht wird. Forschungsstatistiken zeigen, dass mehr als 90% der menschlichen Krebserkrankungen Mutationen in verwandten Genen in den CDK-, Cyclin-, CK- und Rb-Signalwegen aufweisen, wobei CDK und seine entsprechende regulatorische Untereinheit Cyclin am häufigsten dysfunktional sind. Darüber hinaus fördern Schwankungen im Zellzyklus die Chemotherapieresistenz und reduzieren die Auswirkungen der Chemotherapie. Daher ist die Regulation der CDK / Cyclin-Aktivität, die den normalen Zellzyklus wiederherstellt, eine der Strategien zur Behandlung von Tumoren.
Zellzyklus-Inhibitoren werden jetzt klinisch eingesetzt
Arzneimittelforscher haben sich darauf konzentriert, verschiedene Arten von CDK- und Cyclin-Inhibitoren als hochmoderne Krebsmedikamente zu finden. Derzeit werden CDK-Inhibitoren hauptsächlich in endogene und exogene unterteilt. Die größte Klasse von endogenen niedermolekularen Inhibitoren sind niedermolekulare Proteine, die nach Unterschieden in den Strukturfunktionen in zwei große Kategorien eingeteilt werden, und eine Klasse wird als duale spezifische Familie INK4 bezeichnet, einschließlich p15, p16, p18, p19, die die Proteinfamilie hemmt. Das inhibitor-abhängige Protein der CyclinD-assoziierten Kinase bindet an das entsprechende freie CDK4, wodurch die Bindung von CDK4 an das entsprechende cyclinD blockiert wird, um einen katalytischen Dimerkomplex zu bilden. Die andere Klasse heißt Kip-Familie, einschließlich P21, P27,P57. Diese Proteinfamilie kann ein Trimer mit einem dimeren Komplex bilden, der aus Cyclin E / CDK2 und cyclinA / CDK1 besteht, indem das katalytisch aktive Zentrum des Dimers blockiert wird. Die Hemmung dieser endogenen Inhibitoren reguliert in Kombination mit dem Kinasekomplex spezifisch seine Aktivität und reguliert so präzise die Transformation der Zelle von der G1- in die S-Phase. Studien haben gezeigt, dass das Auftreten und die Entwicklung multipler Tumoren mit einer verminderten Expression von CDKs / Cyclinen oder einer verminderten Expression endogener Inhibitoren wie der Deletion von P16 verbunden sind, die in Beziehung zur Entwicklung von Melanomen, Lungenkrebs, Brustkrebs und Darmkrebs stehen. Die Deletion von P27-Protein ist häufig bei Brustkrebs, Prostatakrebs, Darmkrebs und Magen-Darm-Krebs. Daher ist die Deletion des endogenen CDKs-Inhibitors oder der Genmutation eine wichtige Referenz für die Tumordiagnose. Endogene niedermolekulare Inhibitoren sind auch eine Klasse wichtiger nicht-kodierender RNAs, die in den letzten Jahren entdeckt wurden. Die Zielstellenregionen binden aneinander, um mRNA schnell und effizient abzubauen oder die Translation des Proteins zu hemmen, das Protein auf einem niedrigeren oder optimalen Niveau zu steuern und für das Leben Aktivitäten zu erfordern. Es wurden mehr als 10 microRNAs entdeckt, die an der Regulation des Zellzyklus beteiligt sind. Unter ihnen zielen miR1-2 und miR3-4 auf CDK4 ab, und der Zellzyklus wird in der G1-Phase angehalten, was die Tumorzellproliferation hemmt; miR-22 zielt auf CDK6-Zellen ab. Der Zyklus stagniert in der G1-Phase, was zu einer Seneszenz in Brustkrebszellen führt. In verschiedenen biologischen Prozessen regulieren diese miRNAs das Fortschreiten des Zellzyklus, indem sie auf E2F, CDK, Cyclin, P21, P27, DNA-Polymerase-Alpha usw. abzielen. um Schlüsselregulatoren des Zellzyklus zu fördern oder zu blockieren. Exogene Inhibitoren umfassen Antisense-Nukleinsäuren, Antikörper, kleine interferierende RNA-Interferenz (siRNA) und niedermolekulare Verbindungen. Niedermolekulare Verbindungen sind die wichtigste Klasse exogener CDK-Inhibitoren. Da das Verständnis der Kristallstruktur es den Menschen ermöglicht, molekulare Simulationsstudien durchzuführen, wurden in den letzten Jahren Durchbrüche bei der Konzeption und Entwicklung hocheffizienter und selektiver Studien zu chemischen Inhibitoren von CDKs erzielt. Man kann sagen, dass solche Verbindungen jeden Tag neue Mitglieder haben. Gegenwärtig können niedermolekulare CDK-Inhibitoren in die folgenden 13 Kategorien unterteilt werden: Roscovitin und Olomouc, Pyrimidine (PD-033299), Flavonoide (Flavopiridole), Thiazole (SNS03), Anthracen und seine Derivate (SU951), Piperidon (Paullone), Imidazopyridin, Pyrazolopyridin (AZ703), Pyrazine (AT751), Butyrolacton-1 ( butyrolacton-1), Scorpionin (UCN-01) und andere zwei Arten. Dreizehn niedermolekulare Inhibitoren sind in klinische Studien eingetreten. Sie sind alle kleinmolekulare Chemikalien planarer Heterocyclen, die mit ATP um die Bindung an die ATP-Bindungsstelle der CDK-Kinase konkurrieren. In-vivo-Experimente zeigten, dass CYC202 eine gute Arzneimittelresistenz und eine gute orale physiologische Aktivität aufweist und offensichtliche hemmende Wirkungen auf solide Tumoren bei Nacktmäusen hat, die mit menschlichen Darmkrebs- und Gebärmutterkrebszellen geimpft wurden. In Phase-Ib-Studien nahmen 10 Patientinnen mit Eierstockkrebs CYC länger als 20 Monate ein, ohne dass es zu einer Zunahme von Tumoren oder schweren behandlungsbedingten Nebenwirkungen kam, von denen der Tumor einer Patientin um mehr als 30% geschrumpft ist. und einige Patienten, die seit mehr als einem Jahr behandelt wurden, haben einen stabilen Zustand. Klinische Phase-II-Studien haben gezeigt, dass CYC202 allein eine etwas schlechtere Wirkung hat und in Kombination mit anderen Chemotherapeutika wirksam ist. Klinische Phase-IIb-Studien mit CYC202 in Kombination mit Capecitabin zur Behandlung von Brustkrebs in Kombination mit 2,2-Difluordesoxycytidin oder Cisplatin zur Behandlung von Lungenkrebs und Nasopharynxkarzinom sind ebenfalls im Gange. Die Entwicklung und Anwendung der niedermolekularen RNA-Interferenztechnologie hat es ermöglicht, die Genexpression spezifischer Interventionszielmoleküle zu untersuchen, und viele Wissenschaftler haben begonnen, auf genetischer Ebene in die Synthese von CDK / Cyclin einzugreifen. Limaet al. transfizierte Cyclin-Targeting-siRNA in Hep3B, HepG2, SNU449 (Cyclin-Überexpression) und HuH7 (Cyclin-Überexpression) und fand heraus, dass die Cyclin-Expression in Zellen um 90% reduziert war. Die DNA-Synthese ist signifikant reduziert und die Zellen unterliegen einer Apoptose. Galimberti et al. transfizierte siRNA, die auf Cyclin, CDK2 und CDK1 abzielte, in Maus-Lungenkrebszellen HOP-62, H-522 bzw. H-23 und fand heraus, dass cyclin / CDK2 Apoptose induzieren und die Proliferation von Lungenkrebszellen hemmen kann. Eine verminderte CDK1-Expression, die durch CDK1-siRNA-Interferenz verursacht wird, verursacht nur einen Zellphasenarrest und verlangsamt die Zellproliferation; während CDK1- und CDK2-siRNA-Co-Interferenz zu einer gleichzeitigen Abnahme der CDK1- und CDK2-Expression führen und Resistenzen in den Phasen des Zellzyklus S und G2 / M verursachen. Die Stagnation induzierte auch Apoptose der Zellen. Cao Yinfang und andere erfolgreiche Transfektion von CDK2 / Cyclin-siRNA-rekombinantem Expressionsvektor in HepG2-Zellen zeigten, dass die CDK2- und Cyclin-mRNA-Expression signifikant abnahm, der Zellzyklus in der S-Phase angehalten wurde, die G1-Phasenzellen signifikant zunahmen, die Caspase-3-Aktivität erhöht wurde, HepG2-Zellen Apoptose unterzogen wurden und Zellzyklusänderungen mit einer verringerten Proliferation von HepG2-Zellen übereinstimmenin vitro nach der Transfektion.
Funktion des Zellzyklushemmers
Mit der Vertiefung des Verständnisses der wichtigen Rolle der Zellzyklusregulation bei der Tumorbildung und Apoptose wurde die Zellzyklusregulation bei der Resistenz gegen Tumorchemotherapie weiter untersucht. Cyclin-abhängige Kinasen (Cdks), die während des Zellzyklus eine Rolle beim Antrieb des Zellmotors spielen, sind ideale Ziele für die Tumortherapie. Die meisten Krebszellen haben Aktivierung, Überexpression des CDK-Gens (Zellteilungszyklus) und Defekte in der CDKIs-Funktion. Der CDK-Inhibitor übt eine Brechwirkung aus, die den Zellzyklus hemmt. In den letzten Jahren haben sich CDKIs zu einem wichtigen Highlight der Krebstherapie entwickelt, das die Aktivität von CDKs im Zellzyklus hemmt. Eine Reihe von klinischen Studien hat auch gezeigt, dass eine einzelne Anwendung moderate Auswirkungen haben kann. In Kombination mit herkömmlichen zytotoxischen Chemotherapeutika können CDKIs jedoch die Antitumorwirkung herkömmlicher Chemotherapeutika signifikant verstärken. Daher ist die Erforschung der Antikrebseffekte von CDKIs-Medikamenten und anderen Chemotherapeutika zu einem Hot Spot in der aktuellen Behandlung von Tumorresistenz geworden.
Referenz
- Bendris N, Lemmers B, Blanchard J M. Zellzyklus, Zytoskelettdynamik und darüber hinaus: die vielen Funktionen von Cyclinen und CDK-Inhibitoren. Zellzyklus. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Targeting von Kernkinasen bei Krebs: Entwicklung von Zellzyklus-Kinase-Inhibitoren. Pharmakologie & Therapeutika. 2014, 142(2):258-269.
- Stone A, Sutherland R L, Musgrove E A. Inhibitoren von Zellzykluskinasen: jüngste Fortschritte und Zukunftsperspektiven als Krebstherapeutika. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. Zellzyklusregulation und Melanom. Aktuelle onkologische Berichte. 2016, 18(6):34.
- Malumbres M, Barbacid M. Zellzyklus, CDKs und Krebs: ein Paradigmenwechsel. Nature Reviews Krebs. 2009, 9(3):153-166.
