Verbessertes kleines kontinuierliches Kultivierungssystem
In dieser Studie zeigen wir weitere Fortschritte und Anwendungsmöglichkeiten eines kleinen kontinuierlichen Kultivierungssystems auf, das zuvor von Klein et al. , für einen erhöhten Parallelisierungsgrad und eine verbesserte Handhabung sowie Überwachung der einzelnen Reaktoren. Die Hauptaspekte der am System vorgenommenen Änderungen umfassen eine Erhöhung des Satzes paralleler Kulturgefäße von 8 auf 24 Reaktoren und eine Verringerung des Arbeitsvolumens von 10 auf 6,5 ml. Das vorliegende System besteht ferner aus maßgeschneiderten Deckeln mit vier festen Anschlüssen, die zur Belüftung, Medienversorgung, Brühenentnahme sowie zur Inokulation oder Probenahme verwendet werden (Abb. 1). Neben den vier Anschlüssen wird eine optische stabförmige DO-Sonde zur DO-Überwachung durch den Deckel eingeführt, ohne den Kultivierungsprozess zu stören, und ersetzt auf diese Weise den Sauerstoffleuchtstoffsensorfleck des vorherigen Aufbaus . Das Wasserbad, das im vorherigen Aufbau eine konstante Kultivierungstemperatur beibehielt, wurde durch einen maßgeschneiderten Aluminiumheizblock ersetzt, der mit einer Mikroplattenrühreinheit verschmolzen ist. Da die Vorgängerversion des kleinskaligen Bioreaktorsystems mit der Spalthefe Schizosaccharomyces pombe validiert wurde , stellen wir hier den verbesserten Kultivierungsaufbau für S. cerevisiae-Kultivierungen vor.
Grundlegende Arbeitsschritte sowie Anpassungen der Verdünnungsraten durch Auswahl des geeigneten Rohrdurchmessers und der Pumprate der Medieneinströmpumpe wurden wie zuvor beschrieben durchgeführt . Hier wurde das Gewicht des Flüssigkeitsgehalts jedes Bioreaktors am Ende der Kultivierung gravimetrisch bestimmt, was die genaue Berechnung der jeweiligen Verdünnungsrate mit a 5 ermöglicht.1% abweichung. Kulturbrühe und Reaktorgasphase wurden beide durch den gleichen Anschluss des Reaktordeckels mit der Effluxpumpe (Fig. 1). Für alle Kultivierungsversuche wurden Effluxpumpraten von 7,5 ml min−1 verwendet. Die Effluxpumpenrate lag weit über der Fütterungspumpenrate, wodurch ein leichter Unterdruck innerhalb des Kulturgefäßes erzeugt wurde. Diese Druckdifferenz führte zum Zufluss von Luft durch den Belüftungsanschluss. Der durchschnittliche erreichte Sauerstoff-Stoffübergangskoeffizient kLa betrug 110 h-1, was DO-Werte weit über 30% Sättigung während des gesamten Kultivierungsprozesses ermöglichte. Der pH-Wert wurde weder online überwacht noch während der Kultivierung kontrolliert, da das Medium a priori auf einen pH-Wert von 6,0 eingestellt wurde, was zu einem endgültigen pH-Wert von 5,5 in der Kultivierungsbrühe führte. Der pH-Wert wurde täglich at-line vom Auslauf der Reaktoren und nach der Ernte gemessen. Der pH-Wert blieb konstant, sobald der Steady State erreicht war und das Reaktoraustrag eine geringfügige Abweichung von 0,1 pH-Einheiten aufwies (Daten nicht dargestellt).
Untersuchung der 3-PS-Produktion in kleinskaligen Chemostaten bei unterschiedlichen Verdünnungsraten unter C-limitierenden Bedingungen
Zur Bestimmung der maximalen spezifischen Wachstumsrate (µmax) wurde S. cerevisiae ST938 unter Batchbedingungen mit überschüssiger Nährstoffverfügbarkeit kultiviert. Unter Verwendung von Glucose als Kohlenstoffquelle betrug die µmax 0,265 h−1, die Biomasseausbeute 24,9 g mol-1 und die 3-HP-Kohlenstoffausbeute an Glucose 0,6 %C-mol (Tabelle 1). In diesem Kultivierungsmodus wurde der größte Teil des Kohlenstoffs zu Ethanol und CO metabolisiert2 , als hohe glykolytische Flüsse in Wildtyp S. cerevisiae sind eng mit der alkoholischen Gärung verbunden . Chemostat-Kultivierungen werden durch die Zufuhr eines wachstumslimitierenden Substrats gesteuert. Im Steady State produziert Wildtyp-S. cerevisiae unterhalb einer bestimmten Wachstumsrate keine signifikanten Mengen seiner Metaboliten, was die kritische Verdünnungsrate (Dcrit (h−1)) aufgrund der fehlenden Akkumulation der Kohlenstoffquelle markiert. Bei oder oberhalb dieser kritischen Verdünnungsrate sammelt sich Kohlenstoffquelle im Reaktor an und der Überlaufstoffwechsel wird ausgelöst, was zur Produktion verschiedener Nebenprodukte wie Ethanol, Acetat und geringen Mengen organischer Säuren führt . Dementsprechend wurden kontinuierliche Kulturen verwendet, um den Zusammenhang zwischen der Wachstumsrate und der biomassespezifischen 3-HP-Produktbildung in S. cerevisiae ST938 zu untersuchen. Die vier verschiedenen Verdünnungsraten D(h−1): 0,04, 0,09, 0,17 und 0,21 wurden so gewählt, dass sie unterhalb der µmax von S. cerevisiae Stamm ST938 lagen, die in Batch-Kultivierung bestimmt wurden. Die Biomasseausbeute an Glucose sowie die 3-HP-Ausbeute, die spezifische 3-HP-Produktionsrate und die spezifische Substrataufnahmerate wurden untersucht (Abb. 2a-d, Tabelle 1). Alle relevanten Kultivierungsparameter, d.h. Ausbeuten und Raten mit den jeweiligen Standardabweichungen, sind in Tabelle 1 zusammengefasst.

Selected rates and yields for C-limited aerobic chemostat cultivations of S. cerevisiae ST938 a 3-HP yield (C-mol C-mol−1) on glucose, b biomass yield on glucose (g mol−1), c specific 3-HP production rate (mmol gCDW−1 h−1) and d specific glucose uptake rate (mmol gCDW−1 h−1) at different dilution rates for S. cerevisiae ST938. Cultivations were carried out in triplicates at 30 °C and pH 5.5 under C-limited conditions. Fehler entsprechen Standardabweichungen, die aus Dreifachkultivierungen abgeleitet wurden
Die Kultivierung von S. cerevisiae ST938 unter C-limitierenden Bedingungen zeigte einen Wechsel von überwiegend fermentativem Metabolismus, der im Batch-Modus beobachtet wurde, zu einem respiratorischen Metabolismus in Chemostaten, was sich in höheren Biomasseerträgen sowie in vernachlässigbarer Ethanol- und Glycerinbildung widerspiegelt (Tabelle 1). Weiterhin geringe Mengen an Restglukose unter 0.1 mM wurden in den aus dem Efflux der verschiedenen Reaktoren entnommenen Proben nachgewiesen, wodurch die Kulturen als glucosebegrenzt verifiziert wurden. Kohlenstoffbegrenzte Bedingungen in Steady-State-Chemostat-Kulturen schienen die Bildung von 3-HP zu begünstigen, da die Ausbeuten dieses Produkts 20- bis 25-fach höher waren als die in Batch-Kultur ermittelte Ausbeute (Tabelle 1). Dies ist höchstwahrscheinlich auf die effizientere Umwandlung von Kohlenstoff in Energie in Form von ATP während der Atmung im Vergleich zur Fermentation in Batchkulturen zurückzuführen. Interessant, die Kultivierungen von S. cerevisiae ST938 zeigte unter C-limitierenden Bedingungen, dass bei sinkenden spezifischen Wachstumsraten ein konstanter Anstieg der 3-HP-Kohlenstoffausbeuten beobachtet werden konnte, wobei die höchste 3-HP−Ausbeute von 16,6 %C-mol bei einer Verdünnungsrate von 0,04 h-1 beobachtet wurde (Abb. 2a). Die 3-PS-Ausbeute an Biomasse ist zehnfach höher als die Ausbeute an Batchkulturen und stieg durch Absenkung der Verdünnungsrate von 0,21 auf 0,04 h−1 um mehr als das Doppelte von 0,19 auf 0,43 g gCDW−1 (Tabelle 1). Die maximale spezifische Produktivität für 3-HP von etwa 0,50 mmol gCDW−1 h-1 wurde bei Verdünnungsraten von 0,17 und 0 beobachtet.21 h-1, was etwa vierfach höher ist als bei Batch-Kultivierungen gemessen (Abb. 2c, Tabelle 1). Erwartungsgemäß stieg die spezifische Glucoseaufnahmerate (qS) mit höheren Verdünnungsraten von 0,51 auf 2,1 mmol gCDW−1 h−1 (Abb. 2d). Diese Werte liegen bis zu 20-fach unter der maximalen spezifischen Glucoseaufnahmerate von 10,7 mmol gCDW−1 h−1, die bei µmax unter glucosebegrenzten Wachstumsbedingungen im Batch-Modus beobachtet wurde (Tabelle 1). Erhaltene Werte für die spezifische Substrataufnahmerate und Biomasseausbeute bei einer Verdünnungsrate von 0.09 h-1 (Tabelle 1) stimmten mit Daten aus Chemostat−Kultivierungen mit Wildtyp S. cerevisiae bei einer Verdünnungsrate von 0,10 h−1 überein, wobei 1,1 bzw. 1,25 mmol gCDW−1 h−1 sowie 0,49 g g-1 angegeben wurden. Es hat sich gezeigt, dass die Biomasseausbeute pro Substrat mit steigenden Verdünnungsraten zunimmt, für Wildtyp S. cerevisiae ist dieser Parameter jedoch im Allgemeinen konstant unter Dcrit, solange der Erhaltungsmetabolismus eine erhebliche Kohlenstoffsenke darstellt, die die Biomasseausbeute bei niedrigen Verdünnungsraten verringert . Im Falle von S. cerevisiae Stamm ST938 Es schien jedoch, dass Kohlenstoff, der nicht auf die Biomassebildung gerichtet war, in gewissem Maße zur Bildung von 3-HP und Nebenprodukten beitrug.Zusammenfassend lässt sich sagen, dass Unterschiede in kontinuierlichen Kulturen bei unterschiedlichen Verdünnungsraten sowie im Vergleich zu ähnlichen Setups mit S. cerevisiae Wildtyp darauf hindeuten, dass der integrierte Biosyntheseweg zur Produktion von 3-HP einen enormen Einfluss auf die Hefephysiologie hat, der vermutlich durch adaptive Stressreaktionen verstärkt wird. Schließlich, C-begrenzte Chemostat-Kultivierung bei der niedrigsten Verdünnungsrate von 0.04 h-1 resultierte in der höchsten 3-HP Kohlenstoffausbeute.
Untersuchung der Stickstoff- und Phosphatlimitierung auf erhöhte 3-HP-Ausbeuten in kleinskaligen Chemostat-Kulturen
Nach der Charakterisierung von S. cerevisiae ST938 unter C-limitierenden Bedingungen wurden Kultivierungen unter stickstoff- und phosphatlimitierenden Bedingungen durchgeführt, wie sie sich bisher als günstig für die Produktion verschiedener nativer und nicht nativer Metaboliten in verschiedenen Organismen erwiesen haben . Hier wurden die entsprechenden Kultivierungen unter Stickstoff (N)- und Phosphor (P)-Limitierung im kleinskaligen kontinuierlichen Kultivierungssystem untersucht (Abb. 1) mit einer eingestellten Verdünnungsrate von 0,04 h−1, die zuvor zu den höchsten Kohlenstoffausbeuten von 3-HP unter C-begrenzten Bedingungen geführt hatte (Tabelle 1). Die Parameter und die jeweiligen Standardabweichungen von N- und P-begrenzten Kultivierungen des Hefestamms ST938 sind in Tabelle 2 zusammengefasst.
Für N- und P-begrenzte Kultivierungsbedingungen wurden in den aus dem Ausfluss der verschiedenen Reaktoren entnommenen Proben keine Ammonium- oder Phosphatreste nachgewiesen, was die zu begrenzenden Kulturen in Bezug auf die entsprechende Substratbegrenzung belegt (Tabelle 2). Unter N- und P-Begrenzung wurden jedoch geringe Restglukosemengen im Bereich von 0,63 und 0,19 mM nachgewiesen (Tabelle 2). Während der C-Limitierung lagen die Restglukosespiegel deutlich unter 0,1 mM (Tabelle 2). Kultivierungen unter Anwendung von N- und P-Beschränkungen ergaben eine 3-HP-Ausbeute von 17,7 bzw. 21,1 % C-mol, die unter P-begrenzten Bedingungen einen signifikant höheren Wert aufwies als die 3-HP-Kohlenstoffausbeute von 16,6 % C-mol, berechnet für C-begrenzte Kultivierungsbedingungen (Tabellen 1, 2). In ähnlicher Weise wurde die spezifische Produktivität für 3-HP für N- und P-begrenzte Kultivierungen signifikant erhöht, wobei Werte von 0,22 und 0,23 mmol gCDW−1 h−1 im Vergleich zu 0,17 mmol GCDW−1 h−1 in C-begrenzten Kulturen erreicht wurden. Darüber hinaus zeigten die 3-PS-Ausbeuten an Biomasse vergleichbare Werte von 0,43 und 0.44 g gCDW-1 für C- und N-begrenzende Bedingungen, jedoch wurde bei P−Begrenzung eine erhöhte Ausbeute von 0,50 g gCDW-1 beobachtet. Aufgrund der insgesamt geringen Konzentrationen der quantifizierten Nebenprodukte sind diese vernachlässigbar (Tabelle 2). Die Werte für die spezifische Substrataufnahmerate (qS) für C- und P-Limitierung waren vergleichbar und es wurde ein leicht erhöhter Wert von 0.61 mmol gCDW−1 h−1 unter N-limitierten Bedingungen erhalten. Biomasseerträge pro Substrat ergaben für N- und P-begrenzte Bedingungen ähnliche Werte von 72,4 bzw. 75,2 g mol−1. Im Vergleich zum Biomasseertrag von 78.4 g mol-1 unter C-begrenzten Bedingungen erreicht werden, sind diese Werte ähnlich. Unsere Studie unterstützt die Begründung, dass höhere Produktausbeuten pro Substrat unter N- und P-begrenzenden Bedingungen erzielt wurden. Folglich scheint es, dass eine höhere spezifische Substrataufnahmerate im Falle der N-Begrenzung kombiniert mit der minimalen Bildung von Nebenprodukten letztlich die Produktbildung begünstigte. Unter P-begrenzenden Bedingungen wurden die geringsten Mengen an Nebenprodukten gebildet, die die Produktsynthese begünstigen könnten. Es kann weiter spekuliert werden, dass einige metabolische Veränderungen möglicherweise dazu führen, dass eine geringere Menge an Kohlenstoff als CO2 freigesetzt wird.Zusammenfassend zeigten Chemostat-Kultivierungen unter N- und P-Begrenzung erhöhte 3-PS-Erträge und spezifische Produktionsraten im Vergleich zu C-begrenzten Bedingungen, wobei die P-Begrenzung die höchsten Produktausbeuten ermöglichte.
Übertragbarkeit der in kleinskaligen Chemostaten gemessenen physiologischen Parameter auf Fed-Batch-Kulturen in 1-L-Bench-Top-Bioreaktoren unter C- und P-limitierenden Bedingungen
Da diese Studie weiterhin darauf abzielte, die Übertragbarkeit und Vergleichbarkeit der unter verschiedenen Kultivierungsbedingungen gemessenen physiologischen Parameter zu bewerten, wurden die aus den in Chemostat-Kulturen ermittelten C- und P-limitierenden Bedingungen erhaltenen Kultivierungsparameter auf 1-L-gerührte Tischreaktoren übertragen, die im Fed-Batch-Modus laufen. Das Konzept dieses Ansatzes bestand daher darin, die wichtigsten Bedingungen und Parameter für Chemostat- und Fed-Batch-Kulturen konstant zu halten, um die Vergleichbarkeit sicherzustellen. Diese Bedingungen umfassten (i) das gleiche C: P-Verhältnis wie bei P-limitierenden Chemostat-Kultivierungen, (ii) die gleichen Prozessbedingungen wie pH-Wert und Temperatur und (iii) die gleichen spezifischen Wachstumsraten wie bei Chemostaten, die durch ein exponentielles Feed-Profil erreicht wurden. Zur Optimierung des Produkttiters werden die Parameter mit der maximalen Produktausbeute pro Substrat aus den Chemostaten-Experimenten (D = 0.04 h-1) unter C- und P-Begrenzung für die Übergabe an das Fed-Batch-System gewählt. Aufgrund technischer Einschränkungen im Aufbau wurden Fed-Batch-Kultivierungen mit einer Wachstumsrate von 0,05 h−1 durchgeführt, was etwas höher ist als die eingestellte Verdünnungsrate von 0,04 h−1 in Chemostat-Kultivierungen. Die Fed-Batch-Kultivierung bestand aus einer anfänglichen Batch-Phase zur Erzeugung von Biomasse, gefolgt von einer exponentiellen, nährstoffbegrenzten Fütterungsphase zur Kontrolle der Wachstumsrate. Für die Beurteilung der Übertragbarkeit der aus dem kontinuierlichen Kultivierungssystem gewonnenen Parameter wurde nur die Fütterungsphase als relevant erachtet, da allein während dieser Phase die Substratkonzentration das mikrobielle Wachstum kontrollierte und damit limitierte. Die Fed-Batch-Kultivierungsprofile von S. cerevisiae ST938 unter C- und P-limitierenden Bedingungen sind in Abb. 3, und die entsprechenden Kultivierungsparameter mit ihrer jeweiligen Standardabweichung sind in Tabelle 3 zusammengefasst.
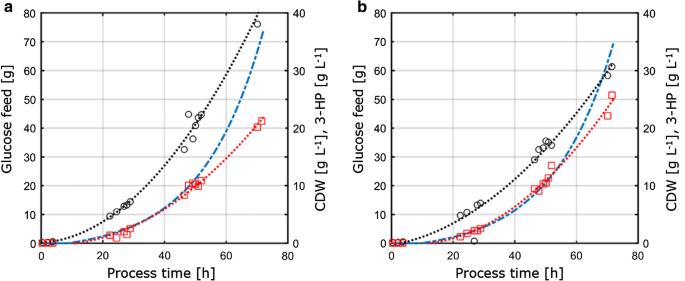
Aerobe Fed-Batch-Kultivierung in 1-L−Tischfermentern von S. cerevisiae ST938 unter Verwendung einer exponentiellen Zufuhrrampe bei D = 0,05 h-1 mit dem Grenzsubstrat a Kohlenstoff oder b Phosphor. Schwarze Kreise beziehen sich auf Biomassetiter, rote Quadrate auf 3-HP-Titer und blaue gestrichelte Linie auf die absolute Menge an Glucose, die den Reaktoren zugeführt wird
Die in den Fed-Batch-Kulturen beobachtete Biomasseausbeute betrug 77,9 bzw. 67,7 g mol-1 für die C- bzw. Der Biomasseertrag für C-begrenzte Kultivierungen war im Chemostat- und Fed-Batch-Betrieb vergleichbar, während für die P-Begrenzung im Fed-Batch-Betrieb ein leicht verringerter Biomasseertrag beobachtet wurde (Tabellen 2, 3), der innerhalb der für beide Biomasseerträge beobachteten Standardabweichungen liegt. Die Kohlenstoffausbeute pro Substrat für 3-HP betrug 15,9% für C-HP, was im Vergleich zu dem im Chemostat-System berechneten Wert (Fig. 4a). Die in dieser Studie ermittelten 3-HP-Ausbeuten stimmen ferner eng mit einer Kohlenstoffausbeute pro Substrat von 14% überein, die in früheren C-begrenzten Fed-Batch-Studien bei pH 5,0 mit einem S. cerevisiae-Stamm erhalten wurde, der unter Verwendung des β-alanin-Weges entwickelt wurde, und von 13% mit einem S. cerevisiae, der den Malonyl-CoA-Reduktase-abhängigen Weg verwendet . Höhere 3-HP-Kohlenstoffausbeuten pro Substrat über den β-Alanin-Weg wurden in Studien mit Escherichia coli mit einem Wert von 42% in Fed-Batch-Kultivierungen auf Glucose bestimmt .

Vergleich von Kultivierungsparametern unter verschiedenen Einschränkungen, die in kleinen Chemostaten und 1-L-Tischreaktoren im Fed-Batch-Modus bestimmt wurden. a 3-HP Kohlenstoffausbeute (%C-mol) und b 3-HP Ausbeute an Biomasse (g gCDW−1). Fehler entsprechen Standardabweichungen, die von Dreifachkultivierungen abgeleitet wurden
Für P-begrenzende Bedingungen ergab unsere Studie jedoch einen erheblichen Anstieg der 3-HP-Kohlenstoffausbeute von 25,6% (Abb. 4a). Die beobachteten 3-PS-Ausbeuten an Biomasse betrugen 0,38 bzw. 0,65 g gCDW-1 für C- und P-Grenzbedingungen. Für die C-Begrenzung bestätigte dies die im Chemostaten-Setup beobachteten Werte (Abb. 4b). Aufgrund der Ertragssteigerung von 3-HP pro Substrat unter P-limitierenden Bedingungen und der gleichzeitig geringen Abnahme der Biomasseausbeute pro Substrat wurde die Ausbeute von 3-HP pro Biomasse im Vergleich zum Chemostat-Experiment signifikant erhöht. Im Gegensatz zu den in Chemostaten durchgeführten Kultivierungen wurde bei Fed-Batch-Kultivierungen keine signifikante Anreicherung von Ethanol oder Glycerin festgestellt. Eine geschlossene Kohlenstoffbilanz für C- und P-Grenzbedingungen zeigte, dass keine relevanten Mengen anderer (Neben-)Produkte gebildet wurden (Tabelle 3). Dieser Unterschied im Nebenproduktspektrum könnte den Anstieg der 3-HP-Ausbeute pro Glucose erklären.
Im Vergleich zu den in Chemostaten durchgeführten Kultivierungen zeigen die in Fed-Batch−Kulturen ermittelten spezifischen Glucoseaufnahmeraten für C− bzw. P-limitierende Bedingungen deutlich höhere Werte von 0,75 bzw. 0,77 mmol gCDW-1 h-1. Wie oben erwähnt, wurde der Sollwert für den Exponentialfaktor des Feedprofils auf 0,05 h−1 eingestellt und bis zu 0,059 h−1 variiert, was zu einer 30-45% höheren spezifischen Wachstumsrate in Fed-Batch-Kultivierungen im Vergleich zu den Chemostat-Experimenten mit 0 führte.04 h-1 (Tabelle 3), was zu erhöhten spezifischen Glukoseaufnahmeraten führt. Für C-begrenzte Fermentationen war der Biomasseertrag an Glucose jedoch zwischen Chemostat- und Fed-Batch-Kultivierung vergleichbar. In ähnlicher Weise waren die spezifischen 3-HP-Produktionsraten in Fed−Batch−Kultivierungen mit 0,24 mmol gCDW−1 h−1 bzw. 0,38 mmol GCDW-1 h-1 erhöht. 3-HP-Erträge pro Substrat waren zwischen Chemostat- und Fed-Batch-Kultivierung vergleichbar, was darauf hindeutet, dass die Erträge ein robuster Kultivierungsparameter sind, der gegen Störungen resistent ist, die durch kleinere Schwankungen im Kultivierungsaufbau induziert werden. In den Proben, die den verschiedenen Reaktoren für P-begrenzende Bedingungen entnommen wurden, wurde kein Restphosphat sowie Glucose nachgewiesen, was bestätigt, dass die Kulturen in Bezug auf die entsprechende Begrenzung begrenzt sind. In ähnlicher Weise wurde für die C-Begrenzung keine Restglukose in den Proben nachgewiesen.
Die hier vorgestellten Verbesserungen eines kleinskaligen Chemostat-Systems, das zuvor von Klein et al. , umfasste unter anderem eine Erhöhung der Anzahl der Reaktoren auf 24 und eine Verringerung des Kultivierungsvolumens auf 6,5 ml. Dieser erhöhte Parallelisierungsgrad macht das System zu einem geeigneten Hochdurchsatz-Screening-Tool, da verschiedene vergleichbare kleine Chemostat-Systeme mit höheren Arbeitsvolumina und einer geringeren Anzahl von Reaktoren arbeiten: Das Continuous Parallel Shaken Bioreactor (CosBios) -System verwendet sechs bzw. acht parallele Kulturgefäße mit einem Kulturvolumen von 20-25 ml . Das für kontinuierliche Kultivierungen modifizierte Einweg-Rührkessel-Bioreaktorsystem (bioREACTOR, 2mag AG) arbeitet mit acht parallelen Reaktoren bei einem Arbeitsvolumen von 10 ml. Das von Bergenholm et al. besteht aus 16 parallelen Reaktoren und benötigt ein Arbeitsvolumen von 40 ml. Unser System eignet sich daher gut für das einfache und kostengünstige Screening der mikrobiellen Leistung im kontinuierlichen Modus. Es könnte jedoch von Bedeutung sein, das System durch Überwachung zusätzlicher Parameter, wie z.B. Abgas, weiter zu erweitern, um eine detaillierte Analyse der Kohlenstoffverteilung zu ermöglichen, was für physiologische Belastungscharakterisierungen von besonderer Bedeutung ist.Da unsere Studie nahelegte, dass die N- und P-Limitierung für die 3-HP-Bildung in S. cerevisiae günstig ist, könnten zukünftige Experimente ein weiteres Screening der Wachstumsraten mit N- und P-Limitierung beinhalten, um die optimale 3-HP-Produktion mit der jeweiligen Limitierung zu finden. Unsere Studie zeigte ferner die Übertragbarkeit physiologischer Parameter von Chemostaten auf Fed-Batch-Kultivierungen. Dies erscheint nur dann machbar, wenn sich während der Fed-Batch-Kultivierung keine toxischen oder hemmenden Verbindungen anreichern, da sich physiologische Parameter mit der Zeit ändern und von den in Chemostaten erfassten Parametern abweichen würden. Als allgemeiner Ansatz können Chemostat-Experimente als Instrument zur Untersuchung des Einflusses einer potentiellen toxischen oder inhibierenden Verbindung dienen, indem die Substanz dem Futter selbst zugesetzt wird. Da alle anderen Parameter konstant sind, kann der Einfluss der Verbindung und ihrer Konzentration direkt beurteilt und bewertet werden. In unserer Studie wurde keine Nebenproduktbildung in Fed-Batch-Kultivierungen nachgewiesen und eine vermutlich ähnliche Stressreaktion wurde aufgrund schwacher Säuren induziert, wodurch die physiologischen Bedingungen in kleinen Chemostaten denen in Fed-Batch-Bedingungen ähnelten.Zusammenfassend zeigte diese Studie, dass das Konzept der C- und P-limitierenden Bedingungen für die Produktion von 3-HP in einem neuartigen parallelisierten Chemostat-Kultivierungssystem untersucht wurde und erfolgreich auf 1-L-Bench-Top-Bioreaktoren übertragen werden konnte, die im Fed-Batch-Modus arbeiten. Daher können physiologische Parameter, die in Chemostaten erfasst werden, für das Design und die Leistungsbewertung von Fed-Batch-Kultivierungen unter Verwendung ertragsbasierter Parameter für den Prozessaufbau verwendet werden.
