Elektronegativität und Bondpolarität
Obwohl wir kovalente Bindung als Elektronenteilung definiert haben, werden die Elektronen in einer kovalenten Bindung nicht immer gleichmäßig von den beiden gebundenen Atomen geteilt. Wenn die Bindung nicht zwei Atome desselben Elements verbindet, gibt es immer ein Atom, das die Elektronen in der Bindung stärker anzieht als das andere Atom, wie in Abbildung 4.3 „Polare versus unpolare kovalente Bindungen“ gezeigt. Wenn solch ein Ungleichgewicht auftritt, gibt es einen resultierenden Aufbau einer negativen Ladung (genannt eine teilweise negative Ladung und bezeichnet δ−) auf einer Seite der Bindung und einer positiven Ladung (bezeichnet δ+) auf der anderen Seite der Bindung. Eine kovalente Bindung, die eine ungleiche Elektronenaufteilung aufweist, wie in Teil (b) von Abbildung 4.3 „Polare versus unpolare kovalente Bindungen“, wird als polare kovalente bondA-kovalente Bindung mit einer unsymmetrischen Elektronenverteilung über die Bindung bezeichnet.. Eine kovalente Bindung, die eine gleiche Aufteilung der Elektronen aufweist (Teil (a) von Abbildung 4.3 „Polare versus unpolare kovalente Bindungen“) wird als unpolare kovalente bondA-kovalente Bindung mit einer ausgewogenen Elektronenverteilung über die Bindung bezeichnet..
Abbildung 4.3 Polare versus unpolare kovalente Bindungen
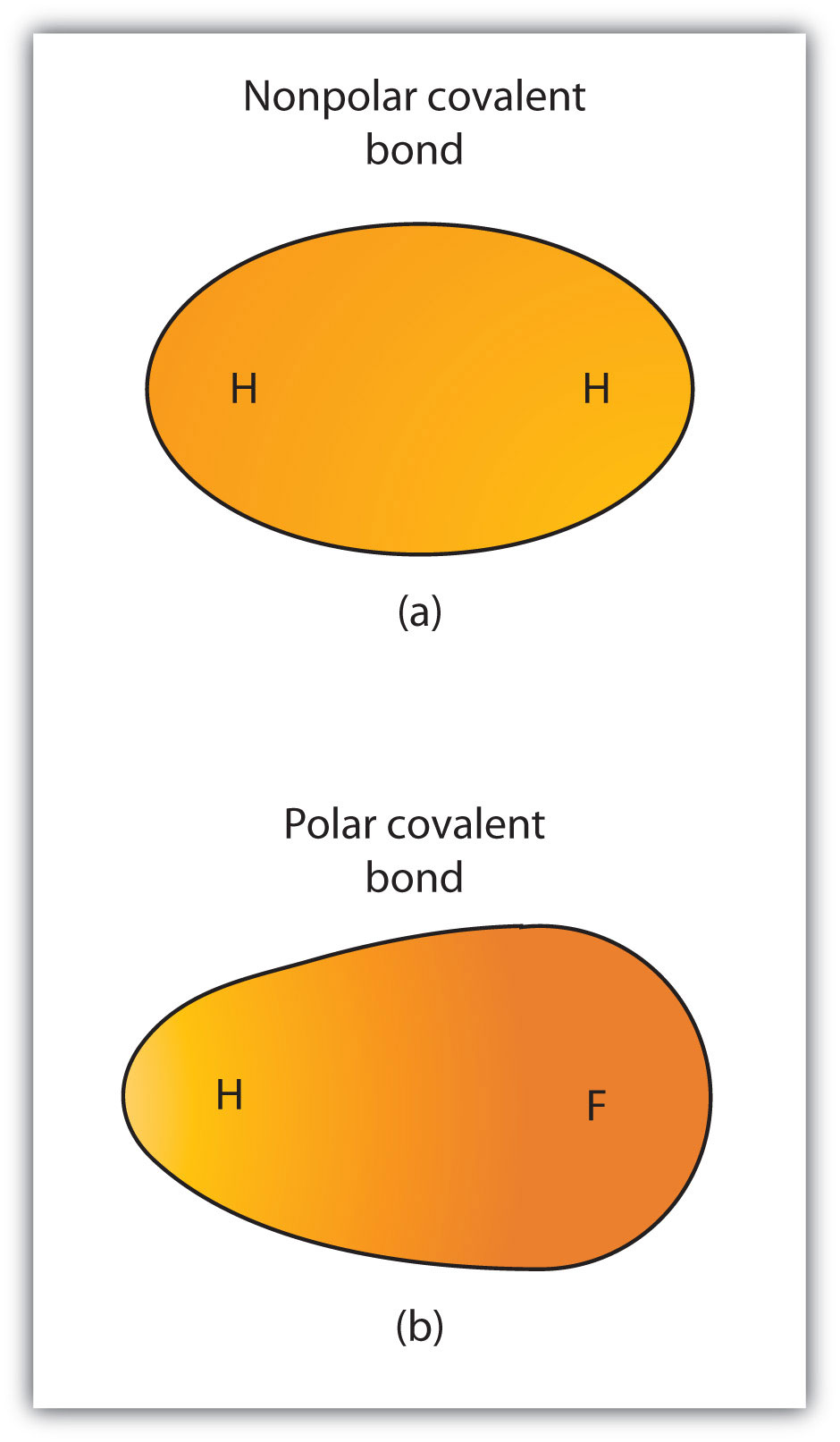
(a) Die Elektronen in der kovalenten Bindung werden von beiden Wasserstoffatomen gleichermaßen geteilt. Dies ist eine unpolare kovalente Bindung. (b) Das Fluoratom zieht die Elektronen in der Bindung stärker an als das Wasserstoffatom, was zu einem Ungleichgewicht in der Elektronenverteilung führt. Dies ist eine polare kovalente Bindung.
Jede kovalente Bindung zwischen Atomen verschiedener Elemente ist eine polare Bindung, aber der Grad der Polarität variiert stark. Einige Bindungen zwischen verschiedenen Elementen sind nur minimal polar, während andere stark polar sind. Ionenbindungen können als die ultimative Polarität angesehen werden, wobei Elektronen eher übertragen als geteilt werden. Um die relative Polarität einer kovalenten Bindung zu beurteilen, verwenden Chemiker Elektronegativitätein relatives Maß dafür, wie stark ein Atom Elektronen anzieht, wenn es eine kovalente Bindung bildet. ist ein relatives Maß dafür, wie stark ein Atom Elektronen anzieht, wenn es eine kovalente Bindung bildet. Es gibt verschiedene numerische Skalen zur Bewertung der Elektronegativität. Abbildung 4.4 „Elektronegativitäten verschiedener Elemente“ zeigt eine der beliebtesten — die Pauling-Skala. Die Polarität einer kovalenten Bindung kann beurteilt werden, indem der Unterschied in den Elektronegativitäten der beiden Atome bestimmt wird, die die Bindung eingehen. Je größer der Unterschied in den Elektronegativitäten ist, desto größer ist das Ungleichgewicht der Elektronenteilung in der Bindung. Obwohl es keine festen Regeln gibt, lautet die allgemeine Regel, wenn der Unterschied in den Elektronegativitäten kleiner als etwa 0,4 ist, wird die Bindung als unpolar betrachtet; Wenn der Unterschied größer als 0,4 ist, wird die Bindung als polar betrachtet. Wenn der Unterschied in den Elektronegativitäten groß genug ist (im Allgemeinen größer als etwa 1,8), wird die resultierende Verbindung eher als ionisch als als kovalent angesehen. Eine Elektronegativitätsdifferenz von Null zeigt natürlich eine unpolare kovalente Bindung an.
Abbildung 4.4 Elektronegativitäten verschiedener Elemente
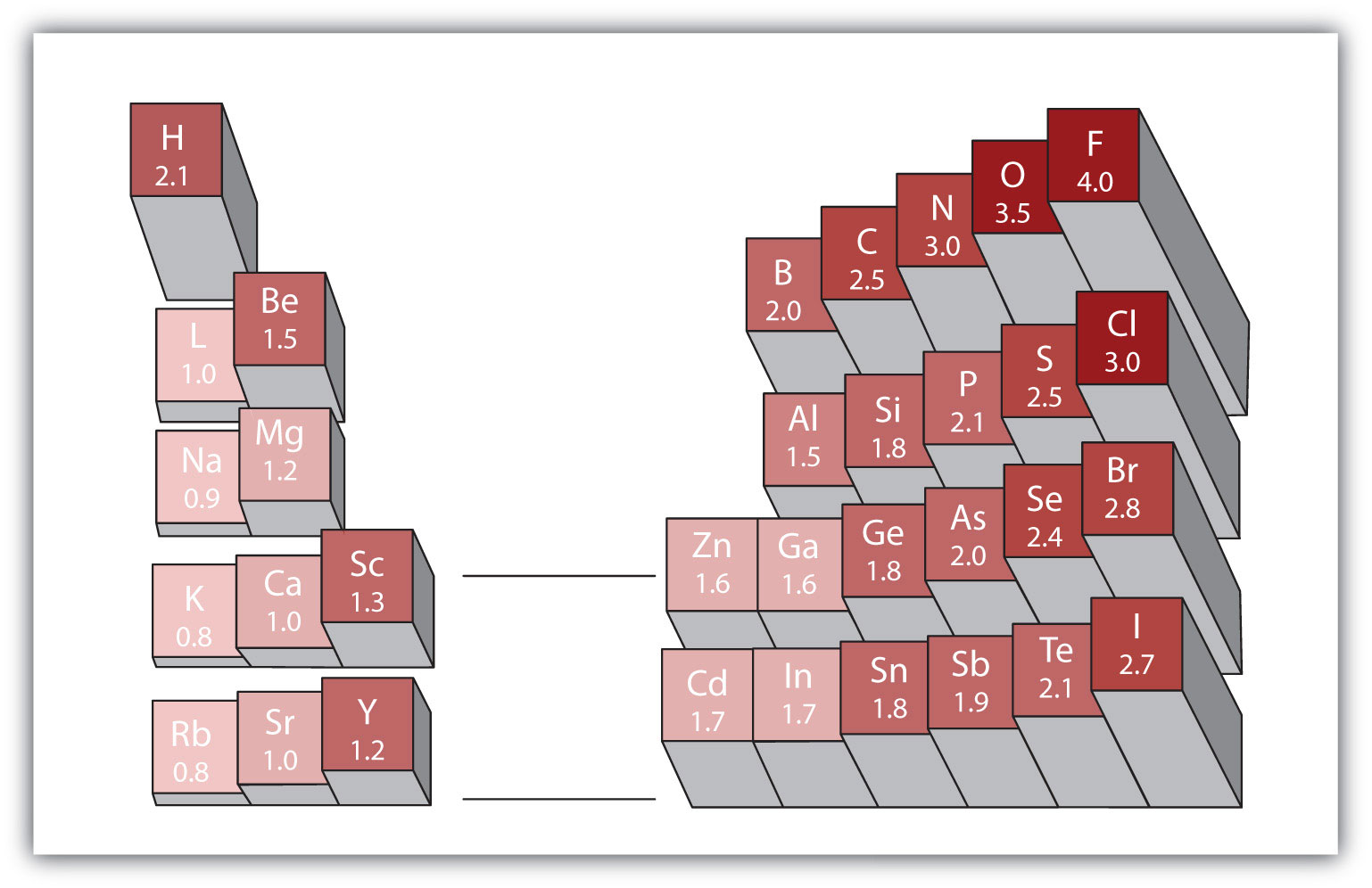
Eine beliebte Skala für Elektronegativitäten hat den Wert für Fluoratome auf 4,0 gesetzt, den höchsten Wert.
Ein genauerer Blick: Linus Pauling
Linus Pauling (1901-94), der wohl einflussreichste Chemiker des 20.Jahrhunderts, ist der einzige, der zwei individuelle (dh nicht geteilte) Nobelpreise gewonnen hat. In den 1930er Jahren verwendete Pauling neue mathematische Theorien, um einige grundlegende Prinzipien der chemischen Bindung zu formulieren. Sein 1939 erschienenes Buch The Nature of the Chemical Bond ist eines der bedeutendsten Bücher, die jemals in der Chemie veröffentlicht wurden.1935 wandte sich Paulings Interesse biologischen Molekülen zu und erhielt 1954 den Nobelpreis für Chemie für seine Arbeiten zur Proteinstruktur. (Er war der Entdeckung der Doppelhelixstruktur der DNA sehr nahe, als James Watson und James Crick 1953 ihre eigene Entdeckung ihrer Struktur ankündigten. 1962 erhielt er den Friedensnobelpreis für seine Bemühungen, Atomwaffentests zu verbieten.In seinen späteren Jahren wurde Pauling überzeugt, dass große Dosen von Vitamin C Krankheiten, einschließlich der Erkältung, verhindern würden. Die meisten klinischen Studien zeigten keinen Zusammenhang, aber Pauling nahm weiterhin täglich große Dosen ein. Er starb 1994, nachdem er ein Leben lang ein wissenschaftliches Erbe aufgebaut hatte, das nur wenige jemals erreichen werden.

Linus Pauling war einer der einflussreichsten Chemiker des 20.Jahrhunderts.
Beispiel 6
Beschreiben Sie die Elektronegativitätsdifferenz zwischen jedem Atompaar und die resultierende Polarität (oder Bindungsart).
- C und H
- H und H
- Na und Cl
- O und H
Lösung
- Kohlenstoff hat eine Elektronegativität von 2,5, während der Wert für Wasserstoff 2,1 beträgt. Der Unterschied beträgt 0,3, was eher gering ist. Die C-H-Bindung wird daher als unpolar angesehen.
- Beide Wasserstoffatome haben den gleichen Elektronegativitätswert-2.1. Der Unterschied ist Null, also ist die Bindung unpolar.
- Die Elektronegativität von Natrium beträgt 0,9, während die von Chlor 3,0 beträgt. Der Unterschied beträgt 2,1, was ziemlich hoch ist, und so bilden Natrium und Chlor eine ionische Verbindung.
- Mit 2,1 für Wasserstoff und 3,5 für Sauerstoff beträgt die Elektronegativitätsdifferenz 1,4. Wir würden eine sehr polare Bindung erwarten, aber nicht so polar, dass die OH–Bindung als ionisch angesehen wird.
Übung zum Aufbau von Fähigkeiten
-
C und O
-
K und Br
-
N und N
-
Cs und F
Beschreiben Sie den Elektronegativitätsunterschied zwischen jedem Atompaar und der resultierenden Polarität (oder Bindungsart).
Wenn die Bindungen eines Moleküls polar sind, kann das Molekül als Ganzes eine ungleichmäßige Verteilung der Ladung, abhängig davon, wie die einzelnen Bindungen ausgerichtet sind. Beispielsweise ist die Orientierung der beiden OH–Bindungen in einem Wassermolekül (Abbildung 4.5 „Physikalische Eigenschaften und Polarität“) unterschiedlich: Ein Ende des Moleküls hat eine teilweise positive Ladung und das andere Ende eine teilweise negative Ladung. Kurz gesagt, das Molekül selbst ist polar. Die Polarität von Wasser hat einen enormen Einfluss auf seine physikalischen und chemischen Eigenschaften. (Zum Beispiel ist der Siedepunkt von Wasser für ein so kleines Molekül hoch und beruht auf der Tatsache, dass polare Moleküle sich stark anziehen.) Im Gegensatz dazu sind die beiden C = O-Bindungen in Kohlendioxid zwar polar, liegen sich jedoch direkt gegenüber und heben sich so gegenseitig auf. Somit sind Kohlendioxidmoleküle insgesamt unpolar. Dieser Mangel an Polarität beeinflusst einige der Eigenschaften von Kohlendioxid. (Zum Beispiel wird Kohlendioxid bei -77 ° C zu einem Gas, fast 200 ° niedriger als die Temperatur, bei der Wasser kocht.)
Abbildung 4.5 Physikalische Eigenschaften und Polarität

Die physikalischen Eigenschaften von Wasser und Kohlendioxid werden durch ihre Polarität beeinflusst.
Übungen zur Überprüfung des Konzepts
-
Wie heißt der Abstand zwischen zwei Atomen in einer kovalenten Bindung?
-
Was bedeutet die Elektronegativität eines Atoms?
-
Welche Art von Bindung wird zwischen zwei Atomen gebildet, wenn der Unterschied in den Elektronegativitäten gering ist? Mittel? Groß?
-
Bindungslänge
-
Die Elektronegativität ist ein qualitatives Maß dafür, wie stark ein Atom Elektronen in einer kovalenten Bindung anzieht.
-
unpolar; polar; ionisch
Bindungslänge
Die Elektronegativität ist ein qualitatives Maß dafür, wie stark ein Atom Elektronen in einer kovalenten Bindung anzieht.
unpolar; polar; ionisch
Wichtige Erkenntnisse
- Kovalente Bindungen zwischen verschiedenen Atomen haben unterschiedliche Bindungslängen.
- Kovalente Bindungen können polar oder unpolar sein, abhängig von der Elektronegativitätsdifferenz zwischen den beteiligten Atomen.
-
Was ist länger — eine C–H–Bindung oder eine C-O-Bindung? (Siehe Tabelle 4.2 „Ungefähre Bindungslängen einiger Einfachbindungen“.)
-
Was ist kürzer — eine N-H-Bindung oder eine C-H-Bindung? (Siehe Tabelle 4.2 „Ungefähre Bindungslängen einiger Einfachbindungen“.)
-
Ein Nanometer beträgt 10-9 m. Unter Verwendung der Daten in Tabelle 4.2 „Ungefähre Bindungslängen einiger Einzelbindungen“ und Tabelle 4.3 „Vergleich der Bindungslängen für Einfach- und Mehrfachbindungen“, bestimmen Sie die Länge jeder Bindung in Nanometern.
- eine C–O–Bindung
- eine C=O-Bindung
- eine H-N-Bindung
- eine C≡N-Bindung
-
Ein Angstrom (Å) ist definiert als 10-10 m. Bestimmen Sie anhand der Tabelle 4.2 „Ungefähre Bindungslängen einiger Einfachbindungen“ und der Tabelle 4.3 „Vergleich der Bindungslängen für Einfach- und Mehrfachbindungen“ die länge jeder Bindung in Angström.
- eine C–C–Bindung
- eine C=C-Bindung
- eine N≡N-Bindung
- eine H-O-Bindung
-
Siehe Übung 3. Warum ist die Nanometereinheit als Einheit zum Ausdrücken von Bindungslängen nützlich?
-
Siehe Übung 4. Warum ist die Angstrom-Einheit als Einheit zum Ausdrücken von Bindungslängen nützlich?
-
Bestimmen Sie anhand von Abbildung 4.4 „Elektronegativitäten verschiedener Elemente“, welches Atom in jedem Paar die höhere Elektronegativität aufweist.
- H oder C
- O oder Br
- Na oder Rb
- I oder Cl
-
Bestimmen Sie anhand von Abbildung 4.4 „Elektronegativitäten verschiedener Elemente“, welches Atom in jedem Paar die niedrigere Elektronegativität aufweist.
- Mg oder O
- S oder F
- Al oder Ga
- O oder I
-
Werden die Elektronen gleichmäßig oder ungleich über jede kovalente Bindung verteilt? Wenn ungleich, zu welchem Atom werden die Elektronen stärker gezogen?
- eine C-O-Bindung
- eine F–F–Bindung
- eine S–N-Bindung
- eine I-Cl-Bindung
-
Werden die Elektronen gleichmäßig oder ungleich über jede kovalente Bindung verteilt? Wenn ungleich, zu welchem Atom werden die Elektronen stärker gezogen?
- eine C–C–Bindung
- eine S–Cl–Bindung
- eine O–H-Bindung
- eine H-H-Bindung
Was ist länger — eine C–H–Bindung oder eine C-O-Bindung? (Siehe Tabelle 4.2 „Ungefähre Bindungslängen einiger Einfachbindungen“.)
Was ist kürzer — eine N-H-Bindung oder eine C-H-Bindung? (Siehe Tabelle 4.2 „Ungefähre Bindungslängen einiger Einfachbindungen“.)
Ein Nanometer beträgt 10-9 m. Unter Verwendung der Daten in Tabelle 4.2 „Ungefähre Bindungslängen einiger Einzelbindungen“ und Tabelle 4.3 „Vergleich der Bindungslängen für Einfach- und Mehrfachbindungen“, bestimmen Sie die Länge jeder Bindung in Nanometern.
- eine C–O–Bindung
- eine C=O-Bindung
- eine H-N-Bindung
- eine C≡N-Bindung
Ein Angstrom (Å) ist definiert als 10-10 m. Bestimmen Sie anhand der Tabelle 4.2 „Ungefähre Bindungslängen einiger Einfachbindungen“ und der Tabelle 4.3 „Vergleich der Bindungslängen für Einfach- und Mehrfachbindungen“ die länge jeder Bindung in Angström.
- eine C–C–Bindung
- eine C=C-Bindung
- eine N≡N-Bindung
- eine H-O-Bindung
Siehe Übung 3. Warum ist die Nanometereinheit als Einheit zum Ausdrücken von Bindungslängen nützlich?
Siehe Übung 4. Warum ist die Angstrom-Einheit als Einheit zum Ausdrücken von Bindungslängen nützlich?
Bestimmen Sie anhand von Abbildung 4.4 „Elektronegativitäten verschiedener Elemente“, welches Atom in jedem Paar die höhere Elektronegativität aufweist.
- H oder C
- O oder Br
- Na oder Rb
- I oder Cl
Bestimmen Sie anhand von Abbildung 4.4 „Elektronegativitäten verschiedener Elemente“, welches Atom in jedem Paar die niedrigere Elektronegativität aufweist.
- Mg oder O
- S oder F
- Al oder Ga
- O oder I
Werden die Elektronen gleichmäßig oder ungleich über jede kovalente Bindung verteilt? Wenn ungleich, zu welchem Atom werden die Elektronen stärker gezogen?
- eine C-O-Bindung
- eine F–F–Bindung
- eine S–N-Bindung
- eine I-Cl-Bindung
Werden die Elektronen gleichmäßig oder ungleich über jede kovalente Bindung verteilt? Wenn ungleich, zu welchem Atom werden die Elektronen stärker gezogen?
- eine C–C–Bindung
- eine S–Cl–Bindung
- eine O–H-Bindung
- eine H-H-Bindung
-
Eine C-O-Bindung ist länger.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
Die tatsächlichen Bindungslängen sind sehr klein, so dass die Nanometereinheit den Ausdruck der Länge leichter verständlich macht.
-
- C
- O
- Na
- Cl
-
- ungleich zum O
- gleich
- ungleich zum N
- ungleich zum Cl
Eine C-O-Bindung ist länger.
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
Die tatsächlichen Bindungslängen sind sehr klein, so dass die Nanometereinheit den Ausdruck der Länge leichter verständlich macht.
- C
- O
- Na
- Cl
- ungleich zum O
- gleich
- ungleich zum N
- ungleich zum Cl
