Die chemische Ionisation (CI) ist eine weiche Ionisationstechnik, die die direkte Anwendung der Forschungsergebnisse von Molekül- und Ionenreaktionen in der analytischen Chemie darstellt. Die früheste Ionisationstechnik war die Elektronenbeschuss-Ionisation (EI). Das durch EI erhaltene Produkt weist viele Fragmente auf, die schwer zu analysieren sind. CI, das nur sehr wenige Fragmente produzierte, begann in den 1950er Jahren und hat ein großes Potenzial in der analytischen Chemie.
Beim CI-Prozess bombardieren Elektronen zunächst das Reagenzgas, um Reagenzionen zu erzeugen. Die Probenmoleküle werden dann durch Reagenzionen durch Molekül- und Ionenreaktionsweg ionisiert. Die 1970er Jahre galten als Meilenstein in der Entwicklung von CI. Zu dieser Zeit lösten die Forscher die Mängel der Arbeit von CI in einer Vakuumumgebung, so dass CI unter atmosphärischen Bedingungen arbeiten konnte. Die atmosphärische chemische Ionisation liefert Energie aus der Koronaentladung und erfordert keine Vakuumumgebung, was den Bereich der CI-Anwendungen erheblich erweitert. Gegenwärtig ist CI in der Massenspektrometrietechnik weit verbreitet.
Das Prinzip der chemischen Ionisation
Das Prinzip von CI besteht darin, das Reagenzion X+ zu verwenden, um mit dem Analytmolekül A zu reagieren, um eine Ionisierung des Analyten zu erreichen:
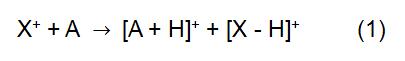
Bei der obigen Reaktion leitet sich X+ vom ionisierten Reaktionsgas ab. Einige gängige Reagenzgase umfassen Methan, Ammoniak, Wasser und Isobutan. Die Reaktionszeit und die Geschwindigkeitskonstante (k) in der Formel können durch Literatur oder Messung erhalten werden. Wenn das Reagenzion X + H3O + ist, lautet die Formel (2):
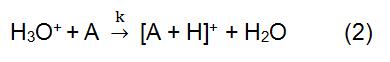
Reagenzionen werden von einer Ionenquelle erzeugt. Häufig verwendete Ionenquellen umfassen hauptsächlich Strahlungsquelle, Hohlkathodenentladungsstromquelle und gewöhnliche Glimmentladungsstromquelle. 210Po und 241Am sind die häufigsten Strahlungsquellen. Der Ionisationsprozess beginnt mit den von 210Po und 241Am emittierten Alphateilchen. Es hat eine hohe Energie und kann mit dem Reagenzgas kollidieren, um Reagenzionen und Elektronen zu erzeugen. Wenn die erzeugten Elektronen hoch genug sind, können sie mit dem Reagenzgas kollidieren, um neue Reagenzionen und Elektronik zu bilden. In der CI unter Verwendung von H3O + als Reagenziion wird üblicherweise eine Hohlkathodenentladungsstromquelle verwendet, die 99,5% von H3O + erzeugen kann.
Entsprechend den Bedingungen der chemischen Ionisation wird CI in chemische Niederdruck-Ionisation klassifiziert (
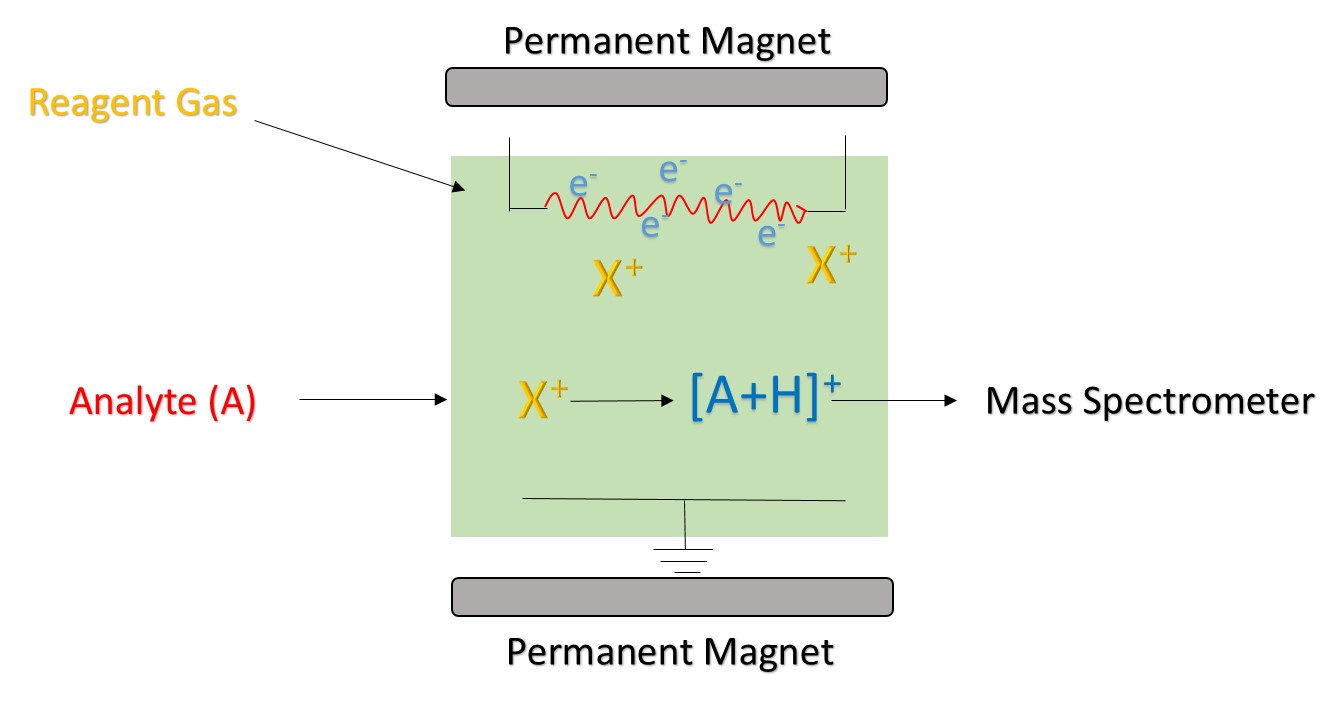 Abbildung 1. Das Prinzip der chemischen Ionisation
Abbildung 1. Das Prinzip der chemischen Ionisation
Vor- und Nachteile von CI
Die Auflösung des CI-Spektrums ist einfach und das genaue Molekulargewicht des Analyten kann erhalten werden. Das durch CI erhaltene Produkt weist wenige Fragmente auf, und seine Produkte sind hauptsächlich Moleküle und Ionen des Analyten. Die Selektivität von CI kann leicht durch Auswahl eines geeigneten Reagenzions erhöht werden. Beispielsweise reagiert das Reagenziion H3O+ nur mit einer organischen Substanz mit einer Protonenaffinität größer als H3O+. Darüber hinaus hat es eine hohe Empfindlichkeit und schnelle Reaktion (15s). Wenn jedoch die reaktiven Ionen unrein sind und eine Vielzahl von chemischen Ionisationsreaktionen gleichzeitig auftreten, wird die Massenspektrometrie schwierig.
Beispiele für CI-Anwendungen
Gegenwärtig wird CI häufig als Ionenquelle in Massenspektrometriesystemen zum Nachweis verschiedener Spurenstoffe verwendet. CI kann zum Nachweis von Substanzen wie Spurengasen in der Atmosphäre, Pestizidrückständen in Gemüse und Obst, Melamin in Milchpulver, Weichmachern und Herbiziden im Boden verwendet werden. Darüber hinaus kann CI auch zur Materialidentifikation verwendet werden, z. B. zur Identifizierung der Qualität von Tee.
- Messung von flüchtigen organischen Verbindungen (VOC)
Bei der Messung von VOC durch CI wird im Allgemeinen H3O+ als Reagenziion verwendet. H3O + reagiert nicht mit den meisten Substanzen in der Luft wie O2, N2, CO2 usw. Andererseits sind die meisten Protonentransferreaktionen nicht dissoziiert, so dass die Produktionen einzeln sind, was die Analyse der Ergebnisse vereinfacht. Das Prinzip der VOC-Messung mit H3O+ als Reagenziion ist in Gleichung (3) dargestellt. Das Endprodukt wurde mittels Protonentransferreaktion Massenspektrometrisch aufgelöst.
- Bestimmung von Melamin in Milchpulver
Bei der Messung von Melamin durch CI wird N2 als Reagenzgas verwendet. Unter der Einwirkung von Hochspannung durchlaufen N2 und H2O komplexe physikochemische Reaktionen, um Reagenzionen H3O + zu erzeugen. Der Reaktionsablauf ist in Formel (3-6) angegeben. H3O + reagiert mit Melamin im Milchpulver, und das Reaktionsprinzip ist in Formel (2) gezeigt.
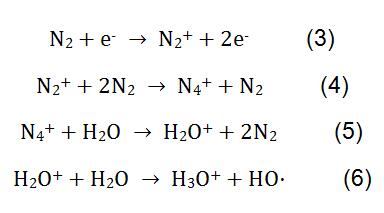
- Identifizierung der Teequalität
Verschiedene Teesorten können identifiziert werden, indem die chemischen Substanzen auf der Oberfläche von Teeblättern mit CI gemessen werden. H3O + reagiert mit der Oberfläche des Tees mit Butanol, Geraniol, Koffein und anderen Substanzen, und die Reaktionsprodukte bilden unterschiedliche Massenspektren auf dem Massenspektrometer. Der Gehalt derselben Substanz in verschiedenen Teesorten ist unterschiedlich, daher ist das durch CI-Nachweis gebildete Massenspektrum unterschiedlich. Das Massenspektrum kann die chemischen Fingerabdruckeigenschaften des Tees bis zu einem gewissen Grad widerspiegeln. Daher hat CI einen wichtigen praktischen Anwendungswert für die schnelle Identifizierung und Qualitätsanalyse von Tee.
Die chemische Ionisation wird aufgrund ihrer starken Selektivität und hohen Empfindlichkeit häufig in der Massenspektrometrie eingesetzt. Die chemische Ionisations-Massenspektrometrie (CIMS) ermöglicht nicht nur die Tandem-massenspektrometrische Identifizierung von Substanzen in komplexen Proben, sondern erhält auch chemische Fingerabdruckdaten für Proben für die chemometrische Analyse. Die Anwendung von CIMS wirkt sich positiv auf die Förderung der Entwicklung von Lebensmitteln, Medizin, Umweltschutz, Landwirtschaft und anderen Branchen aus.
Wir haben kurz die CI vorgestellt, eine Art Ionisationsmethode, die Ihnen helfen kann, mehr über Massenspektrometrie zu verstehen. Bei Creative Proteomics haben wir die professionelle Massenspektrometrie-Plattform entwickelt, die modernste Instrumente enthält. Durch den Einsatz der Massenspektrometrie kann Creative Proteomics verschiedene Dienstleistungen anbieten, um verschiedene Anforderungen zu erfüllen, darunter:
- Proteomik-Dienst
- Metabolomik-Dienst
- Glykomik-Dienst
- Fales HM; et al. Vergleich von Massenspektren einiger biologisch wichtiger Verbindungen, wie sie durch verschiedene Ionisationstechniken erhalten wurden. Analytische Chemie, 1975, 47(2):207-219.
- Lindinger W; et al. Online-Überwachung flüchtiger organischer Verbindungen auf PPTV-Niveau mittels Protonen-Transfer-Reaktions-Massenspektrometrie (PTR-MS) medizinische Anwendungen, Lebensmittelkontrolle und Umweltforschung. Internationale Zeitschrift für Massenspektrometrie & Ionenprozesse, 1998, 173(3):191-241.
- Chen H; et al. Oberflächendesorption Atmosphärendruck chemische Ionisations-Massenspektrometrie für die direkte Analyse von Umgebungsproben ohne toxische chemische Kontamination. Zeitschrift für Massenspektrometrie, 2010, 42(8):1045-1056.
- Yang S; et al. Nachweis von Melamin in Milchprodukten durch Oberflächendesorption Atmosphärendruck Chemische Ionisation Massenspektrometrie. Analytische Chemie, 2009, 81(7):2426.
