Prozess der individuellen Bildung aus Embryonen
Der menschliche Körper besteht aus insgesamt etwa 60 Billionen Zellen. Jede dieser Zellen stammt letztendlich aus einer einzigen befruchteten Eizelle, die sich zu teilen begann und sich schließlich in die somatischen Zellen unterschiedlicher Morphologie und Funktion differenzierte, die die verschiedenen Gewebe und Organe des menschlichen Körpers bilden. Es wird angenommen, dass pluripotente Stammzellen ein ähnliches Potenzial ohne extraembryonale Differenzierung haben.
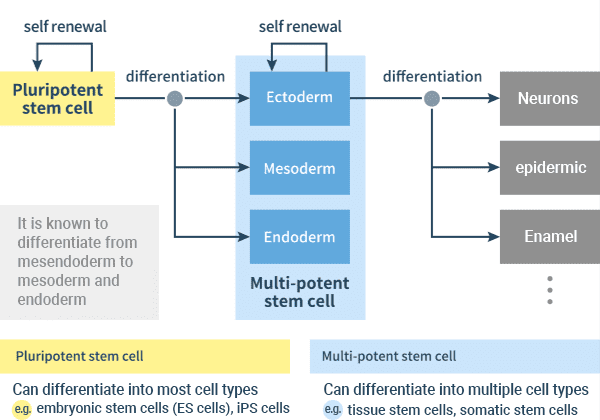
Abbildung: Induktion der verschiedenen Gewebezelltypen aus pluripotenten Stammzellen über drei Keimschichten
Bei der Bildung eines Individuums verwandeln (differenzieren) sich die Stammzellen in Zellen, die sich von sich selbst unterscheiden, während die Proliferationsfähigkeit erhalten bleibt, sich zu teilen und mehr Zellen des gleichen Typs zu erzeugen oder sich weiter in eine speziellere Form zu differenzieren. So entstehen verschiedene Organe.
Im Blastozystenstadium, einem frühen Stadium der Embryonalentwicklung, gibt es Zellen, die sich in fast jeden Zelltyp des Körpers differenzieren können, eine Fähigkeit, die als pluripotentcy.In in vitro können pluripotente Stammzellen, einschließlich ES-Zellen und iPS-Zellen, in die aus dem Endoderm, Mesoderm und Ektoderm abgeleiteten Zelltypen differenzieren, sind jedoch nicht in der Lage, sich allein zu einem vollständigen Organismus zu entwickeln. Im Gegensatz dazu werden Stammzellen, die sich nur in eine begrenzte Anzahl von Zelltypen differenzieren können, wie Gewebestammzellen und somatische Stammzellen, als multipotente Stammzellen bezeichnet.
Diese Zellen werden nicht nur für die Grundlagenforschung verwendet, wo sie in spezifische Zellen differenziert werden, um ihre Eigenschaften zu untersuchen, sondern auch für das „Drug Discovery Screening“, um nach Wirkstoffkandidaten zu suchen, und für die „regenerative Medizin“, wo sie transplantiert oder als Therapeutikum an Patienten verabreicht werden. Die Kultur pluripotenter Stammzellen unterscheidet sich jedoch in vielerlei Hinsicht von der herkömmlichen somatischen Zellkultur, und es soll schwierig sein, den undifferenzierten Zustand aufrechtzuerhalten und ein hohes Maß an Reproduzierbarkeit sicherzustellen.
Klassifizierung und Eigenschaften von multipotenten Stammzellen und pluripotenten Stammzellen
Multipotente Stammzellen
Multipotente Stammzellen haben die Fähigkeit, sich in Zellen zu differenzieren, die spezifische Gewebe und Organe umfassen, und umfassen sowohl Gewebestammzellen als auch somatische Stammzellen.Gewebestammzellen sind gewebespezifisch und haben die Fähigkeit, sich entweder durch Teilung in Tochterzellen gleichen Typs selbst zu erneuern oder sich in speziellere Zellen innerhalb des Gewebes zu differenzieren.
Somatische Stammzellen existieren in vivo und können sich in eine begrenzte Anzahl von Zelltypen differenzieren. Mesenchymale Stammzellen (MSCs) sind eine Art somatischer Stammzellen und können sich in Knochen, Knorpel, Blutgefäße und Kardiomyozyten differenzieren. MSCs werden relativ leicht aus Knochenmark, Nabelschnurgewebe, Nabelschnurblut und Fettgewebe gewonnen.Es wird berichtet, dass multipotente Stammzellen eine entzündungshemmende Wirkung, eine Wachstumsfaktor-induzierende Wirkung, eine proangiogene Wirkung haben und eine wichtige Rolle bei der Gewebereparatur spielen. Darüber hinaus sollen sie im Vergleich zu pluripotenten Stammzellen ein geringeres Krebsrisiko aufweisen, ein wichtiger Sicherheitsaspekt.Regenerative Medizinprodukte wurden bereits weltweit für die Behandlung von Rückenmarksverletzungen und posthämatopoetischen Stammzelltransplantationen bei akuten Graft-versus-Host-Erkrankungen zugelassen.
Tabelle: Examples of Approved Regenerative Medical Products That Use Human MSCs in the World-
| Regenerative Medical Products | Approved Countries | Manufacturing Distributors | Origin MSC | Applications |
|---|---|---|---|---|
| PROCHYMAL® | Canada, New Zealand | Mesoblast | Allogeneic bone marrow-derived MSC | Acute GVHD*(pediatric) |
| TEMCELL® HS Inj. | Japan | JCR Pharma | Allogeneic bone marrow-derived MSC | Acute GVHD* |
| Stemirac® Inj. | Japan (conditional approval) | Nipro | Autologous bone marrow-derived MSC | Spinal cord injury |
| Heartcellgram-AMI® | South Korea | Pharmicell | Autologous bone marrow-derived MSC | Acute myocardial infarction |
| Cupistem® | South Korea | Anterogen | MSC derived from own fat | Crohn’s disease |
| CARTISTEM® | South Korea, EU | Medipost | Allogeneic cord blood-derived MSC | Knee osteoarthritis |
| Stempeucel® | EU, India (conditional approval) |
Stempeutics Research |
Allogeneic bone marrow-derived MSC | Knee osteoarthritis |
| Allostem® | USA | Allosource | Allogeneic fat derived MSC (A combination product composed of human demineralized bone matrix) |
Bone damage |
| Osteocel® Plus | US | NuVasive | Allogeneic bone marrow-derived MSC (A combination product composed of osteoprogenitor cells and human demineralized bone matrix) |
Bone repair (361HCT/P) |
*GVHD: Graft Versus Host Disease
Pluripotente Stammzellen
Pluripotente Stammzellen sind Stammzellen, die sich in fast jede Zelle des Körpers differenzieren können. ESCs, embryonale Keimzellen (EGCs) und iPSCs wurden bisher als Arten von pluripotenten Stammzellen etabliert.
WSR werden aus der inneren Zellmasse in der hohlen Blastozyste gebildet, die ein frühes Stadium der Embryonalentwicklung nach der Teilung durch die Zygote in eine Blastula darstellt. In Japan werden ES-Zellen aus dem Überschuss an befruchteten Eiern hergestellt, die nach einer Unfruchtbarkeitsbehandlung verworfen werden. EGCs werden aus den zellulären Vorläufern von Spermien und Eiern (Urkeimzellen) entwickelt und haben fast die gleichen Eigenschaften wie ESCs.iPSCs werden erzeugt, indem somatische Zellen durch die Einführung spezifischer Gene in einen undifferenzierten Zustand umprogrammiert werden. Die Etablierung von iPSCs hat es uns ermöglicht, Zellen ähnlich wie ESCs von Spendern zu erhalten. Es ist auch möglich, Gewebe von einem Patienten mit einer Krankheit zu erhalten, iPSCs aus dem Gewebe zu etablieren und eine Differenzierung zu induzieren, um ein In-vitro-Modell der Krankheit bereitzustellen. Daher haben somatische Zellen, wie Nervenzellen oder Kardiomyozyten, die durch induzierte Differenzierung von iPSCs erzeugt werden, ein großes Potenzial für Anwendungen wie die Bestimmung der Krankheitsätiologie, die Bewertung der Wirksamkeit und Nebenwirkungen von Arzneimitteln und die Transplantation in Patienten als regenerative Medizin Therapien. Es wurden jedoch unbeabsichtigte Genmutationen bei der Etablierung von iPSC-Kulturen sowie bei der Subkultur von iPSCs und ESCs über lange Zeiträume berichtet. Derzeit ist nicht bekannt, ob all diese genetischen Mutationen gefährlich sind, und die Forscher diskutieren, wie sie ihre Sicherheit für den praktischen Einsatz in der Zukunft am besten bewerten können.
