Ladungstransferkomplexe weisen Ladungstransferübergänge auf, bei denen Absorption den Transfer eines Elektrons vom Donor zum Akzeptor auslöst.
Wenn Jod in Lösungen von Donorlösungsmitteln gelöst wird, wird die auffällige violette Farbe des molekularen Jods durch eine gelbbraune Farbe ersetzt. Dies liegt daran, dass Ladungstransferkomplexe wie die von \(I_2\) gebildeten Licht auf eine Weise absorbieren können, die weder der Donor noch der Akzeptor alleine können. Insbesondere zeigen Ladungstransferkomplexe in ihren Absorptionsspektren Ladungstransferbanden (CT-Banden). Beim Ladungstransferübergang wird der anfängliche partielle Ladungstransfer von der Donor-Lewis-Base zur Akzeptor-Lewis-Säure im Ladungstransferkomplex durch Photoanregung weiter vorangetrieben.
\
Die Art dieser Ladungstransferübergänge ist aus der Orbitalbeschreibung der Bindung für Iod-Ladungstransferkomplexe ersichtlich. Wenn sich ein Donor-I2-Komplex bildet, führt die Bildung von Donor-I2-Bindungs- und Antibonding-Orbitalen zu einer Verschiebung des \ (I2 \ sigma \ rightarrow \ sigma * \) Übergangs zu einer höheren Energie a die Bildung einer neuen Ladungstransferbande, die mit der Anregung eines Elektrons vom weitgehend aminzentrierten Amin-I2 \ (\ sigma \) -Orbital zum weitgehend I2-zentrierten Amin-I2 \ (\ sigma * \) -Orbital verbunden ist.
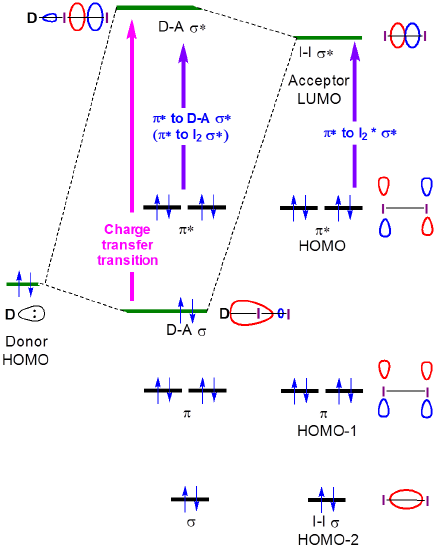
Abbildung 6.4.2.\( \pageIndex{2}\). Grenzorbitale Wechselwirkungen, die zu Änderungen der Absorptionsspektren von Jod führen, wenn es einen Ladungstransferkomplex mit einem Lewis-Basendonor bildet.
Lösungen von I2 als Gemische mit Lewis-Basen wie Aminen und in Donorlösungsmitteln zeigen deutlich Ladungstransferbanden. Mehrere solcher Spektren sind in Abbildung 6.4.2.3 angegeben.
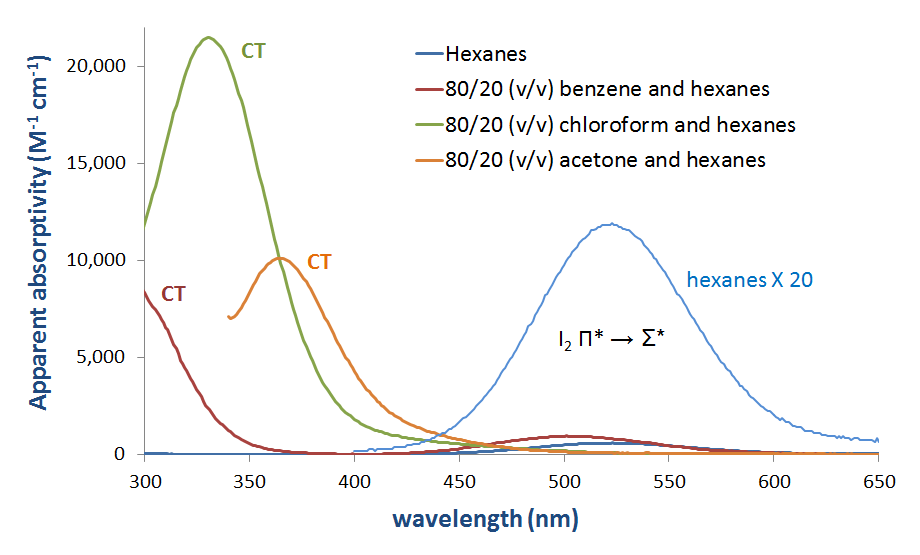
Abbildung 6.4.2.\( \pageIndex{3}\). Absorptionsspektrum von molekularem Jod (I2) in verschiedenen Lösungsmitteln, das das Auftreten einer CT-Bande in Donorlösungsmitteln zeigt.*
Im Prinzip nehmen die Energien sowohl des Ladungstransfers als auch der \(I_2~\pi *~\rightarrow ~D-A~ \sigma *\) Übergänge mit der Donorstärke zu, wie in Abbildung 6.4.2.4 gezeigt.
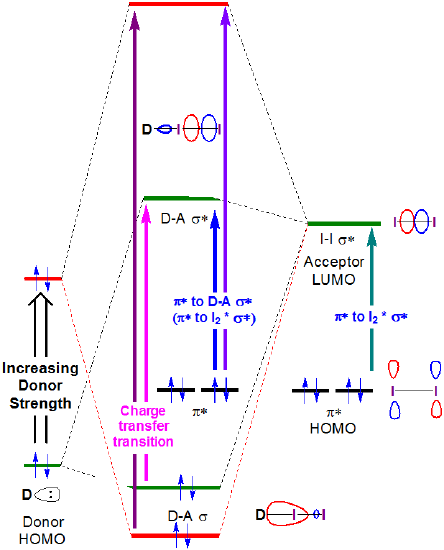
Abbildung 6.4.2.\( \pageIndex{4}\). Erwartete Änderung der Grenzorbitalenergien, die mit der Bildung eines I2-Donorakzeptorkomplexes verbunden sind, wenn die HOMO-Energie des Donors erhöht wird.
Wie in Abbildung 6.4.2 zu sehen ist. es könnte erwartet werden, dass die Energie des Ladungstransferbandes zunimmt, wenn die Energie des Donorhomo zunimmt, um sich der Energie des Akzeptors LUMO zu nähern. Obwohl bei der Interpretation der Lösungsphasenspektren von I2 Vorsicht geboten ist, wird diese Erwartung durch eine flüchtige und qualitative Analyse der Spektren in Abbildung 6.4.2.3 bestätigt. Die CT-Übergangsenergie verschiebt sich in Richtung niedrigerer Wellenlängen (und damit höherer Energie), da die höchste besetzte Atomorbitalenergie für das Donoratom zunimmt, wenn von Aceton (Sauerstoff, -15.85 eV) zu Chloroform (Chlor, -13.67eV) und schließlich Benzol (Kohlenstoff, -10.66 eV).**
Ladungstransferbänder in der Übergangsmetallchemie
Ladungstransferübergänge sind für die intensive Farbe vieler Übergangsmetallkomplexe verantwortlich. In diesen Fällen führt die schwache Lewis-Säure-Base-Wechselwirkung jedoch zu einer unvollständigen Elektronendonation und Akzeptanz in einer \ (p \ pi -d \ pi \) (oder \ (p \ pi-d \ pi *\)) -Bindung zwischen einem Metall und einem Liganden. Die Ladungstransferbanden in den Absorptionsspektren dieser Komplexe beinhalten den Transfer von Elektronen zwischen dem Metall und dem Liganden. Insbesondere
- Metall-Ligand-Ladungstransfer-Banden (MLCT oder CTTL) beinhalten den Transfer eines Elektrons von einem gefüllten oder teilweise gefüllten Metall-d-Orbital zu einem Ligand \ (\ pi *\) -Typ-Orbital.

- Ligand to metal Charge Transfer (LMCT oder CTTL) Banden beinhalten den Transfer eines Elektrons von einem gefüllten oder teilweise gefüllten Ligandorbital zu einem Metall-d-Orbital.

- In einigen Bimetallkomplexen können Metall-Metall-Ladungstransferbänder beobachtet werden. Diese werden jedoch normalerweise nur als Elektronentransfer und nicht als Verschiebung des Status einer Lewis-Säure-Base-Wechselwirkung angesehen.
Da Metall-Ligand-Ladungstransferbänder einen intermolekularen Elektronentransfer zwischen dem Metall und dem Liganden beinhalten, um einen hochenergetischen Redoxzustand zu erzeugen, ist der CT-angeregte Zustand sowohl ein besseres Oxidationsmittel als auch ein Reduktionsmittel als der Grundzustand. Folglich wurde intensiv an der Entwicklung von Metallkomplexen geforscht, deren angeregte Ladungstransferzustände starke Oxidations- und Reduktionsmittel sind, in der Erwartung, dass sie die photokatalytische Oxidation und Reduktion von Substraten antreiben können.
* Das scheinbare Absorptionsvermögen von I2 in Hexanen wurde aus dem Absorptionsspektrum von 215 µM I2 in Hexanen berechnet. Alle anderen scheinbaren Absorptivitäten wurden aus Absorptionsspektren von Lösungen berechnet, die 44 µM in I2 betrugen.
** Die Bandpositionen sind nicht die CT-Bandenergien und die angegebenen HOMO-Energien sind atomare Energieniveaus und entsprechen nicht unbedingt dem HOMO des Donors in Lösung. Aufgrund dieser und anderer Vereinfachungen soll diese Analyse keine rigorose rechnerische Analyse der Faktoren ersetzen, die zu CT-Bandpositionen führen.
1. Meyerstein, D.; Treinin, A., Ladungstransferkomplexe von Jod und anorganischen Anionen in Lösung. Transaktionen der Faraday-Gesellschaft 1963, 59 (0), 1114-1120.
2. Baskar, A. J. A.; Rajpurohit, A. S.; Panneerselvam, M.; Jaccobb, M.; RoopSingh, D.; Kannappan, V., Experimentelle und theoretische Analyse des Substituenteneffekts auf Ladungstransferkomplexe von Jod und einigen Alkylbenzolen in n-Hexanlösung bei 303K. Chemische Datensammlungen 2017, 7-8, 80-92.
