Lernziele
- Schreiben Sie die chemische Formel für eine einfache ionische Verbindung.
- Erkennen Sie mehratomige Ionen in chemischen Formeln.
Wir haben bereits einige chemische Formeln für einfache ionische Verbindungen gefunden. Eine chemische Formel ist eine kurze Liste der Elemente in einer Verbindung und die Verhältnisse dieser Elemente. Um besser zu verstehen, was eine chemische Formel bedeutet, müssen wir überlegen, wie eine ionische Verbindung aus ihren Ionen aufgebaut ist.
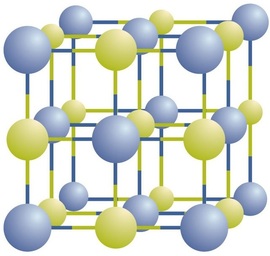
Ionische Verbindungen existieren als alternierende positive und negative Ionen in regelmäßigen, dreidimensionalen Arrays, die Kristalle genannt werden (Abbildung \(\pageIndex{1}\)). Wie Sie sehen können, gibt es keine einzelnen \ (\ce {NaCl}\) „Partikel“ im Array; Stattdessen gibt es ein kontinuierliches Gitter aus abwechselnden Natrium- und Chloridionen. Wir können jedoch das Verhältnis von Natriumionen zu Chloridionen, ausgedrückt in möglichst geringen ganzen Zahlen, zur Beschreibung der Verbindung verwenden. Im Falle von Natriumchlorid beträgt das Verhältnis von Natriumionen zu Chloridionen, ausgedrückt in niedrigsten ganzen Zahlen, 1:1, also verwenden wir \ (\ce{NaCl}\) (ein \ (\ce{Na}\) Symbol und ein \ (\ce{Cl}\) Symbol), um die Verbindung darzustellen. Somit ist \ (\ce{NaCl}\) die chemische Formel für Natriumchlorid, die die relative Anzahl verschiedener Ionen in der Verbindung präzise beschreibt. Eine makroskopische Probe besteht aus Myriaden von NaCl-Paaren; Jedes einzelne Paar wird als Formeleinheit bezeichnet. Obwohl es zweckmäßig ist zu glauben, dass \ (\ce {NaCl}\) Kristalle aus einzelnen \ (\ce{NaCl}\) Einheiten bestehen, zeigt Abbildung \(\pageIndex {1}\), dass kein einzelnes Ion ausschließlich mit einem anderen einzelnen Ion assoziiert ist. Jedes Ion ist von Ionen entgegengesetzter Ladung umgeben.
Die Formel für eine ionische Verbindung folgt mehreren Konventionen. Zuerst wird das Kation vor das Anion geschrieben. Da die meisten Metalle Kationen bilden und die meisten Nichtmetalle Anionen bilden, listen Formeln normalerweise zuerst das Metall und dann das Nichtmetall auf. Zweitens werden Gebühren nicht in einer Formel geschrieben. Denken Sie daran, dass in einer ionischen Verbindung die Komponentenspezies Ionen und keine neutralen Atome sind, obwohl die Formel keine Ladungen enthält. Schließlich hat die richtige Formel für eine ionische Verbindung immer eine Nettoladung von Null, was bedeutet, dass die gesamte positive Ladung der gesamten negativen Ladung entsprechen muss. Um die richtige Formel einer beliebigen Kombination von Ionen zu bestimmen, bestimmen Sie, wie viele von jedem Ion benötigt werden, um die gesamten positiven und negativen Ladungen in der Verbindung auszugleichen.
Diese Regel beruht letztlich auf der Tatsache, dass Materie insgesamt elektrisch neutral ist.
Angenommen, es gibt nur ein Atom, wenn kein Index vorhanden ist. Wir verwenden 1 nicht als Index.
Wenn wir uns die ionische Verbindung ansehen, die aus Lithiumionen und Bromidionen besteht, sehen wir, dass das Lithiumion eine 1 + −Ladung und das Bromidion eine 1- Ladung hat. Nur ein Ion von jedem wird benötigt, um diese Ladungen auszugleichen. Die Formel für Lithiumbromid lautet \(\ce{LiBr}\).
Wenn eine ionische Verbindung aus Magnesium und Sauerstoff gebildet wird, hat das Magnesiumion eine 2 + −Ladung und das Sauerstoffatom eine 2- Ladung. Obwohl beide Ionen höhere Ladungen aufweisen als die Ionen in Lithiumbromid, gleichen sie sich dennoch in einem Eins-zu-Eins-Verhältnis aus. Daher ist die richtige Formel für diese ionische Verbindung \(\ce{MgO}\).
Betrachten Sie nun die ionische Verbindung, die durch Magnesium und Chlor gebildet wird. Ein Magnesiumion hat eine 2 + Ladung, während ein Chlorion eine 1− Ladung hat:
\
Die Kombination eines Ions von jedem gleicht die positiven und negativen Ladungen nicht vollständig aus. Der einfachste Weg, diese Ladungen auszugleichen, besteht darin, die Anwesenheit von zwei Chloridionen für jedes Magnesiumion anzunehmen:
\
Jetzt sind die positiven und negativen Ladungen ausgeglichen. Wir könnten die chemische Formel für diese ionische Verbindung als \(\ce{MgClCl}\) schreiben, aber die Konvention ist, einen numerischen Index zu verwenden, wenn es mehr als ein Ion eines bestimmten Typs gibt —\(\ce{MgCl2}\). Diese chemische Formel besagt, dass es in dieser Formel ein Magnesiumion und zwei Chloridionen gibt. (Lesen Sie den „Cl2“ -Teil der Formel nicht als Molekül des zweiatomigen elementaren Chlors. Chlor existiert in dieser Verbindung nicht als zweiatomiges Element. Es besteht vielmehr aus zwei einzelnen Chloridionen.) Konventionell wird in den Formeln ionischer Verbindungen das niedrigste ganzzahlige Verhältnis verwendet. Die Formel \ (\ce {Mg2Cl4}\) hat ausgeglichene Ladungen mit den Ionen im Verhältnis 1: 2, ist aber nicht das niedrigste ganzzahlige Verhältnis.
Für Verbindungen, bei denen das Ionenverhältnis nicht so offensichtlich ist, können die Indizes in der Formel durch Kreuzen von Ladungen erhalten werden: Verwenden Sie den absoluten Wert der Ladung eines Ions als Index für das andere Ion. Diese Methode ist schematisch in Abbildung 3.3.2 dargestellt.
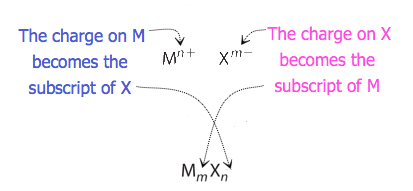
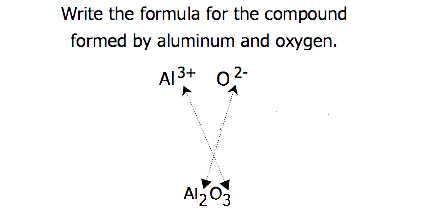
Beim Überqueren von Ladungen ist es manchmal notwendig, die Indizes auf ihr einfachstes Verhältnis zu reduzieren, um die empirische Formel zu schreiben. Betrachten Sie zum Beispiel die Verbindung, die durch Pb gebildet Wird4+ und O2−. Die Verwendung der Absolutwerte der Ladungen an den Ionen als Indizes ergibt die Formel Pb2O4. Dies vereinfacht zu seiner korrekten empirischen Formel PbO2. Die empirische Formel hat ein Pb4 + -Ion und zwei O2− Ionen.
Example \(\pageIndex{1}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Natriumion und das Schwefelion
- das Aluminiumion und das Fluoridion
- das 3+ Eisenion und das Sauerstoffion
Lösung
- Um ein Valenzschalenoktett zu erhalten, bildet Natrium ein Ion mit einer Ladung von 1+, während das Schwefelion hat eine 2− Ladung. Zwei Natrium-1 + -Ionen werden benötigt, um die 2− Ladung auf dem Schwefelion auszugleichen. Anstatt die Formel als \(\ce{NaNaS}\) zu schreiben, verkürzen wir sie konventionell auf \(\ce{Na2S}\).
- Das Aluminiumion hat eine 3+ Ladung, während das durch Fluor gebildete Fluoridion eine 1- Ladung hat. Drei Fluor-1- Ionen werden benötigt, um die 3 + -Ladung des Aluminiumions auszugleichen. Diese Kombination wird als \(\ce{AlF3}\) geschrieben.
- Eisen kann zwei mögliche Ionen bilden, aber das Ion mit einer Ladung von 3+ ist hier angegeben. Das Sauerstoffatom hat eine 2- Ladung als Ion. Um die positiven und negativen Ladungen auszugleichen, betrachten wir das kleinste gemeinsame Vielfache —6: Zwei Eisen−3+ −Ionen ergeben 6+, während drei 2- Sauerstoff-Ionen 6- ergeben, wodurch die insgesamt positiven und negativen Ladungen ausgeglichen werden. Daher lautet die Formel für diese ionische Verbindung \ (\ce {Fe2O3}\). Verwenden Sie alternativ die in Abbildung 3.3.2 gezeigte Methode der Kreuzungsladungen.
Übung \(\pageIndex{1}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Calcium-Ion und das Sauerstoff-Ion
- das 2+ Kupfer-Ion und das Schwefel-Ion
- das 1+ Kupfer-Ion und das Schwefel-Ion
Antwort a:
CaO
Antwort b:
CuS
Antwort c:
Cu2S
Mehratomige Ionen
Einige Ionen bestehen aus Gruppen von Atomen, die kovalent miteinander verbunden sind und eine elektrische Gesamtladung aufweisen. Da diese Ionen mehr als ein Atom enthalten, werden sie als mehratomige Ionen bezeichnet. Die Lewis-Strukturen, Namen und Formeln einiger mehratomiger Ionen sind in Tabelle 3.3.1 enthalten.
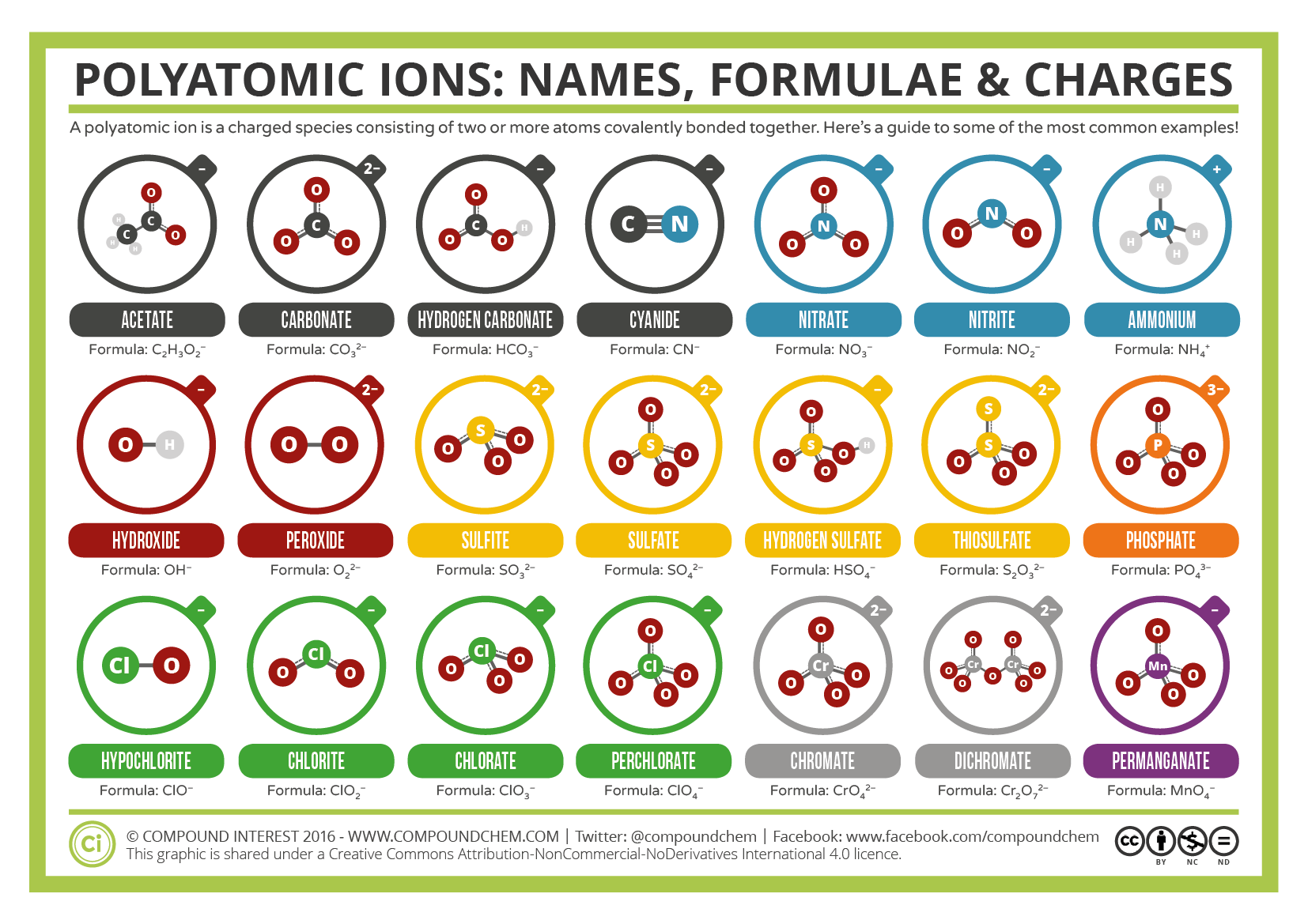
Tabelle \(\pageIndex{1}\): Einige mehratomige Ionen
Mehratomige Ionen haben Formeln, Namen und Ladungen definiert, die in keiner Weise geändert werden können. Tabelle \(\pageIndex{2}\) listet die Ionennamen und Ionenformeln der häufigsten mehratomigen Ionen auf. Zum Beispiel ist \(\ce{NO3^{-}}\) das Nitrationion; es hat ein Stickstoffatom und drei Sauerstoffatome und eine Gesamtladung von 1. Abbildung \(\pageIndex{2}\) listet die häufigsten mehratomigen Ionen auf.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Die verbleibenden mehratomigen Ionen sind alle negativ geladen und werden daher als Anionen klassifiziert. Allerdings werden nur zwei davon, das Hydroxidion und das Cyanidion, mit dem Suffix „-ide“ benannt, das typischerweise auf negativ geladene Teilchen hinweist. Die übrigen mehratomigen Anionen, die alle Sauerstoff enthalten, in Kombination mit einem anderen Nichtmetall, existieren als Teil einer Reihe, in der die Anzahl der Sauerstoffstoffe innerhalb der mehratomigen Einheit variieren kann. Wie in mehreren Abschnitten dieses Textes wiederholt betont wurde, sollten keine zwei chemischen Formeln einen gemeinsamen chemischen Namen haben. Ein einzelnes Suffix „-ide“ reicht nicht aus, um die Namen der Anionen in einer verwandten mehratomigen Reihe zu unterscheiden. Daher werden die Suffixe „-ate“ und „-ite“ verwendet, um anzuzeigen, dass die entsprechenden mehratomigen Ionen Teil einer Reihe sind. Zusätzlich geben diese Suffixe auch die relative Anzahl von Sauerstoffstoffen an, die in den mehratomigen Ionen enthalten sind. Beachten Sie, dass alle mehratomigen Ionen, deren Namen auf „-ate“ enden, einen Sauerstoff mehr enthalten als die mehratomigen Anionen, deren Namen auf „-ite“ enden.“ Leider geben diese Suffixe, ähnlich wie das übliche System zur Benennung von Übergangsmetallen, nur die relative Anzahl von Sauerstoffstoffen an, die in den mehratomigen Ionen enthalten sind. Zum Beispiel hat das Nitrat−Ion, das als NO3−1 symbolisiert wird, einen Sauerstoff mehr als das Nitrit-Ion, das als NO2-1 symbolisiert wird. Das Sulfationen wird jedoch als SO4-2 symbolisiert. Während sowohl das Nitrat-Ion als auch das Sulfat-Ion ein „-ate“ -Suffix teilen, enthält ersteres drei Sauerstoffstoffe, letzteres jedoch vier. Zusätzlich enthalten sowohl das Nitrationion als auch das Sulfition drei Sauerstoffstoffe, aber diese mehratomigen Ionen haben kein gemeinsames Suffix. Leider schreibt die relative Natur dieser Suffixe vor, dass die Ionenformel / Ionennamenkombinationen der mehratomigen Ionen einfach gespeichert werden müssen.
Die Regel für die Konstruktion von Formeln für ionische Verbindungen, die mehratomige Ionen enthalten, ist dieselbe wie für Formeln, die einatomige (einatomige) Ionen enthalten: Die positiven und negativen Ladungen müssen sich ausgleichen. Wenn mehr als eines eines bestimmten mehratomigen Ions benötigt wird, um die Ladung auszugleichen, muss die gesamte Formel für das mehratomige Ion in Klammern gesetzt werden, und der numerische Index wird außerhalb der Klammern platziert. Dies soll zeigen, dass der Index für das gesamte mehratomige Ion gilt. Zwei Beispiele sind unten gezeigt:

Beispiel \(\pageIndex{2}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Kalium− und das Sulfat-Ion
- das Calcium- und das Nitrat-Ion
Lösung
- Kaliumionen haben eine Ladung von 1+, während Sulfat-Ionen eine Ladung von 2- haben. Wir benötigen zwei Kaliumionen, um die Ladung des Sulfationen auszugleichen, daher lautet die richtige chemische Formel \(\ce {K_2SO_4} \).
- Calciumionen haben eine Ladung von 2+, während Nitrationen eine Ladung von 1− haben. Wir benötigen zwei Nitrationen, um die Ladung jedes Calciumions auszugleichen. Die Formel für Nitrat muss in Klammern stehen. Daher schreiben wir \(\ce{Ca(NO3)2}\) als Formel für diese ionische Verbindung.
Übung \(\pageIndex{2}\)
Schreiben Sie die chemische Formel für eine ionische Verbindung, die aus jedem Ionenpaar besteht.
- das Magnesium-Ion und das Carbonat-ion
- das Aluminium-Ion und das Acetat-Ion
Antwort a:
Mg2+ und CO32- = MgCO3
Antwort b:
Al3+ und C2H3O2- = Al(C2H3O2)3
onische Verbindungen
Es gibt zwei Möglichkeiten, ionische Verbindungen zu erkennen. Erstens sind Verbindungen zwischen Metall- und Nichtmetallelementen normalerweise ionisch. Beispielsweise enthält CaBr2 ein metallisches Element (Calcium, ein Metall der Gruppe 2A) und ein nichtmetallisches Element (Brom, ein Nichtmetall der Gruppe 7A). Daher ist es höchstwahrscheinlich eine ionische Verbindung. (In der Tat ist es ionisch.) Im Gegensatz dazu enthält die Verbindung NO2 zwei Elemente, die beide Nichtmetalle sind (Stickstoff aus der Gruppe 5A und Sauerstoff aus der Gruppe 6A). Es ist keine ionische Verbindung; Es gehört zur Kategorie der kovalenten Verbindungen, die anderswo diskutiert werden. Beachten Sie auch, dass diese Kombination von Stickstoff und Sauerstoff hat keine elektrische Ladung angegeben, so ist es nicht das Nitrit-Ion.Zweitens, wenn Sie die Formel eines mehratomigen Ions in einer Verbindung erkennen, ist die Verbindung ionisch. Wenn Sie beispielsweise die Formel \(\ce{Ba(NO3)2}\) sehen, können Sie den Teil „NO3“ als Nitrationion \(\rm{NO_3^ −}\) erkennen. (Denken Sie daran, dass die Konvention zum Schreiben von Formeln für ionische Verbindungen darin besteht, die ionische Ladung nicht einzuschließen.) Dies ist ein Hinweis darauf, dass der andere Teil der Formel, \(\ce{Ba}\), tatsächlich das \ (\ce{Ba ^ {2+}}\) Ion ist, wobei die 2 + Ladung die gesamte 2− Ladung der beiden Nitrationen ausgleicht. Somit ist diese Verbindung auch ionisch.
Beispiel \(\pageIndex{3}\)
Identifizieren Sie jede Verbindung als ionisch oder nicht ionisch.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
Lösung
- Natrium ist ein Metall und Sauerstoff ist ein Nichtmetall; Daher wird erwartet, dass \(\ce{Na2O}\) ionisch ist.
- Sowohl Phosphor als auch Chlor sind Nichtmetalle. Daher ist \(\ce{PCl3}\) nicht ionisch.
- Das \(\ce{NH4}\) in der Formel repräsentiert das Ammoniumion, \(\ce{NH4^{+}}\), was anzeigt, dass diese Verbindung ionisch ist.
- Sowohl Sauerstoff als auch Fluor sind Nichtmetalle. Daher ist \(\ce{OF2}\) nicht ionisch.
Übung \(\pageIndex{3}\)
Identifizieren Sie jede Verbindung als ionisch oder nicht ionisch.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Antwort a:
nicht ionisch
Antwort b:
ionisch
Antwort c:
ionisch
Antwort d:
nicht ionisch
Genauer hinsehen: Blut und Meerwasser
Die Wissenschaft hat seit langem erkannt, dass Blut und Meerwasser ähnliche Zusammensetzungen haben. Schließlich sind in beiden Flüssigkeiten ionische Verbindungen gelöst. Die Ähnlichkeit mag mehr als nur Zufall sein; Viele Wissenschaftler glauben, dass die ersten Lebensformen auf der Erde in den Ozeanen entstanden sind. Ein genauerer Blick zeigt jedoch, dass Blut und Meerwasser ganz unterschiedlich sind. Eine 0,9% ige Natriumchloridlösung entspricht in etwa der Salzkonzentration im Blut. Im Gegensatz dazu besteht Meerwasser hauptsächlich aus einer 3% igen Natriumchloridlösung, die mehr als dreimal so hoch ist wie die Konzentration im Blut. Hier ist ein Vergleich der Mengen an Ionen in Blut und Meerwasser:
| Ionen | Prozent in Meerwasser | Prozent im Blut |
|---|---|---|
| Na+ | 2,36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Dieser Unterschied ist signifikant, da das Hydrogencarbonat-Ion und einige verwandte Ionen eine entscheidende Rolle bei der Kontrolle der Säure-Base-Eigenschaften von Blut spielen. Die Menge an Hydrogenphosphationen – \(\ce{HPO4^{2-}}\) und \(\ce{H2PO4^{−}}\) — im Meerwasser ist sehr gering, aber sie sind in höheren Mengen im Blut vorhanden, wo sie auch die Säure-Base-Eigenschaften beeinflussen. Ein weiterer bemerkenswerter Unterschied besteht darin, dass Blut keine signifikanten Mengen des Sulfationen (\(\ce{SO4^{2−}}\)), aber dieses Ion ist im Meerwasser vorhanden.
Wichtige Erkenntnisse
- Richtige chemische Formeln für ionische Verbindungen gleichen die gesamte positive Ladung mit der gesamten negativen Ladung aus.
- Es gibt auch Gruppen von Atomen mit einer Gesamtladung, die als mehratomige Ionen bezeichnet werden.
-
Welche Informationen sind in der Formel einer ionischen Verbindung enthalten?
-
Warum enthalten die chemischen Formeln für einige ionische Verbindungen Indizes, während andere dies nicht tun?
Welche Informationen sind in der Formel einer ionischen Verbindung enthalten?
Warum enthalten die chemischen Formeln für einige ionische Verbindungen Indizes, während andere dies nicht tun?
3. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Mg2+ und I-
- Na+ und O2-
4. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Na+ und Br-
- Mg2+ und Br−
- Mg2+ und S2-
5. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- K+ und Cl-
- Mg2+ und Cl-
- Mg2+ und Se2−
6. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Na+ und N3-
- Mg2+ und N3-
- Al3+ und S2-
7. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Li+ und N3-
- Mg2+ und P3−
- Li+ und P3-
8. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Fe3+ und Br-
- Fe2+ und Br−
- Au3+ und S2−
- Au+ und S2-
9. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Cr3+ und O2-
- Cr2+ und O2−
- Pb2+ und Cl−
- Pb4+ und Cl−
10. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- Cr3+ und NO3-
- Fe2+ und PO43-
- Ca2+ und CrO42−
- Al3+ und OH-
11. Schreiben Sie die chemische Formel für die ionische Verbindung, die von jedem Ionenpaar gebildet wird.
- NH4+ und NO3-
- H+ und Cr2O72-
- Cu+ und CO32−
- Na+ und HCO3-
12. Bestimmen Sie für jedes Elementpaar die Ladung für ihre Ionen und schreiben Sie die richtige Formel für die resultierende ionische Verbindung zwischen ihnen.
- Ba und S
- Cs und I
13. Bestimmen Sie für jedes Elementpaar die Ladung für ihre Ionen und schreiben Sie die richtige Formel für die resultierende ionische Verbindung zwischen ihnen.
- K und S
- Sc und Br
14. Welche Verbindungen würden Sie als ionisch vorhersagen?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Welche Verbindungen würden Sie als ionisch vorhersagen?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
Antworten
1. das Verhältnis jeder Art von Ionen in der Verbindung
2. Manchmal wird mehr als ein Ion benötigt, um die Ladung des anderen Ions in einer ionischen Verbindung auszugleichen.
- mgi2
- Na2O
- NaBr
- mgbr2
- MGS
- KCl
- MgCl2
- MGSE
- na3n
- mg3n2
- al2s3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- Cr2O3
- Cro
- PbCl2
- PbCl4
- Cr(NO3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- BA2+, S2−, bas
- CS+, I−, CSI
- K+, S2−, k2s
- sc3+, br−, scbr3
- ionic
- ionic
- Not ionic
- Not ionic
- Not ionic
- li> Not ionic
- ionisch
nicht ionisch nicht ionisch - ionisch
nicht ionisch nicht ionisch
