13.5D: Biotin ist ein CO2-tragendes Coenzym
Erinnern Sie sich aus Abschnitt 6.5B daran, dass viele Enzyme auf die Unterstützung von Coenzymen angewiesen sind, bei denen es sich um kleine (relativ zu Protein) organische Moleküle handelt, die – kovalent im aktiven Zentrum eines Enzyms und helfen ihm, seine Reaktion zu katalysieren. S-Adenosylmethionin (SAM, Abschnitt 9.1A) und ATP (Abschnitt 10.2) sind zwei Beispiele, denen wir bisher begegnet sind, und wir werden in den kommenden Kapiteln noch einige weitere sehen. Obwohl Rubisco (in Teil B dieses Abschnitts beschrieben) eine Ausnahme darstellt, sind die meisten Enzyme, die Carboxylierungsreaktionen katalysieren, von einem Coenzym namens Biotin abhängig, das als temporärer Träger von Kohlendioxid dient.
Pyruvatcarboxylase, das Enzym, das den ersten Schritt des Gluconeogenese-Weges katalysiert, ist ein gutes Beispiel für eine biotinabhängige Carboxylierungsreaktion. Beachten Sie, dass das CO2 in dieser Reaktion aus Bicarbonat stammt, im Gegensatz zur Rubisco-Reaktion, bei der CO2 direkt aus der Atmosphäre ‚fixiert‘ wird.

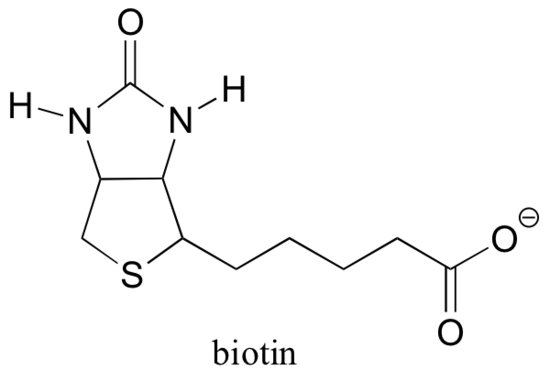
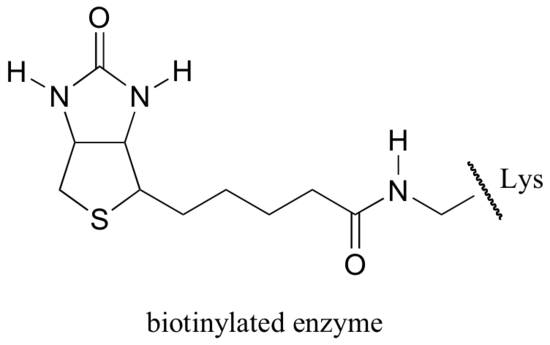
Biotin ist kovalent an das Enzym über eine Amidbindung an ein aktives Lysin gebunden.
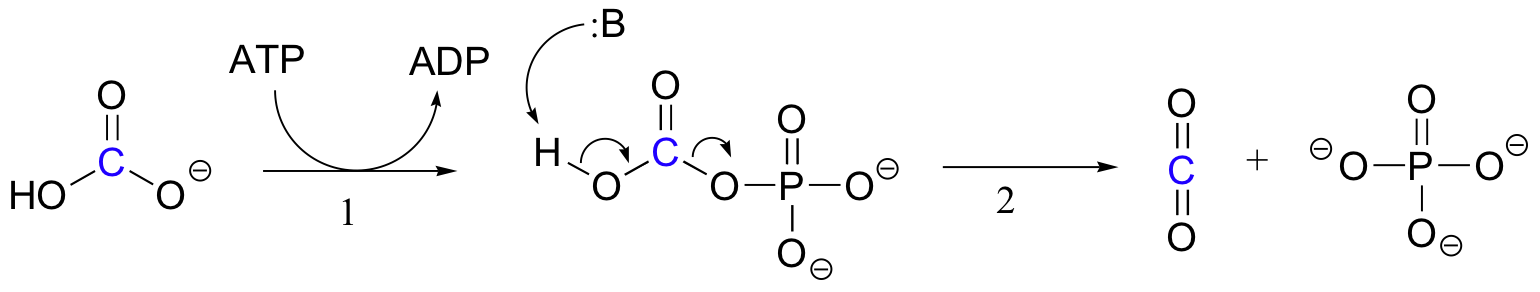
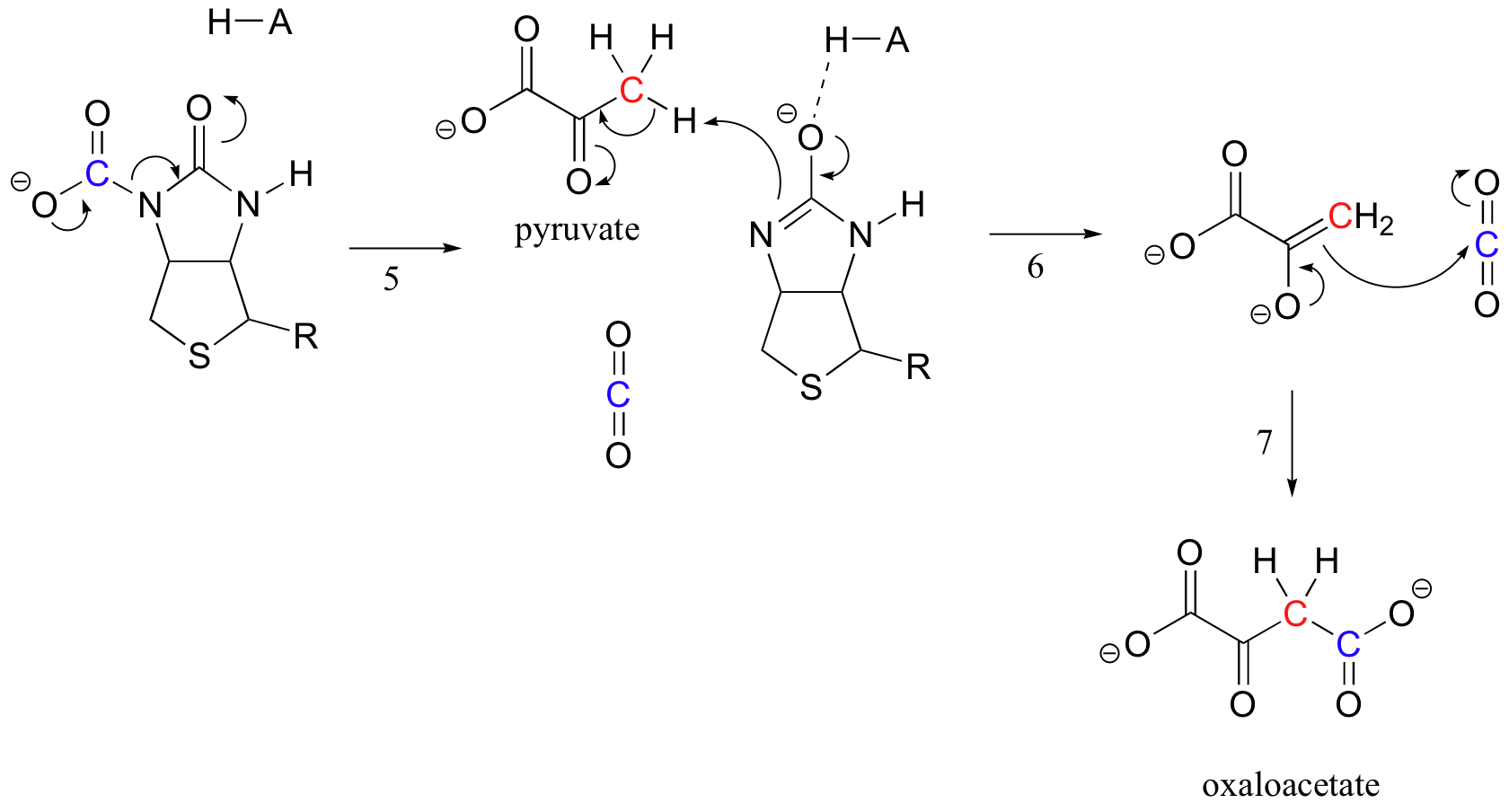
Der genaue Mechanismus, nach dem Biotin-abhängige Carboxylierungsreaktionen ablaufen, ist noch nicht vollständig verstanden, das Folgende ist jedoch ein wahrscheinliches Bild. Zunächst wird das Bicarbonat-Ion durch ATP phosphoryliert (Schritt 1, siehe Abschnitt 10.2) und somit zur Decarboxylierung aktiviert, die freies CO2 erzeugt (Schritt 2).
Die Aufgabe von Biotin besteht darin, das Kohlendioxidmolekül festzuhalten, bis Pyruvat in das aktive Zentrum gelangt. Die Carboxylierung von Biotin beinhaltet die Deprotonierung des Amidstickstoffs unter Bildung eines enolatartigen Zwischenprodukts (Schritt 3 – Amide haben eine pKa von ungefähr 17, und dies wird durch die Anwesenheit einer aktiven Ortssäure in der Nähe des Sauerstoffs verringert). Diesem Schritt folgt ein Angriff des nukleophilen Stickstoffs auf Kohlendioxid unter Bildung eines carboxybiotinylierten Enzyms (Schritt 4).
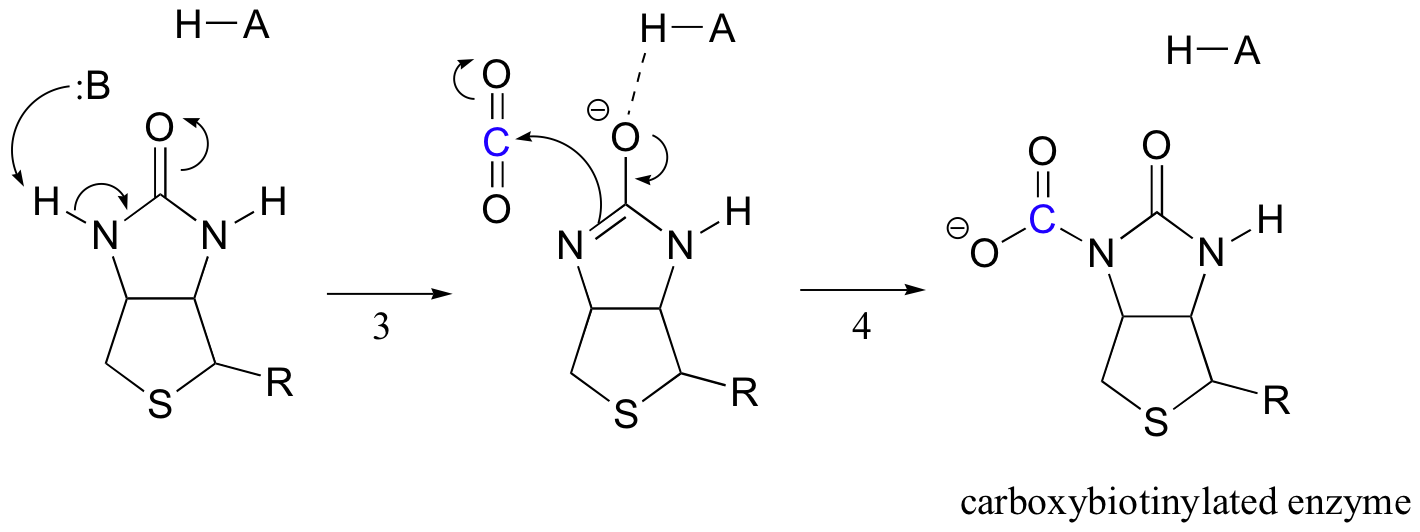
Wenn ein Pyruvatmolekül bindet, bewirkt die Umlagerung der Architektur des aktiven Zentrums, dass der vorherige Schritt umgekehrt wird (Schritt 5), wobei das CO2 freigesetzt und eine Biotinbase erzeugt wird, um den Alpha-Kohlenstoff von Pyruvat zu deprotonieren, so dass es aldolartig mit CO2 zu Oxalacetat kondensieren (Schritte 6-7).
Wenn Sie Biochemie studiert haben, haben Sie vielleicht von Biotin in einem etwas anderen Kontext gehört als in diesem Abschnitt. Ein Protein namens Avidin, das in Eiweiß reichlich vorhanden ist, bindet nicht kovalent und extrem fest an Biotin (tatsächlich ist Avidin-Biotin das engste Protein-Ligand-Bindungspaar, das der Wissenschaft bekannt ist). Biochemiker machen sich diese Eigenschaft oft zunutze, indem sie ein interessierendes Biomolekül kovalent mit Biotin verknüpfen. Die ‚biotinylierte‘ Spezies kann dann leicht aus einer komplexen Mischung isoliert werden, indem die Mischung durch eine ‚Affinitätssäule‘ geführt wird, die mit Avidin beschichtet ist.
