Es gibt eine Reihe von Möglichkeiten, wie sich eine Zelle von einem Punkt im Raum zu einem anderen bewegen kann. In einem flüssigen Medium kann diese Methode eine Art Schwimmen sein, bei dem Zilien- oder Flagellenbewegungen verwendet werden, um die Zelle anzutreiben. Auf festen Oberflächen funktionieren diese Mechanismen eindeutig nicht effizient und die Zelle durchläuft einen Kriechprozess. In diesem Abschnitt beginnen wir mit einer Diskussion der Ziliar- / Flagellenbewegung und betrachten dann die komplizierteren Anforderungen des Zellkriechens.Zilien und Flagellen, die sich hauptsächlich in der Länge und nicht in der Konstruktion unterscheiden, sind Organellen auf Mikrotubuli-Basis, die sich mit einer Hin- und Herbewegung bewegen. Dies bedeutet, dass die relativ kurzen Zilien „rudern“, aber bei den längeren Flagellen bewirkt die Flexibilität der Struktur, dass sich die Hin- und Herbewegung als Welle ausbreitet, sodass die Flagellenbewegung wellenförmiger oder peitschenartiger ist (überlegen Sie, was passiert, wenn Sie einen Gartenschlauch im Vergleich zu einem kurzen Stück desselben Schlauchs schnell von einer Seite zur anderen wedeln). Der Kern jeder Struktur wird Axonem genannt, das aus 9 Mikrotubuli-Dubletten besteht, die durch ziliäre Dynein-Motorproteine miteinander verbunden sind und einen zentralen Kern aus zwei separaten Mikrotubuli umgeben.
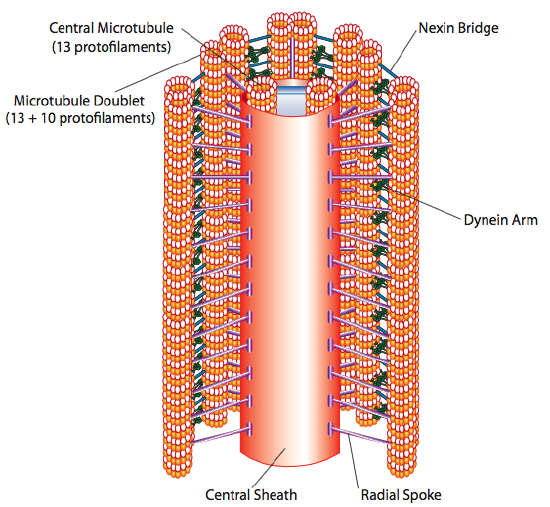
Dies ist als „9 +2“ -Formation bekannt, obwohl die neun Dubletten nicht mit den beiden zentralen Mikrotubuli identisch sind. Der A-Tubulus ist ein voller 13-Protofilamente, aber der damit verschmolzene B-Tubulus enthält nur 10 Protofilamente. Jedes der zentralen Mikrotubuli besteht aus vollen 13 Protofilamenten. Das 9 + 2 Axonem erstreckt sich über die Länge des Ziliums oder Flagellums von der Spitze bis zur Basis und verbindet sich mit dem Zellkörper durch einen Basalkörper, der aus 9 Mikrotubuli-Drillingen besteht, die in einem kurzen Fass angeordnet sind, ähnlich wie die Zentriolen, von denen sie abgeleitet sind.
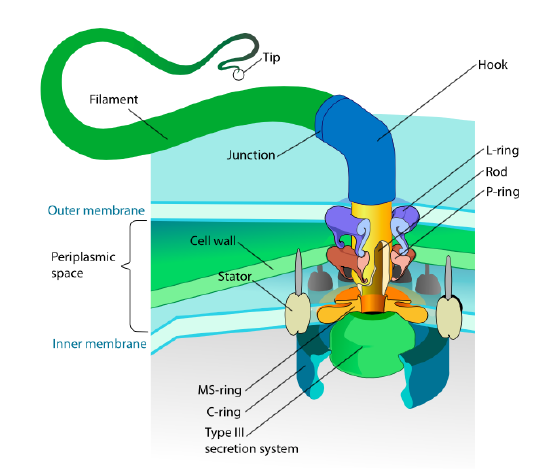
Dieser Abschnitt bezieht sich nur auf Eukaryoten. Einige Prokaryoten haben auch bewegliche Anhängsel, die Flagellen genannt werden, aber sie unterscheiden sich sowohl in der Struktur als auch im Mechanismus völlig. Die Flagellen selbst sind lange helikale Polymere des Proteinflagellins, und die Basis der Flagellinfasern ist mit einem Rotationsmotorprotein verbunden, nicht mit einem Translationsmotor. Dieser Motor (Abbildung \(\pageIndex {18}\)) verwendet Ionen (H + oder Na + je nach Spezies) in einem elektrochemischen Gradienten, um die Energie bereitzustellen, um bis zu 100000 Umdrehungen pro Minute zu drehen. Es wird angenommen, dass die Rotation durch Konformationsänderungen im Statorring angetrieben wird, eingebettet in die Zellmembran.
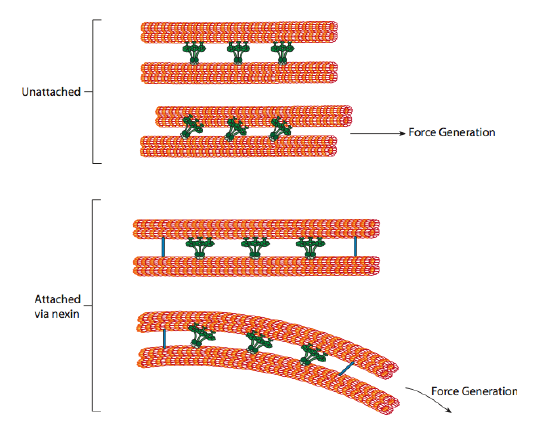
Die Ziliardyneine liefern die motorische Fähigkeit, aber es gibt auch zwei andere Bindungsproteine im Axonem. Es gibt Nexins, die den A-Tubulus eines Dubletts mit dem B-Tubulus seines benachbarten Dubletts verbinden und so den äußeren Ring verbinden. Und es gibt radiale Speichen, die sich vom A-Tubulus jedes Dubletts bis zum zentralen Paar Mikrotubuli im Kern des Axonems erstrecken. Keiner von ihnen hat eine motorische Aktivität. Sie sind jedoch entscheidend für die Bewegung von Zilien und Flagellen, da sie dazu beitragen, eine Gleitbewegung in eine Biegebewegung umzuwandeln. Wenn Ciliary Dynein (sehr ähnlich zu cytoplasmatischen Dyneinen, hat aber drei Köpfe statt zwei) engagiert ist, bindet es ein A-Mikrotubuli auf einer Seite, ein B-Mikrotubuli aus dem benachbarten Dublett und bewegt sich relativ zum anderen. Eine Linie dieser Dyneine, die sich im Konzert bewegt, würde also ein Dublett relativ zum anderen gleiten lassen, wenn (und es ist ein großes „wenn“) die beiden Dubletten völlige Bewegungsfreiheit hätten. Da die Dubletten jedoch durch die Nexin-Proteine miteinander verbunden sind, passiert es, wenn ein Dublett versucht zu gleiten, dass es stattdessen die verbundene Struktur biegt (Abbildung \(\pageIndex {17} \)). Diese Biegung erklärt die Ruderbewegung der Zilien, die relativ kurz sind, sowie die Schlagbewegung der langen Flagellen, die die Biegebewegung entlang des Axonems ausbreiten.
Obwohl wir Zilien- und Flagellenbewegungen als Methoden zum Antrieb einer Zelle betrachten, wie das flagellare Schwimmen von Spermien in Richtung einer Eizelle, gibt es auch eine Reihe wichtiger Stellen, an denen die Zelle stationär ist, und die Zilien werden verwendet, um Flüssigkeit an der Zelle vorbei zu bewegen. Tatsächlich gibt es Zellen mit Zilien in den meisten wichtigen Organen des Körpers. Es wurden mehrere Ziliardyskinesien berichtet, von denen die bekannteste, primäre Ziliardyskinesie (PCD), die das Kartagener-Syndrom (KS) einschließt, auf eine Mutation des DNAI1-Gens zurückzuführen ist, das für eine Untereinheit (Zwischenkette 1) des axonemalen (Ziliardyneins) kodiert. Die Diagnose von KS wird gestellt, wenn auch Situs inversus vorliegt, ein Zustand, bei dem die normale Links-Rechts-Asymmetrie des Körpers (z. B. Magen links, Leber rechts) umgekehrt ist. Das erste Symptom ist auf die Inaktivität der zahlreichen Zilien von Epithelzellen in der Lunge zurückzuführen. Ihre normale Funktion besteht darin, den Schleim in den Atemwegen ständig in Bewegung zu halten. Normalerweise hilft der Schleim, die Lunge feucht zu halten, um die Funktion zu erleichtern, aber wenn der Schleim stationär wird, wird er zu einem Nährboden für Bakterien und wird zu einem Reizstoff und Hindernis für den richtigen Gasaustausch.
Situs inversus ist eine interessante Fehlbildung, da sie in der Embryonalentwicklung auftritt und nur 50% der PCD-Patienten betrifft, da die beeinträchtigte Ziliarfunktion eine Randomisierung der Links-Rechts-Asymmetrie und keine Umkehrung verursacht. In sehr einfachen Worten, während der frühen Embryonalentwicklung ist die Links-Rechts-Asymmetrie teilweise auf die Bewegung molekularer Signale in einem nach links gerichteten Fluss durch den embryonalen Knoten zurückzuführen. Wenn sie also nicht funktionieren, wird der Fluss gestört und es kommt zu einer Randomisierung.
Andere Symptome von PCD-Patienten weisen auch auf die Arbeit von Zilien und Flagellen im Körper hin. Männliche Unfruchtbarkeit ist häufig auf unbewegliche Spermien zurückzuführen. Weibliche Unfruchtbarkeit, obwohl weniger häufig, kann auch auftreten, aufgrund einer Funktionsstörung der Zilien des Eileiters und des Eileiters, die normalerweise das Ei vom Eierstock zur Gebärmutter bewegen. Interessanterweise gibt es auch eine geringe Assoziation von Hydrocephalus internus (Überfüllung der Ventrikel des Gehirns mit Zerebrospinalflüssigkeit, was zu ihrer Vergrößerung führt, die das Hirngewebe um sie herum komprimiert) mit PCD. Dies ist wahrscheinlich auf eine Funktionsstörung der Zilien in den Ependymzellen zurückzuführen, die die Ventrikel auskleiden und die Zirkulation des Liquors unterstützen, aber anscheinend nicht vollständig notwendig sind. Da angenommen wird, dass der Liquor-Massenstrom hauptsächlich von der Systolen- / Diastolen-Änderung des Blutdrucks im Gehirn angetrieben wird, nehmen einige an, dass die Zilien hauptsächlich am Fluss durch einige der engeren Kanäle im Gehirn beteiligt sein können.
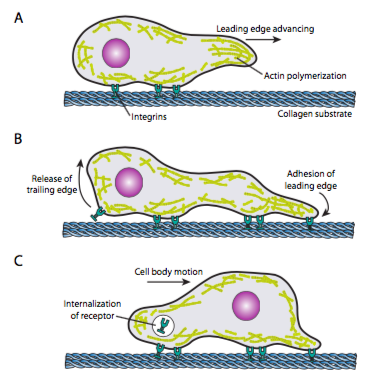
Das Crawlen von Zellen (Abbildung \(\pageIndex{19}\)) erfordert die koordinierte Umlagerung des Vorderkanten-Mikrofilamentnetzwerks, das sich (sowohl durch Polymerisation als auch durch Gleiten) erstreckt Filamente) und dann Adhäsionen am neuen vordersten Punkt bilden. Dies kann die Form von Filopodien oder Lamellipodien annehmen,und oft beides gleichzeitig. Filopodien sind lange und sehr dünne Projektionen mit Kernbündeln paralleler Mikrofilamente und hohen Konzentrationen von Zelloberflächenrezeptoren. Ihr Zweck ist in erster Linie, die Umwelt zu spüren. Lamellipodien erstrecken sich oft zwischen zwei Lopodien und sind eher eine breite Rüsche als ein Finger. Intern bildet sich das Aktin mehr zu Maschen als zu Bündeln, und die breitere Kante ermöglicht mehr Adhäsionen an das Substrat. Das Mikrofilamentnetzwerk ordnet sich dann wieder neu an und öffnet diesmal einen Raum im Zytoplasma, der als Kanal für die Bewegung der Mikrotubuli zur Vorderseite der Zelle dient. Dadurch wird das Transportnetzwerk eingerichtet, um intrazelluläres Schüttgut vorwärts zu bewegen. In diesem Fall werden die alten Adhäsionen am Schwanzende der Zelle freigesetzt. Diese Freisetzung kann durch zwei primäre Mechanismen erfolgen: Endozytose des Rezeptors oder Deaktivierung des Rezeptors durch Signal- / Konformationsänderung. Diese zu starke Vereinfachung widerlegt natürlich die Komplexität bei der Koordination und Steuerung all dieser Aktionen, um eine gerichtete Bewegung einer Zelle zu erreichen.
Ein Modell der Mikrofilamentkrafterzeugung, das elastische Brownsche Ratschenmodell (Mogilner und Oster, 1996), schlägt vor, dass aufgrund der Brownschen Bewegung der Zellmembran, die aus kontinuierlichen winzigen thermischen Schwankungen resultiert, die Aktinfilamente, die sich zu den Rändern der Membran herausdrücken, unterschiedlich stark gebogen werden. Wenn der Flex groß genug ist, kann ein neues Aktinmonomer zwischen die Membran und die Spitze des Filaments passen, und wenn sich das jetzt längere Filament zurückbeugt, kann es einen größeren Druck auf die Membran ausüben. Offensichtlich erzeugt ein einzelnes Filament nicht viel Kraft, aber die koordinierte Ausdehnung vieler Filamente kann die Membran nach vorne drücken.
Sobald eine Zelle ein Signal zur Bewegung erhält, besteht die anfängliche Reaktion des Zytoskeletts darin, Aktin zu polymerisieren und mehr Mikrofilamente zu bilden, die in die Vorderkante eingebaut werden können. Abhängig von dem Signal (attraktiv oder abstoßend) kann die Polymerisation auf der gleichen oder gegenüberliegenden Seite der Zelle vom Punkt der Signalrezeptoraktivierung auftreten. Bezeichnenderweise kann die Polymerisation von neuem f-Aktin allein eine ausreichende Kraft erzeugen, um die Membran auch ohne Beteiligung von Myosin-Motoren vorwärts zu bewegen! Modelle der Krafterzeugung werden diskutiert, beginnen aber im Allgemeinen mit dem Einbau von neuem g-Aktin in ein Filament an seiner Spitze; das heißt, an der Filament-Membran-Schnittstelle. Auch wenn das technisch ausreichen könnte, sind in einer lebenden Zelle Myosins beteiligt und helfen, Filamente direktional zu schieben und anzuordnen, um die neue Vorderkante aufzubauen. Darüber hinaus müssen einige Filamente und Netzwerke schnell durchtrennt und neue Verbindungen hergestellt werden, sowohl zwischen Filamenten als auch zwischen Filamenten und anderen Proteinen wie Adhäsionsmolekülen oder Mikrotubuli.
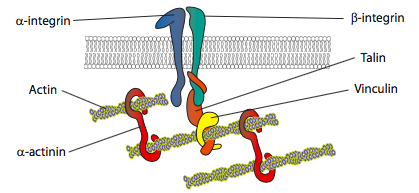
Wie wird die Polymerisation und Aktinumlagerung gesteuert? Die Rezeptoren, die die Zellfortbewegung signalisieren, können etwas unterschiedliche Wege einleiten, aber viele haben einige Gemeinsamkeiten bei der Aktivierung eines oder mehrerer Mitglieder der Ras-Familie kleiner GTPasen. Diese Signalmoleküle wie Rac, Rho und cdc42 können durch Rezeptor-Tyrosinkinasen aktiviert werden (siehe RTK-Ras activation pathways, Kap. 14). Jeder von ihnen hat eine etwas andere Rolle in der Zellmotilität: die cdc42-Aktivierung führt zur Filopodienbildung, Rac aktiviert einen Weg, der Arp2 / 3 und Cofilin zur Lamellipodienbildung umfasst, und Rho aktiviert Myosin II, um die fokale Adhäsion und die Spannungsfaserbildung zu kontrollieren. Eine andere Art von Rezeptorkaskade, die G-Protein-Signalkaskade (auch Kapitel 14), kann zur Aktivierung von PLC und anschließender Spaltung von PIP2 und Erhöhung des cytosolischen Ca2 + führen. Diese Veränderungen können, wie bereits erwähnt, auch Myosin II sowie die Remodeling-Enzyme Gelsolin, Cofilin und Profilin aktivieren. Dadurch werden vorhandene Aktinstrukturen abgebaut, um die Zelle flüssiger zu machen, und gleichzeitig mehr g-Aktin zur Bildung des neuen Vorderkanten-Zytoskeletts beigetragen.In-vitro-Experimente zeigen, dass beim Vorwärtsschieben der Membran neue adhäsive Kontakte durch Adhäsionsmoleküle oder Rezeptoren hergestellt werden, die das Substrat binden (häufig sind Zellkulturträger oder -schalen mit Kollagen, Filaminin oder anderen extrazellulären Matrixproteinen beschichtet). Die Kontakte rekrutieren dann Zytoskelettelemente für eine größere Stabilität, um eine fokale Adhäsion zu bilden (Abbildung \(\pageIndex {20}\)). Die Bildung fokaler Adhäsionen scheint jedoch ein Artefakt der Zellkultur zu sein, und es ist unklar, ob die Arten von Adhäsionen, die sich in vivo bilden, dieselben Arten von Zytoskelettkomponenten rekrutieren.
Der dritte Schritt zur Zellfortbewegung ist die Massenbewegung des zellulären Inhalts vorwärts. Die Mechanismen für diese Phase sind unklar, aber es gibt einige Hinweise darauf, dass unter Verwendung von Verknüpfungen zwischen dem Aktin-Zytoskelett an der Vorderkante und den vorderen Teilen des Mikrotubulus-Zytoskeletts die Mikrotubuli neu angeordnet werden, um einen effizienten Transportweg für die Massenbewegung zu bilden. Ein weiterer Aspekt kann ein „Corralling“ -Effekt durch die Aktinnetzwerke sein, die den Raum zur Vorderkante hin gerichtet öffnen. Die Mikrotubuli treten dann leichter in diesen Raum ein, als durch ein enges Aktinnetz zu arbeiten, wodurch der Fluss in die richtige Richtung erzwungen wird.
Ein Großteil der Arbeiten zu Mikrotubuli-Aktin-Wechselwirkungen in der Zellmotilität wurde durch Forschung am neuronalen Wachstumskegel durchgeführt, der manchmal als Zelle an der Leine bezeichnet wird, da er fast unabhängig wie eine kriechende Zelle wirkt und nach dem richtigen Weg sucht, um sein Axon vom Zellkörper zu seiner richtigen synaptischen Verbindung zu führen (A.W. Schaefer et al, Dev. Zelle 15: 146-62, 2008).
Schließlich muss die Zelle ihre alten Verwachsungen an der Hinterkante lösen. Dies kann auf verschiedene Arten geschehen. In vitro wurde beobachtet, dass sich kriechende Zellen vom Substrat abreißen und dabei winzige Membranstücke und zugehörige Adhäsionsproteine zurücklassen. Es wird angenommen, dass die erzeugte Kraft von Aktin-Myosin-Stressfasern herrührt, die von den vorwärtsgerichteten fokalen Adhäsionen ausgehen. Den Zellen stehen jedoch weniger destruktive Mechanismen zur Verfügung. In einigen Fällen kann die Adhäsivität des zellulären Rezeptors für das extrazelluläre Substrat intern reguliert werden, möglicherweise durch Phosphorylierung oder Dephosphorylierung eines Rezeptors. Eine andere Möglichkeit ist die Endozytose des Rezeptors, die ihn von der Zelloberfläche entfernt. Es könnte einfach bis zur Vorderkante recyceln, wo es benötigt wird (dh Transzytose), oder wenn es nicht mehr benötigt oder beschädigt wird, kann es in einem Lysosom abgebaut werden.
