Kort beskrivning av två typer av programmerad celldöd: apoptos och autofagi
apoptos, eller typ i programmerad celldöd, är den mest studerade av formerna av celldöd. Dess morfologiska egenskaper kan identifieras under ljusmikroskopi och innefattar cellkrympning, komprimering av kromatinet, blebbing av det cytoplasmatiska membranet och slutligen bildandet av apoptotiska kroppar (Figur 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
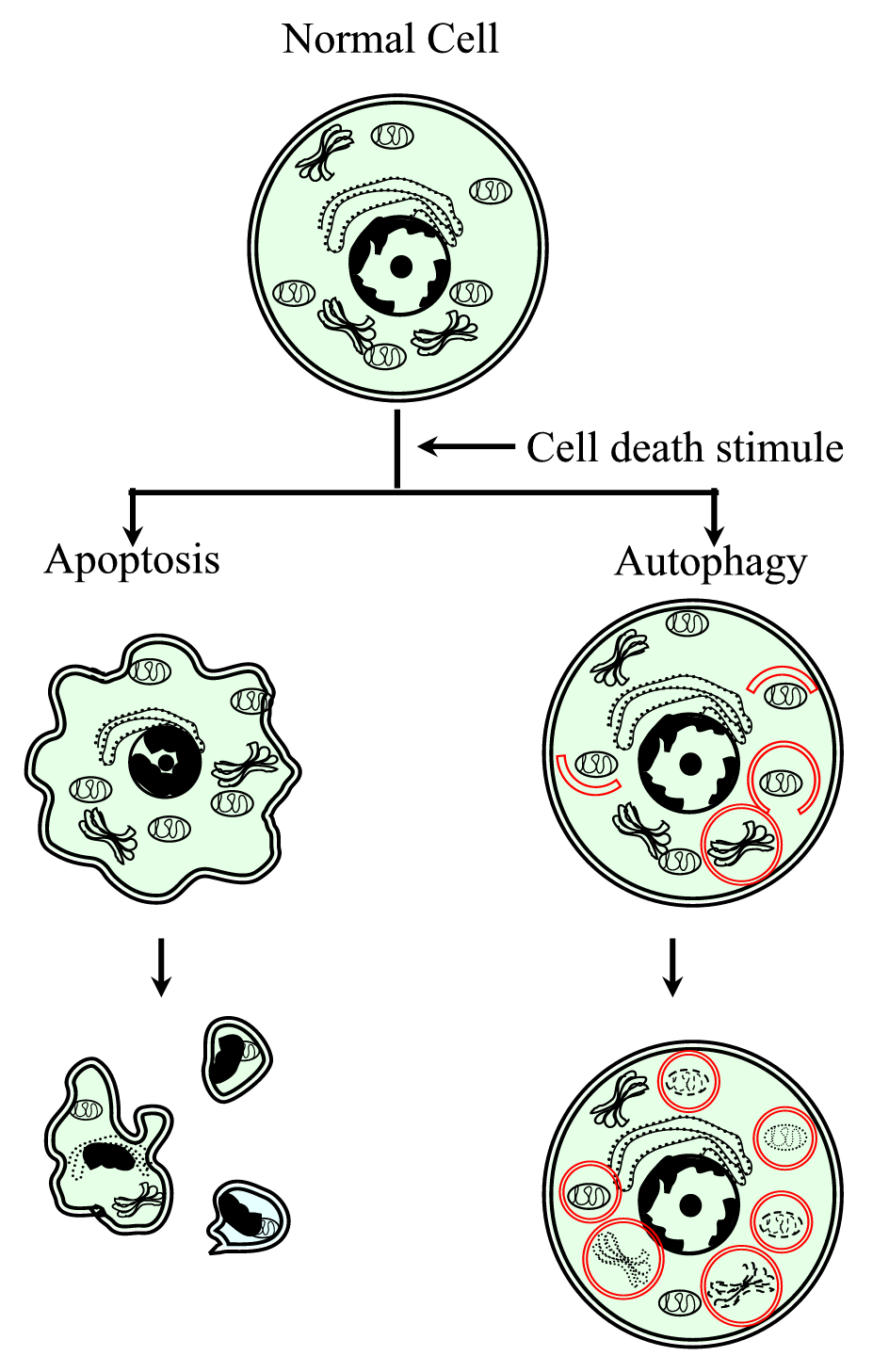
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi= ”http://www.w3.org/2001/XMLSchema-instanceSchematisk representation av den programmerade celldödsprocessen typ i (apoptos) och typ II (autofagi). Apoptos kännetecknas av en cellulär sammandragning, kromatinkomprimering, membranösa blebs och bildandet av apoptotiska kroppar. Autofagi kännetecknas av närvaron av ett stort antal autofagosomer med cytoplasmiskt innehåll. Båda typerna av celldöd genererar inte ett inflammatoriskt svar eftersom det cytoplasmatiska membranet konserveras tills det cellulära skräpet elimineras av grannskapet eller av specialiserade.
caspaser är cysteinyl-aspartatspecifika proteaser som syntetiseras i en inaktiv form som zymogener som kallas pro-caspaser (Figur 2). Det är denna inaktiva form som tillåter det kontrollerade utförandet av celldödsprocessen. Caspaser identifierades först i nematoden Ceanorhabditis elegans, men homologa former finns i däggdjur .
kännetecknen för apoptos, såsom DNA-fragmentering och komprimerat kromatin, är resultatet av caspasaktivitet. Under apoptos fragmenteras DNA i nukleosomstorlek (200 bp) . Den faktor som är ansvarig för DNA-fragmentering under apoptos är ett specifikt DNas (CAD, caspase-activated DNase) som aktiveras av aktivt caspase-3 . Aktiv caspase-3 är i sin tur involverad i morfologiska cellförändringar under apoptos, där den klyver rho-associerat Kinas-1 (ROCK-1) för att aktivera det och detta påverkar slutligen det cytoskeletala arrangemanget som orsakar apoptotisk krympningsmorfologi .

Figur 2.
xmlns: xlink=”http://www.w3.org/1999/xlink ” xmlns:mml= ” http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceKaspaser som är involverade i den apoptotiska processen syntetiseras i en inaktiv form som zymogener, utgörs av en pro-domän, en stor underenhet och en liten underenhet. Zymogenerna aktiveras och bildar tetramerer.
Apoptotisk celldöd regleras starkt av medlemmar i B-celllymfom 2 (Bcl-2) – Familjen . Bcl – 2-familjemedlemmar har klassificerats som anti-apoptotiska och pro-apoptotiska proteiner enligt deras Bcl-2-homologi (BH) och domänorganisation (Figur 3). Närvaron av domäner BH1, BH2, BH3 och BH4 motsvarar gruppen som hämmar apoptos. Den pro-apoptotiska gruppen är däremot uppdelad i två grupper: de med domäner BH1, BH2 och BH3, och de med endast BH3-domänerna (definieras endast som BH3; se recensionen i ). Denna familj av proteiner utför sina funktioner på intracellulär nivå inuti mitokondrier, ett nyckelelement i apoptos.

Figur 3.
xmlns: xlink=”http://www.w3.org/1999/xlink ”xmlns: mml=” http://www.w3.org/1998/Math/MathML ” xmlns:xsi= ”http://www.w3.org/2001/XMLSchema-instanceB-celllymfom 2 (Bcl-2) familjeproteiner. A) allmän schematisering av strukturen av BCL-2-proteiner. B) de anti-apoptotiska medlemmarna – de har alla fyra BH-domänerna. C) de pro-apoptotiska medlemmarna som i sin tur är indelade i två grupper: endast multidomän och BH3.
apoptos kan initieras av två väl beskrivna vägar: de yttre och inre vägarna (Figur 4). Extrinsisk aktivering utförs genom deltagande av dödligander (såsom tumörnekrosfaktor – TNF – superfamilj, och TNF-relaterade apoptosinducerade ligander, eller TRAIL) med deras kognatcellytadödsreceptorer (såsom TNF-receptor 1, Fas, SPÅRRECEPTOR 1 eller SPÅRRECEPTOR 2) (granskad i ). När liganden känner igen och binds till dess receptor bildas en serie intracellulära komplex för att aktivera initiatorkaspaserna (såsom -8 och -10), som sedan aktiverar bödelkaspaserna (såsom -3, -6 och -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Ligandreceptorinteraktionen inducerar sammansättningen av det dödsinducerande signalkomplexet (DISC) för att främja aktiveringen av caspase-8, som i sin tur kan aktivera till exekutören caspase -3, -6 eller -7, som leder till de morfologiska förändringarna av apoptosen. Den inneboende vägen styrs av mitokondriell yttre membranpermeabilisering, vilket möjliggör frisättning av pro-apoptotiska element som cytokrom-C. cytokrom-C inducerar apoptosproteasaktiverande faktor 1 (Apaf-1) för att främja aktiveringen av caspase-9 för att montera apoptosomen. Apoptosomen kan aktiveras till exekutörens caspaser.
den inneboende apoptotiska vägen kan däremot aktiveras av olika stimuli, inklusive DNA-skada, tillväxtfaktorsvält och oxidativ stress . Under exponering av celler för dessa stimuli påverkas mitokondrierna, eftersom flera medlemmar av BCL-2-Familjen aktiveras och främjar mitokondrier yttre membranpermeabilisering (MOMP). Det genomträngda yttre mitokondriemembranet möjliggör frisättning av cytokrom c (cyt c), vilket är associerat med apaf-1-proteinet. CYT c och apaf-1-unionen binds sedan till initiatorn caspase-9 för att bilda komplexet som utgör apoptosomen, som har förmågan att aktivera initiatorkaspaserna som utför sina funktioner genom att klyva specifika cellulära substrat.
den andra processen för celldöd, autofagi, är en genetiskt programmerad och evolutionärt konserverad process som producerar nedbrytning av föråldrade organeller och proteiner. Det aktiveras av sådana extracellulära stimuli som näringssvält, hypoxi, hög temperatur och förändrade intracellulära tillstånd, inklusive ackumulering av skadade eller överflödiga organeller (granskad i ).
i eukaryota organismer har tre typer av autofagi beskrivits: mikroautofagi, makroautofagi (vanligtvis kallad helt enkelt autofagi) och chaperonmedierad autofagi (Figur 5). Mikroautofagi involverar uppslukning av cytoplasmatiska komponenter direkt vid lysosomens nivå med hjälp av en invaginationsprocess, medan makroautofagi medför bildandet av dubbelmembranblåsor som innehåller cellulära komponenter, som smälter samman med lysosomer för att bilda en autofagolysosom. Det är inuti autofagolysosomen att de intra-vesikulära komponenterna bryts ned och om möjligt återvinns av cellen (granskad i ). Chaperonmedierad autofagi medför slutligen deltagande av chaperoner vid erkännande av proteinerna som är avsedda för eliminering av lysosomerna .

Figur 5.
xmlns: xlink=”http://www.w3.org/1999/xlink”xmlns:mml=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceschematiska representationer av de olika mekanismerna för autofagi. Makroautofagi – autofagi-innebär bildandet av en dubbelmembranvesikel, som uppslukar cytoplasmiskt innehåll som kommer att ledas till lysosomen som ska brytas ned. Mikroautofagi kännetecknas av direkt uppslukning av cytoplasmatiska komponenter av lysosomen. Denna process innefattar ombyggnad av organellens membran genom att bilda en lysosomal membraninvagination. Under chaperone-medierad autophagy riktas proteinerna som ska brytas ned för en Hsp70, som i sin tur transporterar målbelastningen till lysosomen.
autofagi styrs av Atg(Autofagirelaterade) gener, som krävs för att aktivera signalkomplexet som utlöser bildandet av autofagosomer . Atggener upptäcktes i jäst, men många har ortologer i högre eukaryoter (Figur 6). Autofagosombildning medför deltagande av det cytoplasmatiska proteinet LC3 (Atg8), som genomgår lipidering av fosfatidyletanolamin och rekryteras sedan till det framväxande autofagosommembranet (Figur 7). Ackumulering av lipiderat LC3-protein (känt som LC3-II) används som en markör för autofagi .

Figur 6.
xmlns: xlink=”http://www.w3.org/1999/xlink ”xmlns: mml=” http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. LC3-proteinet lipideras av fosfatidyletanolamin.
autofag celldöd, eller typ II programmerad celldöd, kännetecknas av en massiv uppslukning av cytoplasman av autofagiska vesiklar. Denna intensiva autofagiska aktivitet skiljer sig väsentligt från autofagi som uppträder kontinuerligt vid basala nivåer. Ultrastrukturella studier i Drosophila har avslöjat ackumulering av autofagiska vakuoler i de flesta larvvävnader. Denna typ av programmerad celldöd börjar med nedbrytningen av cytoplasmatiska organeller genom autofagi, även om de cytoskeletala elementen bevaras fram till de sena stadierna av processen (granskad i ).
