inlärningsmål
- beskriv den grundläggande strukturen för en aminosyra
- Beskriv de kemiska strukturerna för proteiner
- sammanfatta de unika egenskaperna hos proteiner
i början av detta kapitel beskrivs ett känt experiment där forskare syntetiserade aminosyror under förhållanden som simulerade de som finns på jorden långt före livets utveckling som vi känner till det. Dessa föreningar är kapabla att binda samman i väsentligen vilket antal som helst, vilket ger molekyler av väsentligen vilken storlek som helst som har ett brett spektrum av fysikaliska och kemiska egenskaper och utför många funktioner som är viktiga för alla organismer. Molekylerna härledda från aminosyror kan fungera som strukturella komponenter i celler och subcellulära enheter, som källor till näringsämnen, som atom – och energilagringsreservoarer och som funktionella arter som hormoner, enzymer, receptorer och transportmolekyler.
aminosyror och peptidbindningar

Figur 1.
en aminosyra är en organisk molekyl i vilken en väteatom, en karboxylgrupp (–COOH) och en aminogrupp (–NH2) alla är bundna till samma kolatom, det så kallade askorbikolet. Den fjärde gruppen som är bunden till Kubi-kolet varierar mellan de olika aminosyrorna och kallas en rest eller en sidokedja, representerad i strukturformler med bokstaven R. en Rest är en monomer som resulterar när två eller flera aminosyror kombinerar och tar bort vattenmolekyler. Den primära strukturen hos ett protein, en peptidkedja, är gjord av aminosyrarester. De unika egenskaperna hos de funktionella grupperna och R-grupperna tillåter dessa komponenter i aminosyrorna att bilda väte -, joniska och disulfidbindningar, tillsammans med polära/icke-polära interaktioner som behövs för att bilda sekundära, tertiära och kvartära proteinstrukturer. Dessa grupper består främst av kol, väte, syre, kväve och svavel, i form av kolväten, syror, amider, alkoholer och aminer. Några exempel som illustrerar dessa möjligheter finns i Figur 1.
aminosyror kan kemiskt bindas samman genom reaktion av karboxylsyragruppen i en molekyl med amingruppen i en annan. Denna reaktion bildar en peptidbindning och en vattenmolekyl och är ett annat exempel på uttorkningssyntes (Figur 2). Molekyler som bildas genom att kemiskt länka relativt blygsamma antal aminosyror (cirka 50 eller färre) kallas peptider, och prefix används ofta för att specificera dessa siffror: dipeptider (två aminosyror), tripeptider (tre aminosyror) och så vidare. Mer allmänt betecknas det ungefärliga antalet aminosyror: oligopeptider bildas genom att sammanfoga upp till cirka 20 aminosyror, medan polypeptider syntetiseras från upp till cirka 50 aminosyror. När antalet aminosyror kopplade ihop blir mycket stort, eller när flera polypeptider används som byggnadsunderenheter, kallas makromolekylerna som resulterar proteiner. Den kontinuerligt variabla längden (antalet monomerer) av dessa biopolymerer, tillsammans med variationen av möjliga R-grupper på varje aminosyra, möjliggör en nästan obegränsad mångfald i de typer av proteiner som kan bildas.

Figur 2. Peptidbindningsbildning är en dehydreringssyntesreaktion. Karboxylgruppen för den första aminosyran (alanin) är kopplad till aminogruppen för den inkommande andra aminosyran (alanin). I processen frigörs en molekyl vatten.
Tänk på det
- hur många aminosyror finns i polypeptider?
proteinstruktur
storleken (längden) och den specifika aminosyrasekvensen för ett protein är viktiga determinanter för dess form, och formen på ett protein är avgörande för dess funktion. Till exempel, i processen med biologisk kvävefixering (se biogeokemiska cykler), jordmikroorganismer som kollektivt kallas rhizobia symbiotiskt interagerar med rötter av baljväxter som sojabönor, jordnötter eller bönor för att bilda en ny struktur som kallas en nodul på växtrötterna. Växten producerar sedan ett bärarprotein som kallas leghemoglobin, ett protein som bär kväve eller syre. Leghemoglobin binder med en mycket hög affinitet till dess substratsyre vid en specifik region av proteinet där formen och aminosyrasekvensen är lämpliga (det aktiva stället). Om formen eller den kemiska miljön på den aktiva platsen förändras, till och med något, kanske substratet inte kan binda lika starkt, eller det kanske inte binder alls. För att proteinet ska vara fullt aktivt måste det således ha lämplig form för sin funktion.
proteinstruktur kategoriseras i termer av fyra nivåer: primär, sekundär, tertiär och kvartär. Den primära strukturen är helt enkelt sekvensen av aminosyror som utgör polypeptidkedjan. Figur 3 visar den primära strukturen hos ett protein.
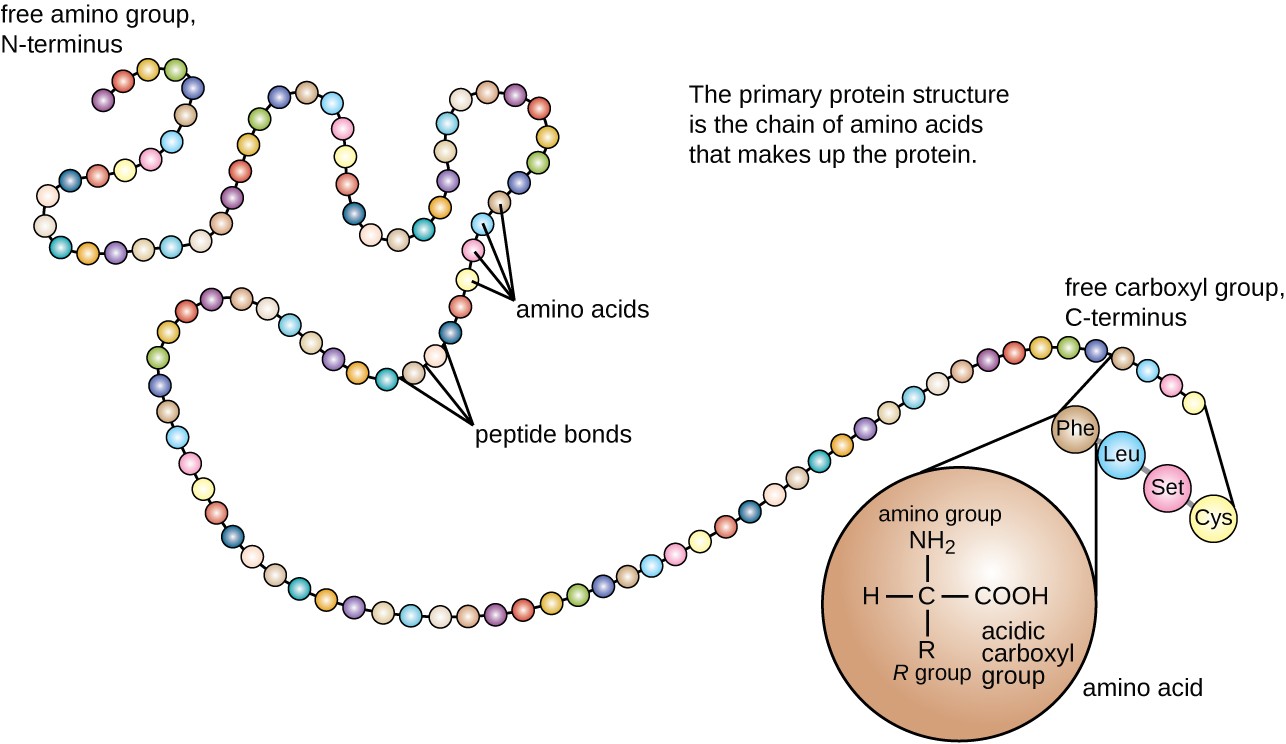
Figur 3. Klicka för att se en större bild. Den primära strukturen hos ett protein är sekvensen av aminosyror. (kredit: modifiering av arbete av National Human Genome Research Institute)
kedjan av aminosyror som definierar ett protein primära struktur är inte stel, men i stället är flexibel på grund av arten av de bindningar som håller aminosyrorna tillsammans. När kedjan är tillräckligt lång kan vätebindning inträffa mellan Amin-och karbonylfunktionella grupper inom peptidryggraden (exklusive R-sidogruppen), vilket resulterar i lokal vikning av polypeptidkedjan i spiraler och ark. Dessa former utgör ett protein sekundära struktur. De vanligaste sekundära strukturerna är en helix och en veckad plåt. I strukturen av den s. k. spiralen hålls spiralen av vätebindningar mellan syreatomen i en karbonylgrupp av en aminosyra och väteatomen i aminogruppen som bara är fyra aminosyraenheter längre längs kedjan. I det veckade arket bildas vecken av liknande vätebindningar mellan kontinuerliga sekvenser av karbonyl-och aminogrupper som separeras ytterligare på ryggraden i polypeptidkedjan (Figur 4).

Figur 4. Den sekundära strukturen hos ett protein kan vara en bisexuell-helix eller ett Bisexuellt pläterat ark, eller båda.
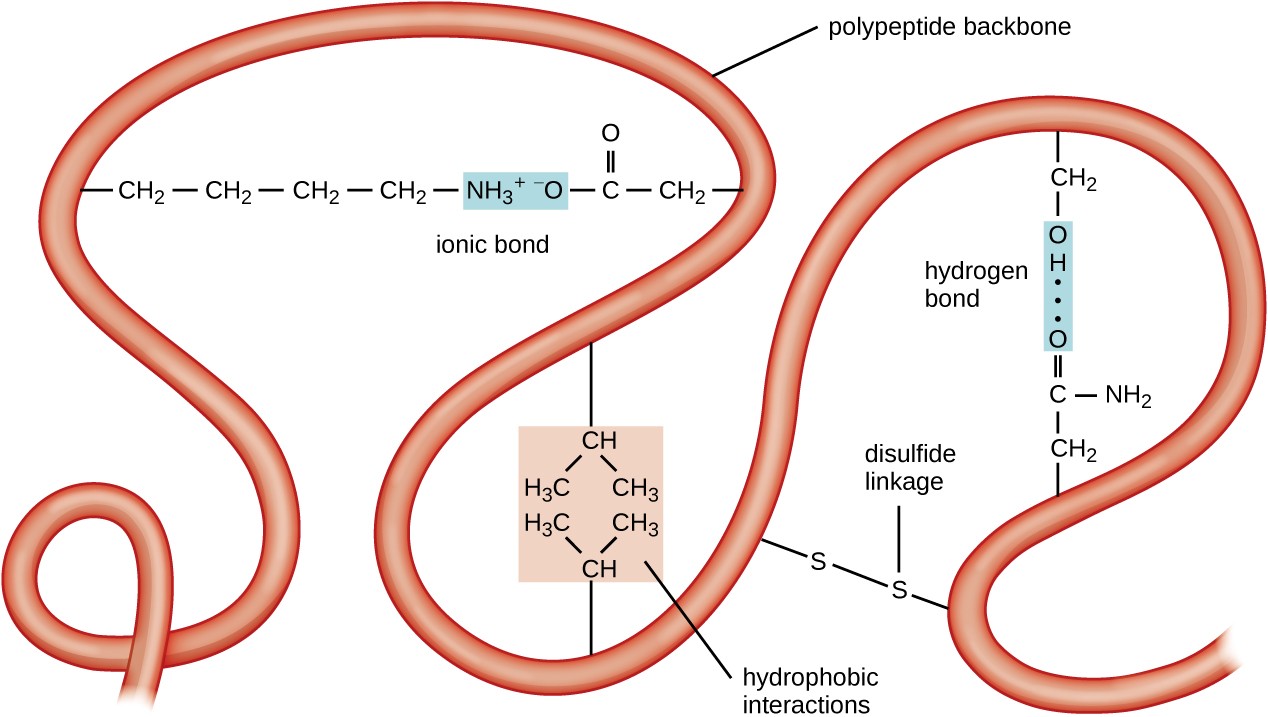
Figur 5. Klicka för att se större bild. Den tertiära strukturen av proteiner bestäms av en mängd attraktiva krafter, inklusive hydrofoba interaktioner, jonbindning, vätebindning och disulfidbindningar.
nästa nivå av proteinorganisation är den tertiära strukturen, som är den storskaliga tredimensionella formen av en enda polypeptidkedja. Tertiär struktur bestäms av interaktioner mellan aminosyrarester som är långt ifrån varandra i kedjan. En mängd olika interaktioner ger upphov till protein tertiär struktur, såsom disulfidbroar, vilka är bindningar mellan sulfhydryl (–SH) funktionella grupper på aminosyrasidgrupper; vätebindningar; jonbindningar; och hydrofoba interaktioner mellan icke-polära sidokedjor. Alla dessa interaktioner, svaga och starka, kombineras för att bestämma den slutliga tredimensionella formen av proteinet och dess funktion (Figur 5).
processen genom vilken en polypeptidkedja antar en storskalig, tredimensionell form kallas proteinvikning. Vikta proteiner som är fullt funktionella i sin normala biologiska roll sägs ha en inbyggd struktur. När ett protein förlorar sin tredimensionella form kan det inte längre vara funktionellt. Dessa utfällda proteiner denatureras. Denaturering innebär förlust av den sekundära strukturen och tertiärstrukturen (och, om den finns, den kvartära strukturen) utan förlust av den primära strukturen.
vissa proteiner är sammansättningar av flera separata polypeptider, även kända som proteinunderenheter. Dessa proteiner fungerar tillräckligt endast när alla underenheter är närvarande och korrekt konfigurerade. Interaktionerna som håller dessa underenheter tillsammans utgör den kvartära strukturen hos proteinet. Den övergripande kvartära strukturen stabiliseras av relativt svaga interaktioner. Hemoglobin har till exempel en kvaternär struktur av fyra globulära proteinsubenheter: två polypeptider av typ och två av typ av polypeptider, var och en innehållande ett järnbaserat hem (Figur 6).

Figur 6. En hemoglobinmolekyl har två megapixlar och två polypeptider tillsammans med fyra hemgrupper.
en annan viktig klass av proteiner är de konjugerade proteinerna som har en icke-proteindel. Om det konjugerade proteinet har ett kolhydrat fäst kallas det ett glykoprotein. Om den har en lipid fäst kallas den ett lipoprotein. Dessa proteiner är viktiga komponenter i membran. Figur 7 sammanfattar de fyra nivåerna av proteinstruktur.

Figur 7. Proteinstrukturen har fyra nivåer av organisation. (kredit: modifiering av arbetet av National Human Genome Research Institute)
Tänk på det
- vad kan hända om ett protein primära, sekundära, tertiära eller kvartära struktur ändras?
primär struktur, dysfunktionella proteiner och cystisk fibros

figur 8. Klicka för att se en större bild. Det normala CFTR-proteinet är ett kanalprotein som hjälper salt (natriumklorid) att röra sig in och ut ur celler.
proteiner associerade med biologiska membran klassificeras som extrinsiska eller inneboende. Extrinsiska proteiner, även kallade perifera proteiner, är löst associerade med ena sidan av membranet. Intrinsiska proteiner, eller integrerade proteiner, är inbäddade i membranet och fungerar ofta som en del av transportsystem som transmembranproteiner. Cystisk fibros (CF) är en mänsklig genetisk störning orsakad av en förändring i transmembranproteinet. Det påverkar mestadels lungorna men kan också påverka bukspottkörteln, levern, njurarna och tarmen. CF orsakas av en förlust av aminosyran fenylalanin i en cystisk fibros transmembranprotein (CFTR). Förlusten av en aminosyra förändrar den primära strukturen hos ett protein som normalt hjälper till att transportera salt och vatten in och ut ur celler (figur 8).
förändringen i den primära strukturen förhindrar att proteinet fungerar ordentligt, vilket gör att kroppen producerar ovanligt tjockt slem som täpper till lungorna och leder till ackumulering av klibbigt slem. Slemet hindrar bukspottkörteln och stoppar naturliga enzymer från att hjälpa kroppen att bryta ner mat och absorbera viktiga näringsämnen.
i lungorna hos individer med cystisk fibros ger det förändrade slemet en miljö där bakterier kan trivas. Denna kolonisering leder till bildandet av biofilmer i lungans små luftvägar. De vanligaste patogenerna som finns i lungorna hos patienter med cystisk fibros är Pseudomonas aeruginosa (figur 9a) och Burkholderia cepacia. Pseudomonas skiljer sig inom biofilmen i lungan och bildar stora kolonier, kallade ”mucoid” Pseudomonas. Kolonierna har en unik pigmentering som dyker upp i laboratorietester (figur 9b) och ger läkare den första ledtråden att patienten har CF (sådana kolonier är sällsynta hos friska individer).

Figur 9. (a) en svepelektronmikrograf visar den opportunistiska bakterien Pseudomonas aeruginosa. B) pigmentproducerande P. aeruginosa på cetrimid agar visar det gröna pigmentet som kallas pyocyanin. (kredit a: modifiering av arbetet av Centers for Disease Control and Prevention)
nyckelbegrepp och sammanfattning
- aminosyror är små molekyler som är väsentliga för allt liv. Var och en har ett koldioxidkol till vilket en väteatom, karboxylgrupp och amingrupp är bundna. Den fjärde bundna gruppen, representerad av R, varierar i kemisk sammansättning, storlek, polaritet och laddning mellan olika aminosyror, vilket ger variation i egenskaper.
- Peptider är polymerer som bildas genom koppling av aminosyror via dehydreringssyntes. Bindningarna mellan de länkade aminosyrorna kallas peptidbindningar. Antalet aminosyror kopplade ihop kan variera från några till många.
- proteiner är polymerer som bildas genom koppling av ett mycket stort antal aminosyror. De utför många viktiga funktioner i en cell, som fungerar som näringsämnen och enzymer; lagringsmolekyler för kol, kväve och energi; och strukturella komponenter.
- strukturen hos ett protein är en kritisk determinant av dess funktion och beskrivs av en graderad klassificering: primär, sekundär, tertiär och kvartär. Den nativa strukturen hos ett protein kan störas av denaturering, vilket resulterar i förlust av dess högre ordningsstruktur och dess biologiska funktion.
- vissa proteiner bildas av flera separata proteinsubenheter, interaktionen mellan dessa subenheter som komponerar den kvartära strukturen hos proteinkomplexet.
- konjugerade proteiner har en nonpolypeptiddel som kan vara ett kolhydrat (bildar ett glykoprotein) eller en lipidfraktion (bildar ett lipoprotein). Dessa proteiner är viktiga komponenter i membran.
Multiple Choice
vilken av följande grupper varierar mellan olika aminosyror?
- väteatom
- karboxylgrupp
- R-grupp
- aminogrupp
aminosyrorna som finns i proteiner skiljer sig åt i vilket av följande?
- storlek
- form
- sidogrupper
- alla ovanstående
vilka av följande bindningar är inte inblandade i tertiär struktur?
- peptidbindningar
- jonbindningar
- hydrofoba interaktioner
- vätebindningar
fyll i ämnet
sekvensen av aminosyror i ett protein kallas dess __________.
denaturering innebär förlust av __________ och __________ strukturer utan förlust av __________ struktur.
True / False
en förändring i en aminosyra i en proteinsekvens resulterar alltid i en funktionsförlust.
Tänk på det
- uppvärmning av ett protein tillräckligt kan få det att denaturera. Med tanke på definitionen av denaturering, vad säger detta uttalande om styrkorna hos peptidbindningar jämfört med vätebindningar?
- bilden som visas representerar en tetrapeptid.

- hur många peptidbindningar finns i denna molekyl?
- identifiera sidogrupperna av de fyra aminosyrorna som utgör denna peptid.
