introduktion
cytotoxiska celler är integrerade i kampen mot virusinfekterade och cancerceller. Dessa celler dödar genom tre olika vägar, frisättningen av lytiska granuler, Fas-receptor–ligandvägen eller spår-SPÅRRECEPTORVÄGEN. I detta dokument kommer vi att fokusera på degranulering. När en cytotoxisk cell möter en målcell, klibbar den tätt mot den och bildar immunsynapsen. De lytiska granulerna polariseras sedan mot den immunologiska synapsen och frigörs från den cytotoxiska cellen riktad mot målet (1). Dessa granuler innehåller olika cytotoxiska mediatorer såsom perforin och granzymer. Släppt perforin kan bilda övergående porer i målcellmembranet så att granzymer kan komma in i målcellen. Inträde medieras förmodligen också av perforin oligomerer som bildar ofullständiga porer (bågar) (2), och det har också föreslagits att granzymer och perforin kan tas upp i målcellerna genom endosomvägen (3, 4). Uppgifterna bakom dessa föreslagna mekanismer har nyligen diskuterats i detalj (5). När granzymes går in i målceller aktiveras caspasvägen vilket resulterar i apoptos (6, 7). Membranet i dessa cytotoxiska granuler innehåller lysosomalt associerat membranglykoprotein-1 (LAMP1), även känt som CD107a (8). Den luminala delen av råtta CD107a exponeras övergående för den extracellulära sidan av cellmembranet efter degranulering innan den återigen internaliseras. Därför indikerar cd107a-färgning att en degranuleringshändelse har inträffat (9). Medan rollen för CD107a fortfarande bestäms, har siRNA-studier mot CD107a visat att det är viktigt för perforin-handel i vesiklarna, eftersom leverans av perforin till lytiska granuler hämmas i frånvaro av CD107a (10). CD107a har också visat sig ha en roll för att skydda cytotoxiska celler från döden genom att binda till perforin och förhindra införande i cellmembranet (11).
det finns två huvudtyper av cytotoxiska lymfocyter, naturliga mördarceller (nk) och CD8 T-celler. Båda celltyperna dödar genom frisättning av lytiska granuler, Fas-receptorn/Fas-ligandvägen och TRAIL/TRAIL-receptorvägen, men stimulansen som krävs för att aktivera dessa två cellgrupper är annorlunda. T-celler känner igen antigen som presenteras av MHC klass i-molekyler genom deras aktiverande T-cellreceptor (TCR), medan NK-celler känner igen målcellantigener även om olika hämmande och aktiverande receptorer. Hämmande receptorer är viktiga för att förhindra att NK-celler dödar friska celler medan aktiverande receptorer inducerar nk-cellcytotoxicitet.
före identifieringen av CD107a som en markör för degranulering i NK-celler (12) var utgången för mätning av den cytotoxiska förmågan målcellernas död. Detektion av CD107a genom flödescytometri gjorde det möjligt för forskare att identifiera de specifika effektorcellerna med cytotoxisk förmåga. Sedan upptäckten har ett brett utbud av publikationer av data från mus-och humanstudier slutförts som visar fördelen med att använda en anti-CD107a-antikropp. Råttan är en värdefull immunologisk djurmodell för att studera sjukdomar som leukemi och transplantat vs. värdsjukdom (13), men funktionella avläsningar har hindrats av bristen på högkvalitativa specifika anti-råtta CD107a-antikroppar för flödescytometri. Denna uppsats beskriver skapandet av en antikropp mot råtta CD107a och karakterisering av degranuleringssvaret i råtta NK och CD8+ T-celler.
material och metoder
djur
armeniska inavlade hamstrar (Cytogen Research and Development Inc., MA, USA) var inrymt i Institutionen för komparativ medicin vid Rikshospitalet, Oslo Universitetssjukhus, i överensstämmelse med institutionella riktlinjer. Råttstammarna PVG-RT1U, PVG-RT7b, PVG-RT1N och PVG-R23 användes omväxlande och underhålls i mer än 20 generationer och inrymdes i enlighet med riktlinjer som fastställts av Experimental Animal Board under Norges Jordbruksministerium och av den europeiska konventionen om skydd av ryggradsdjur som används för experimentella och andra vetenskapliga ändamål. Råttor användes vid 8-12 veckors ålder. Försöksdjursanläggningarna utsätts för ett rutinmässigt hälsoövervakningsprogram och testas för smittsamma organismer enligt en modifiering av Federation of European Laboratory Animal Science Association rekommendationer. Djurförsök reglerades genom laboratoriebestämmelser, som läggs fram av djurskyddslagen där Norge följer EU: s laboratorieriktning och den europeiska laboratoriekonventionen.
Abs och reagenser
antikroppar mot Nkp46 , NKR-P1A 3.2.3-PB eller okonjugerad (bindande endast NKR-P1A, men inte NKR-P1B, i PVG-stammen), CD8 (OX8-biotin), CD2 (OX34, okonjugerad), TCR (R73-Alexa647), mus IgD b allotyp (TIB96-okonjugerad, används som mus IGG-isotyp) och CD45.2 (His41-FITC, används som mus IGG-isotyp) gjordes i vårt laboratorium och konjugerad enligt standardprotokoll. Antikroppar mot CD3 (IF4, okonjugerad) och dess isotypmus IgM (MM-30, okonjugerad) och armenisk hamster IGG-isotypkontroll (HTK88-FITC) köptes från Biolegend (San Diego, CA, USA). Kommersiella anti-CD107a-antikroppar köptes från AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) och Lifespan (Seattle, WA, USA) (LS-C8580-okonjugerad). LS – C8580 konjugerades med Alexa488 NHS ester (Sigma-Aldrich, St.Louis, MO, USA) för användning i funktionella analyser. Anti-FLAGGANTIKROPP (M2, okonjugerad) och anti-mus IgG (get polyclonal-FITC) köptes från Sigma-Aldrich (St.Louis, MO, USA). IL – 2 erhölls från en dialyserad cellkultursupernatant av en kinesisk hamster äggstock (CHO) cellinje stabilt transfekterad med en råtta IL-2-uttryckskonstruktion. Peridinin klorofyll-ett Protein (PerCP) konjugerat streptavidin, FITC hamster IGG polyklonal isotyp kontroll, FITC mus IgG1 isotyp kontroll (MOPC-FITC) och GolgiStop köptes från BD biosciences (Franklin Lakes, NJ, USA). Get anti-armenisk hamster (polyclonal-FITC) köptes från Jackson Immunoresearch (West Grove, PA, USA). Supernatanter från hybridom OX41, CD172a (SIRPa), R73 (Anti-rat Tcra Bisexuell), OX19 (Anti-CD5), OX12 (Anti-Igk-kedja) och OX33 (Anti-CD45RA) gjordes internt. Kontroll hamster serum härleddes från un-immuniserade armeniska hamstrar.
kloning av råtta CD107a
råtta CD107a förstärktes PCR från cDNA genererad från PVG råttsplenocyter och subklonerades till en PMX-uttrycksvektor innehållande en put-resistensgen (en generös gåva från Dr.Michael R. Daws) (14). CD107 primers designades baserat på en råtta CD107a (LAMP1) cDNA-sekvens (GenBank: NM_012857). Framåt primer: 5 ’- GCCCCAGCACTGTTCGAGGT-3’; omvänd primer: 5 ’-GTTGTTACCGTCCTGTACACACAKT-3’. En anjonisk trypsin – 1-ledarpeptid (MSALLILALVGAAVA) användes i uttrycksvektorn och den ursprungliga CD107-transmembranregionen ersattes av ett CD8-transmembranfragment för att underlätta högt ytuttryck. En FLAGGMÄRKE (DYKDDDDK) ligerades till N-terminalen för CD107-proteinet för att göra ytuttrycket detekterbart. Alla infogade sekvenser och öppen läsram i den slutliga chimära plasmidkonstruktionen undersöktes och bekräftades genom Sanger DNA-sekvensering.
Transfecting BWZ.36 celler med PMX-CD107a-Plasmid
293t-celler såddes i en 6-brunnscellodlingsplatta med 4 ml RPMI 1640-medium, transfekterades med 7,5 oc-l FuGENE6-reagens (Roche, tillverkarens protokoll) och inkuberades vid 37 oc C med 5% CO2. FuGENE6-reagenset förspäddes med Opti-MEM (Gibco) och blandades med 1,5 occurg pMX-CD107a plasmid och 1 occurg pCL-ECO gnagare specifik retroviral förpackningsplasmid (Addgene #12371). Tjugofyra timmar efter transfektion descanterades supernatanten och ersattes med rpmi1640-medium med 2% FBS och överfördes till 32 C-C för retroviral produktion. Fyrtioåtta timmar senare skördades supernatanten och filtrerades med ett 0,2-occurm Filtropur s-filter (Sarstedt) och sparades vid -80 occur C för retroviral transduktion.
den 105 BWZ.36 celler såddes per brunn i en 24-brunns cellodlingsplatta (Corning) och odlades med färskt rpmi1640-medium med 10% FBS, över natten. Supernatanten avlägsnades och rpmi1640 innehållande 10% FBS, 16 occurg polybrene (till en slutlig koncentration 8 occurg/ml) och 1,5 ml retroviral supernatant tillsattes och centrifugerades vid 32 occur C vid 2400 rpm i 2 timmar. Cellerna inkuberades sedan vid 32 kg C i 1 timme, varefter supernatanten avlägsnades och ersattes med färskt rpmi1640-medium med 10% FBS och odlades i 3 dagar, vid 37 kg C med 5% CO2 (på dag 2 kunde komplett medium med 1 ng/ml puromycin användas). Utvidgade BWZ. CD107a-FLAGGTRANSFEKTANTER undersöktes för ytuttryck av FLAGGMÄRKET och användes sedan för antikroppsimmunisering eller antikroppsscreening.
generering av CD107a som uttrycker Transfektanter
den chimära rått-CD107a-plasmiden transfekterades i CHO-celler. I korthet odlades CHO-celler i fullständigt rpmi1640-medium (cRPMI; RPMI1640-medium med 10% FBS, 1 mm Na-pyruvat, 50 occurm 2-merkaptoetanol) tills de nådde 30% sammanflöde. Plasmiden på 2,5 oc-g blandades med 7,5 oc-l Fugene 6-reagens (Roche) och tillsattes droppvis till celler. Två dagar efter avlägsnades CHO-cellerna med rpmi1640-medium kompletterat med 2 mm EDTA och såddes ut i 96-brunns platta bottencellodlingsplattor (25-celler/brunn) med urvalsmedium (cRPMI kompletterat med 20 kg/ml putromycin) för kloning av stabila transfektanter. Efter 10-12 dagars kultur screenades vuxna kloner med anti-FLAGGANTIKROPP (M2). En av klonerna som uttryckte högsta ytnivå av flagga och CD107a användes för immuniseringar.
immunisering och cellfusion
de 3-till 10 veckor gamla manliga armeniska inavlade hamstrarna immuniserades genom intraperitoneala injektioner (i.p.) med 2 msk 106 CHO.CD107a-FLAGGCELLER en gång i veckan i 3 veckor. Ett uppsving med 4 106 106 stabilt transfekterade BWZ. CD107a-FLAGGCELLER gavs IP 32 dagar efter första immuniseringen och sera analyserades för ytfärgning av både CHO.CD107a-flagga och BWZ.CD107a-flagga transfektanter. Två av de tre djuren var positiva, och 3 dagar efter förstärkning skördades mjältceller och samlades från de två djuren, varav en hade splenomegali. 2,0 × 108 mjältceller och 1,4 × 108 NS0 myelomceller spolades tre gånger i DMEM med tillsatser (1mM natrium pyruvat, 0,05 mM 2-mercaptoethanol och antibiotika/antimykotisk) och centrifugeras på 90 g i 10 min. Att hålla allt på 37 CCB från denna punkt framåt, löstes pelleten genom att knacka på röret och föruppvärmd polyetylenglykol 1500 (Roche) tillsattes droppe för droppe under omrörning försiktigt i 1 min. Tre milliliter DMEM med tillsatser tillsattes gradvis för nästa 3 min efterbehandling med en extra 7 ml innan centrifugerades vid 500 g. pelleten tvättades genom noggrann spolning (ingen resuspension) med DMEM med tillsatser och 20% FBS (DMEM-20) och odlades över natten. Celler skördades följande dag och 100 ml DMEM-20 med 2 kg hypoxantin–aminopterin–tymidin (SIGMA) och 10% hybridom kloning tillägg (HCS) (PAA) tillsattes. Cellsuspensionen överfördes till 96-brunnsplattor. Efter 12 dagar testades supernatanter från växande kloner med flödescytometri för färgning av ytantigener närvarande på BWZ.CD107a-flagga och CHO.CD107a-flagga, men inte på BWZ.36 celler transfekterade med irrelevanta FLAGGMÄRKTA antigener som negativa kontroller. 9 av 12 positiva kloner som producerar specifika antikroppar subklonerades ytterligare med användning av DMEM-20 kompletterat med hypoxantin-tymidin och HCS. Endast en klon (SIM1) producerade fortfarande antikroppar efter subkloning och detta subklonerades ytterligare en gång. CD107a – specifika hamster IgG-antikroppar detekterades av FITC anti-armenisk hamster IGG (Jackson Immunoresearch). Anti-CD107a från SIM1 hybridom renades av HiTrap Protein g HP (GE Healthcare, Life Sciences) och FITC-konjugerad enligt standardprocedurer eller Alexa488-konjugerad enligt tillverkarens protokoll.
generering av effektorceller
singelcellsuspensioner framställdes från mjälten. Lymfocyter isolerades med användning av en Lymfoprep-gradient och kördes sedan över en nylonullkolonn för att avlägsna B-celler och makrofager. För generering av IL-2-aktiverade NK-celler (LAK) odlades de återstående cellerna över natten i IL-2. Följande dag avlägsnades icke-vidhäftande celler genom tvättning med PBS och de vidhäftande NK-cellerna bibehölls i RPMI kompletterat med IL-2, 10% värmeinaktiverat FBS, 1% Streptomycin/Penicillin, 1 mm natriumpyruvat och 50 kg 2-merkaptoetanol. Celler odlades i 8-10 dagar. För generering av berikade NK-celler eller sorterade T-och NK-celler berikades celler genom negativt urval efter nylonullsteget. För anrikning av NK-celler belades pan-mus IGG Dynabeads (Invitrogen Dynal) med antikroppar mot makrofager (OX41), T-celler (R73 och OX19) och B-celler (OX12 och OX33). För anrikning av T-celler färgades pan-mus IGG Dynabeads med antikroppar mot makrofager (OX41) och B-celler (OX12 och OX33). Celler berikades med två steg av negativt urval med färgade pärlor för 30 min vid 4 msk C. Berikade NK-celler hade en renhet på cirka 50-60% och användes för degranuleringsstudier. Berikade T-celler (79-85% renhet) sorterades vidare för TCR+ – celler med användning av en FACS Aria (BD Biosciences).
Degranuleringsanalyser
för att mäta degranuleringssvaret genom färgning med Anti-rat CD107a (SIM1) under målcellstimulering inkuberades NK-effektorer och YAC-målceller, i ett förhållande 1 till 1 på 3 105 celler/brunn (om inte annat anges) i media innehållande SIM1 mAb, de andra kommersiellt tillgängliga Anti-CD107a-antikropparna eller isotypkontroll. För att mäta degranuleringssvaret på antikroppsstimulering från NK-celler använde vi platta 96-brunnsplattor belagda med varierande koncentrationer av anti-NKp46 (Wen23), anti-NKR-P1A (3.2.3) och en mus IgG1-isotypkontroll (TIB96). Följande dag tvättades plattorna med PBS och blockerades med cRPMI innan tillsats av 3 105-berikade NK-celler suspenderade i cRPMI innehållande SIM1 tillsattes per brunn. För att mäta degranulering från T-celler sorterades och odlades de i cRPMI med IL-2 i 2-3 dagar. De 96-väl platta bottenplattorna belades över natten med antikroppar mot CD3 (IF4), CD2 (OX34) eller en IgM-isotypkontroll (MM-30). Om 3 105 T-celler tillsattes per brunn i cRPMI innehållande SIM1. Alla analyser inkuberades i 4 timmar. Golgistop tillsattes under de senaste 3 h inkubation för att förhindra nedbrytning av internaliserad CD107a. celler tvättades sedan och färgades med antikroppar mot lämpliga ytreceptorer och analyserades med hjälp av FACS Canto eller LSR II (BD Biosciences).
Kromfrigöringsanalys
YAC-1-målceller (5 106 celler/ml cRPMI) med tillsatt 3.7 MBq51Cr inkuberades vid 37 kcal C under 1 h, omröring var 15: e minut. Cellerna tvättades sedan tre gånger med PBS med 2% FBS och resuspenderades till 1 105 celler/ml i cRPMI. Lak effektorceller och målceller pläterades vid de angivna förhållandena i en slutlig volym av 200 occyl. Celler centrifugerades och inkuberades för 4 h vid 37 C. specifik frisättning av 51Cr mättes med användning av Cobra auto-gamma (Packard).
resultat
för att skapa en antikropp mot CD107a gjorde vi en uttrycksvektor innehållande det extracellulära membranområdet för råtta CD107a, transmembranområdet för råtta CD8 och en 3′-terminal FLAGGMÄRKE för att detektera ytuttryck (Figur 1a). Vektorn transfekterades till CHO-celler och BWZ.36 t-cellinje och screenad för CD107a-uttryck med användning av en anti-FLAGGANTIKROPP (M2) (Figur 1b). CD107a stabilt transfekterade CHO-celler injicerades i armeniska inavlade hamstrar en gång i veckan i 3 veckor med en slutlig boost av CD107a stabilt transfekterade BWZ-celler 3 dagar före fusion med NS0-myelomcellinjen. Supernatanter från de olika klonerna testades för specificitet mot BWZ. CD107a-flagga, men inte irrelevant FLAGGMÄRKT BWZ.36 transfektanter. En klon, SIM1, befanns binda specifikt till CD107a som uttrycker transfektant, men inte till flaggan transfekterad kontroll (figur 1C).

Figur 1. Generering av en anti-råtta CD107a monoklonal antikropp (SIM1). (A) schematisk vektorkarta över PMX-uttrycksvektorn med ledarpeptid, FLAGGMÄRKE, CD107a-insats och CD8-transmembrandomänen. B) stabilt transfekterad Kinesisk hamster äggstock och BWZ.36 celler testades för cellytuttryck av FLAGGMÄRKT CD107a med användning av en anti-FLAGGANTIKROPP (M2) (skuggade histogram). Negativ kontroll är enbart sekundär antikropp (transparent histogram). (C) BWZ-celler transfekterade med CD107a-flagga eller irrelevant antigen (NKR-P1F-flagga) färgades med hamsterkontrollserum, SIM1-supernatant eller en anti-FLAGGANTIKROPP (M2).
klonen SIM1 testades vidare i funktionella analyser parallellt med två kommersiellt tillgängliga CD107a-antikroppar, som potentiellt kan korsreagera med råtta CD107a i flödescytometri. Antikroppsklonerna som testades var H4A3 från AbCam (som korsreagerar med människa, råtta, mus och primater i flödescytometri) och antikroppsklonen LS-C8580 från LifeSpan BioSciences (som korsreagerar med CD107a från mus, människa och råttor i immunhistokemi och Western blots enligt tillverkarens webbplats). Vår SIM1-antikroppsklon identifierade degranulerande celler i närvaro av målceller och visade liten bakgrundsfärgning i frånvaro av mål (övre panel figur 2a). Klon H4A3 färgade Den högsta andelen NK-celler efter målcellstimulering (mittpanel). Det fanns emellertid också en hög nivå av bakgrundsfärgning i frånvaro av målceller, vilket indikerar ospecifik bindning. Mycket låga nivåer av degranulering, om någon, mättes av LS-C8580 mAb-klonen (nedre panelen). Specificiteten hos dessa antikroppar bekräftades genom positiv färgning av BWZ. CD107a-FLAGGTRANSFEKTANT, men inte BWZ.NKR-P1F-FLAGGKONTROLL (Figur 2B). Antikroppsklon H4A3, som har visat sig binda till humana CD107a (16), fläckade inte råtta CD107a transfekterade BWZ-celler, vilket indikerar att det inte finns någon korsreaktion med råtta CD107a. anti-mus CD107a klon ID48 misslyckades också med att fläcka råtta CD107a transfektant. Okonjugerad LS-C8580 visade å andra sidan specifik färgning av CD107a transfekterade celler (data visas inte). Ls-c8580-klonen är emellertid endast tillgänglig som okonjugerad antikropp som inte är lämplig för degranuleringsstudier. Upprepade försök i vårt laboratorium att konjugera LS-C8580 till Alexa488 har tyvärr inte gett några starka färgningskonjugat, även om den lilla provstorleken och koncentrationen av LS-C8580 kan vara orsaken till den dåliga konjugationen. Konjugerad LS-C8580 visar reducerad men specifik färgning av CD107a transfekterade celler (Figur 2B), men som visas i Figur 2a kunde vi inte detektera degranulerande celler under funktionella analyser med detta konjugat. Sammanfattningsvis fläckar SIM1 mAb specifikt degranulerande råtta NK-celler efter stimulering med målceller.

Figur 2. SIM1 mäter degranulering från naturliga mördare (nk) och CD8 T-celler. (A) procent degranulerande celler mättes med anti-CD107a-antikroppar SIM1, H4A3 och LS-C8580, med eller utan YAC-1-målceller som stimulans. Ett representativt experiment på fyra visas (B). Färgning av BWZ. CD107a-FLAGGCELLINJEN med SIM1, H4A3, LS-C8580 eller ID48 antikroppskloner. BWZ.36 celler transfekterade med irrelevant FLAGGMÄRKT antigen (BWZ.Nkr-P1G-flagga) inkluderades som en negativ kontroll, (C) berikade NK-celler stimulerades med plattbundna anti-NKp46, anti-Nkr-P1A eller mus IgG1 som isotypkontroll, och SIM1 användes för att mäta procentuella degranulerande celler. Nkp46 + (Wen23) eller Nkr-P1Abright (3.2.3) celler var gated på. (D) TCR+-celler sorterades (Renhet 99%) och odlades i IL-2 i 2-3 dagar. Cellerna stimulerades sedan med platta bunden anti-CD3 och anti-CD2 eller mus IgM isotyp kontroll för anti-CD3. Den nedre panelen visar stimulering med anti-CD3 och anti-CD2 och färgning med en SIM1-isotypkontroll (FITC hamster IgG polyclonal). T-celler sorterades med användning av R73-Alexa647 och 3.2.3-PB antikroppar, gating på R73 + / 3.2.3− celler. Data som visas är från ett representativt experiment av tre separata oberoende experiment.
direkt stimulering av aktiverande nk-receptorer genom plattbundna antikroppar är en annan potent metod för att inducera degranulering. För att testa SIM1-klonen i denna funktionella analys inkuberade vi berikade NK-celler på plattor belagda med antikroppar mot de aktiverande receptorerna NKp46 och NKR-P1A (figur 2C). Som en negativ kontroll belades plattor med mus IgG1-isotypkontroll. Färgning med SIM1-antikroppen identifierade 25,5 eller 44% degranulerande celler efter nk-cellstimulering i plattor belagda med 5 Aug/ml anti-NKp46 respektive anti-Nkr-P1A. Procentandelen av degranulerande celler ökade ytterligare när plattorna belades med en högre koncentration av stimulerande antikroppar (10 occurg/ml). Ingen degranulering inducerades i brunnar belagda med musen IgG1 isotyp kontroll.
vi såg tydligt degranulering i NK-celler stimulerade med antingen målceller eller med antikroppar mot aktiveringsreceptorer genom att använda vår SIM1-antikropp. Vi ville också bekräfta detta i cytotoxiska T-celler. T-celler sorterades från mjältceller och odlades i IL-2 i 2-3 dagar. T-cellerna stimulerades sedan med plattbunden anti-CD3 och anti-CD2 (figur 2D). Degranulering mättes från odlade CD8 + T-celler när de stimulerades med anti-CD3 och anti-CD2 på båda dagarna 2 och 3. Ingen degranulering mättes från icke-cytotoxiska CD4 – T-celler, eller efter stimulering med isotypkontrollantikropp, vilket ytterligare demonstrerar specificiteten hos vår SIM1-antikropp.
Lymfokinaktiverade mördarceller (Lak) skapas genom att odla NK-celler i IL-2 i 7-10 dagar och används ofta som mycket potenta effektorceller i kromfrisättningsanalyser för att studera cytotoxicitet och bör därför kunna generera höga nivåer av degranulering. För att mäta degranulering från LAK-celler använde vi initialt en 1:1 förhållande effektor till mål men fann oväntat låga nivåer av degranulering (data visas inte). Men genom att göra en titrering för att hitta optimal effektor till målförhållanden såg vi att ökande nivåer av degranulering kunde uppnås när effektor till målförhållanden var under 1 (figur 3a). Det optimala förhållandet för degranuleringsanalyser står därför i kontrast till cytotoxicitetsanalyser där nivån av cytotoxicitet ökar med högre effektor: målförhållanden (figur 3b).
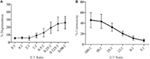
Figur 3. Låg effektor:målförhållanden är viktiga för att säkerställa adekvat känslighet i degranulationsanalyser med råtta NK-celler. (A) degranulering av LAK-celler odlade 8-10 dagar i IL-2 mot YAC-1-mål vid olika effektor:målförhållanden. (B) cytotoxicitet hos IL-2-odlade LAK mot YAC-1-målceller bekräftades med kromfrisättningsanalysen slutförd dag 8-10. Alla grafer är kumulativa av tre eller flera separata experiment med staplar som visar SD.
diskussion
i den initiala testningen av SIM1 och de olika kommersiella CD107a-antikropparna i degranuleringsanalyser i råtta valde vi ett litet intervall av effektor till målförhållanden med en skevning mot mer effektorceller än mål baserat på aktuell litteratur (12, 16, 17). Effektor till målcellsförhållanden kan variera från papper till papper, men tidigare studier som titrerade effektor till målförhållanden har visat att optimal degranulering från mus NK-celler toppade vid 4.5: 1-förhållande med YAC – 1-målceller (18) och humana NK-celler dödade K562-celler bäst i ett förhållande av 5:1 eller 10:1 (12). Men när man använder ett större intervall av effektor till målförhållanden visar vi att degranulering med hjälp av råtta LAK-celler inducerades mer effektivt när man använde fyra eller flera mål per effektorcell. Denna skillnad i optimal effektor: målförhållande mellan råtta och andra arter kan bero på vilken typ av målceller som används, eftersom titreringar av människa och mus effektor till målförhållande i ovannämnda studier använde målceller som härstammar från samma art. Effektorcellerna kan vara känsligare för målceller från samma art och behöver därför färre målceller för att aktiveras. YAC – 1-cellinjen som används i vår studie är ett mus-T-celllymfom, som har varit standarden i många år för att stimulera cytotoxicitet från råtta NK-celler. Vi kan inte utesluta att användning av en råttmålcell skulle resultera i starkare stimulering av NK-cellerna och därefter kan färre målceller behövas för att inducera degranulering.
det framgår också av denna studie att effektor-målförhållandena som används för cytotoxicitetsanalyser inte korrelerar väl med de förhållanden som behövs för att mäta optimalt degranuleringssvar i effektorcellerna. Detta är inte förvånande eftersom avläsningen för dessa två analyser är olika, med cytotoxicitet som mäter målcelldöd och degranulering som mäter NK-svaret på mål.
Sammanfattningsvis har vi höjt en antikropp mot råtta CD107a (SIM1) och karakteriserat dess förmåga att detektera degranulering i cytotoxiska lymfocyter hos råtta. Vi har visat att SIM1 är specifikt för degranulerande celler, och genom optimering av degranuleringsprotokollet har vi bestämt att användning av effektor:målcellsförhållanden lägre än 1:4 säkerställer optimal stimulering av LAK-celler. Utvecklingen av anti-råtta CD107a (SIM1) möjliggör bättre analys och karakterisering av de cytotoxiska svaren hos råttlymfocyter och kommer att vara ett värdefullt verktyg i råttans många sjukdomsmodeller.
Etikdeklaration
studien är godkänd av National Animal Research Authority (FDU), Norge (tillståndsnummer: ID-1698).
Författarbidrag
AS har varit ansvarig för expressionsanalys, funktionella analyser och skrivning av manuskriptet. K-ZD har utfört cDNA-kloning och generering av transfektanter. JTV har varit involverad i projektplanering och handledning, och i skrivandet av manuskriptet. LK har varit ansvarig för immuniseringar, hybridomtekniken, skrivning av manuskriptet och projektövervakning.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
erkännanden
författarna tackar Ulla Heggelund och Stine Martinsen för tekniskt stöd i laboratoriet och personalen vid djuranläggningen vid Institutionen för komparativ medicin vid Rikshospitalet, Oslo Universitetssjukhus för hjälp med vaccinationer. Tack vare Marit Inngjerdingen för vetenskapliga diskussioner.
finansiering
forskningen finansierades av universitetet i Oslo, sydöstra Norge Regional Health (2009104) och Legatet til Henrik Homans Minde.
1. Orange JS. Bildning och funktion av den lytiska nk-cellimmunologiska synapsen. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038 / nri2381
PubMed Abstrakt / CrossRef fulltext / Google Scholar
2. Han är en av de mest kända och mest kända i världen. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Det är en av de mest populära och mest populära. Perforinporer i det endosomala membranet utlöser frisättningen av endocytoserat granzyme B i cytosolen i målceller. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstrakt / CrossRef fulltext / Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforin och granzymes: funktion, dysfunktion och mänsklig patologi. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Det finns många olika typer av produkter. En andra profylaktisk MHC-felaktig benmärgstransplantation skyddar mot råtta akut myeloid leukemi (BNML) utan dödlig graft-versus-host-sjukdom. Transplantation (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Abstrakt | CrossRef fulltext | Google Scholar
14. Lanier LL, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Tillämpningar av retrovirus-medierad uttryck kloning. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Minskad degranulering av NK-celler hos patienter med ofta återkommande herpes. Clin Vaccin Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstrakt / CrossRef fulltext / Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Trä SM, Bj, lång EO, et al. Funktionell analys av humana NK-celler genom flödescytometri. Metoder Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
