introduktion av cellcykelhämmare
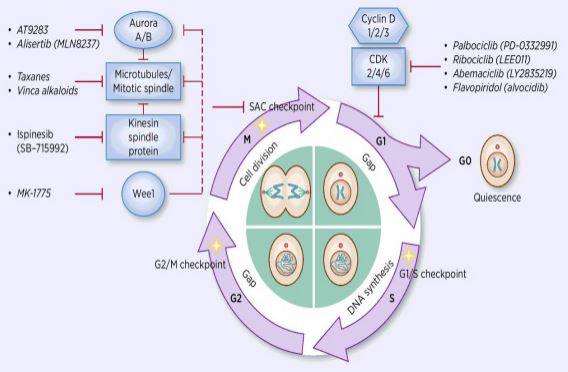
processen för cellcykelreglering är aktivering eller inaktivering av olika regulatoriska faktorer under övervakning av kontrollpunkter, varigenom processen för cell-DNA-replikation och uppdelning i två dotterceller initieras. Bland många cellcykelregulatorer är cyklinberoende Kinas (CDK) kärnan, och det är ett nätverkssystem som reglerar cellcykeln med cyklin-och cyklinberoende kinashämmare (CKI). CDK är en klass av serin / treoninkinaser, och för närvarande finns 13 arter, inklusive CDK1~13, som spelar en roll i cellcykelreglering av CDK och transkriptionell reglering av CDK. Regleringen av cellcykeln är i själva verket regleringen av kontrollpunkter, där G1/S-regleringspunkter är de viktigaste. När cellcykeln stimuleras av externa signaler såsom tillväxtfaktorer binder den katalytiska subenheten CDK4/CDK6 till den regulatoriska subenheten Cyklind, och CDKs-resterna aktiveras genom fosforylering/defosforylering. Efter aktivering av CDK fosforyleras RB-proteinet. Rb-genen, även känd som retinoblastomgenen, är den första klonade tumörsuppressorgenen, och dess förmåga att bilda ett komplex med transkriptionsfaktorer (såsom E2F) efter fosforylering av proteinet förloras. E2F spelar en viktig roll i cellcykelreglering och inducerar uttrycket av cyklin och CDK2 och bildar ett cyklin/CDK2-komplex, vilket ytterligare fosforylerar Rb-protein och helt frigör E2F. därefter kommer E2F in i kärnan för att aktivera en serie cellcykler i S-fas. I den sena fasen av DNA-replikation under S-fasen aktiveras CDK2 av cyklin, som inaktiverar transkriptionsfaktor E2F i tid, vilket förhindrar apoptos orsakad av ihållande aktiverad E2F. Forskningsstatistik visar att mer än 90% av humana cancerformer har mutationer i relaterade gener i CDK -, cyklin -, CKI-och Rb-vägarna, med CDK och dess motsvarande regulatoriska underenhet cyklin är den oftast dysfunktionella. Dessutom främjar fluktuationer i cellcykeln kemoterapiresistens och minskar effekterna av kemoterapi. Därför är regleringen av CDK / Cyklinaktivitet, som återställer normal cellcykel, en av strategierna för behandling av tumörer.
cellcykelhämmare används nu kliniskt
läkemedelsforskare har fokuserat på att hitta olika typer av CDK-och Cyklinhämmare som banbrytande läkemedel mot cancer. För närvarande är CDK-hämmare huvudsakligen uppdelade i endogena och exogena. Den största klassen av endogena småmolekylära hämmare är proteiner med låg molekylvikt, som klassificeras i två breda kategorier beroende på skillnader i strukturella funktioner, och en klass kallas den dubbla specifika familjen INK4, inklusive p15, p16, p18, p19, som hämmar proteinfamiljen. Det hämmande beroende proteinet av Cyklindassocierat Kinas binder till motsvarande fria CDK4 och blockerar därigenom bindningen av CDK4 till motsvarande cyklind för att bilda ett katalytiskt dimerkomplex. Den andra klassen kallas Kip-familjen, inklusive P21,P27, P57. Denna proteinfamilj kan bilda en trimer med ett dimeriskt komplex bestående av cyklin E/CDK2 och cyclinA/CDK1, genom att blockera det katalytiskt aktiva centrumet av dimeren. Inhibering av dessa endogena hämmare, i kombination med kinaskomplexet, reglerar specifikt dess aktivitet och reglerar därigenom cellens transformation från G1 till S-fas. Studier har visat att förekomsten och utvecklingen av flera tumörer är associerade med minskat uttryck av CDK/cykliner eller minskat uttryck av endogena hämmare, såsom radering av P16, som har samband med utvecklingen av melanom, lungcancer, bröstcancer och kolorektal cancer. Deletion av p27-protein är vanligt vid bröstcancer, prostatacancer, koloncancer och mag-tarmcancer. Därför är deletion av endogen CDKs-hämmare eller genmutation en viktig referens för tumördiagnos. Endogena småmolekylära hämmare är också en klass av viktiga icke-kodande RNA som upptäckts de senaste åren. Målplatsregionerna binder till varandra för att snabbt och effektivt försämra mRNA eller hämma translation av proteinet, kontrollera proteinet på en lägre eller optimal nivå och kräva livsaktiviteter. Mer än 10 mikroRNA har upptäckts involverade i cellcykelreglering. Bland dem riktar miR1-2 respektive miR3-4 CDK4 respektive cellcykeln arresteras i G1-fasen, som hämmar tumörcellsproliferation; miR-22 riktar sig mot CDK6-celler. Cykeln stagnerar i G1-fasen, vilket inducerar åldrande i bröstcancerceller. I olika biologiska processer reglerar dessa Mirna cellcykelprogression genom att rikta in E2F, CDK, cyklin, P21, P27, DNA-polymeras alfa, etc. att främja eller blockera nyckelregulatorer i cellcykeln. Exogena hämmare inkluderar antisensnukleinsyror, antikroppar, små störande RNA-interferens (siRNA) och små molekylföreningar. Små molekylföreningar är den viktigaste klassen av exogena CDK-hämmare. Under de senaste åren, eftersom förståelsen av kristallstruktur tillåter människor att genomföra molekylära simuleringsstudier, har genombrott gjorts i design och utveckling av mycket effektiva och selektiva studier på kemiska hämmare av CDK. Det kan sägas att sådana föreningar har nya medlemmar varje dag. För närvarande kan småmolekylära CDK-hämmare delas in i följande 13 kategorier, Roscovitin och Olomouc, pyrimidiner (PD-033299), flavonoider (Flavopiridoler), Tiazoler (SNS03), antracen och dess derivat (SU951), piperidon (Paulloner), imidazopyridin, pyrazolopyridin (AZ703), pyraziner ( AT751), butyrolakton-1 (butyrolakton-1), skorpionin (UCN-01) och andra två arter. Tretton små molekylhämmare har gått in i kliniska prövningar. De är alla småmolekylära kemikalier av plana heterocykler som konkurrerar med ATP för bindning till ATP-bindningsstället för CDK-Kinas. In vivo-experiment visade att CYC202 har god läkemedelsresistens och god oral fysiologisk aktivitet och har uppenbara hämmande effekter på fasta tumörer hos nakna möss inokulerade av humana koloncancer och livmodercancerceller. I fas Ib-studier tog 10 patienter med äggstockscancer CYC i mer än 20 månader, utan ökning av tumörer eller allvarliga behandlingsrelaterade biverkningar, bland vilka en patients tumör har krympt med mer än 30%, och vissa patienter som har behandlats i mer än ett år har ett stabilt tillstånd. Fas II kliniska studier har visat att CYC202 ensam har en något sämre effekt och är effektiv i kombination med andra kemoterapeutiska läkemedel. Fas IIb kliniska prövningar av CYC202 i kombination med capecitabin för behandling av bröstcancer, kombinerat med 2,2-difluorodeoxycytidin eller cisplatin för behandling av lungcancer och nasofaryngealt karcinom pågår också. Utvecklingen och tillämpningen av RNA-interferensteknik med liten molekyl har gjort det möjligt att studera genuttrycket för specifika interventionsmålmolekyler, och många forskare har börjat ingripa i syntesen av CDK/cyklin på den genetiska nivån. Limaet al. transfekterad Cyklininriktad siRNA till Hep3B, HepG2, SNU449 (Cyklinöveruttryck) och HuH7 (Cyklinöveruttryck) och fann att Cyklinuttryck reducerades med 90% i celler. DNA-syntesen reduceras signifikant, och celler genomgår apoptos. Galimberti et al. transfected siRNA targeting CyclinE, CDK2 och CDK1 in i mus lungcancerceller HOP-62, H-522 respektive H-23, och fann att cyklin/CDK2 kan inducera apoptos och hämma proliferationen av lungcancerceller. Minskat CDK1-uttryck orsakat av CDK1 siRNA-interferens orsakar endast cellfasstopp och saktar cellproliferation; medan CDK1-och CDK2 siRNA-saminterferens leder till en samtidig minskning av CDK1-och CDK2-uttryck, vilket orsakar motstånd i cellcykel S-och G2/M-faser. Stagnationen inducerade också apoptos av cellerna. Cao Yinfang och annan framgångsrik transfektion av CDK2 / cyklin siRNA rekombinant uttrycksvektor i HepG2-celler visade att CDK2-och cyklin mRNA-uttryck minskade signifikant, cellcykeln arresterades i S-fas, G1-fasceller ökade signifikant, caspase-3-aktivitet förbättrades, HepG2-celler genomgick apoptos och cellcykelförändringar överensstämde med minskad proliferation av HepG2-cellsin vitro efter transfektion.
funktion av cellcykelhämmare
med fördjupning av förståelsen för den viktiga rollen för cellcykelreglering vid tumörbildning och apoptos har cellcykelreglering studerats ytterligare i tumörkemoterapi resistens. Cyklinberoende kinaser (CDK), som spelar en roll för att driva cellmotorn under cellcykeln, är idealiska mål för tumörterapi. De flesta cancercellerna har aktivering, överuttryck av celldelningscykeln (cdk) – genen och defekter i CDKIs-funktionen. CDK-hämmaren utövar en pausverkan som hämmar cellcykeln. Under de senaste åren har CDKIs blivit en viktig höjdpunkt i cancerterapi, vilket hämmar aktiviteten hos CDK i cellcykeln. En serie kliniska studier har också visat att en enda applikation kan ha måttliga effekter. I kombination med traditionella cytotoxiska kemoterapeutiska läkemedel kan CDKIs emellertid avsevärt förbättra antitumöreffekten av traditionella kemoterapeutiska läkemedel. Därför har forskning om Anticancereffekter av CDKIs-Läkemedel och andra kemoterapeutiska läkemedel blivit en hot spot i den nuvarande behandlingen av tumörresistens.
referens
- Bendris N, Lemmers B, Blanchard J M. cellcykel, cytoskeletondynamik och därefter: de många funktionerna hos cykliner och CDK-hämmare. cellcykeln. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt s G, et al. Inriktning på kärnkinaser i cancer: utveckling av cellcykelkinashämmare. Farmakologi & Terapi. 2014, 142(2):258-269.
- Sten A, Sutherland R L, Musgrove E A. hämmare av cellcykelkinaser: senaste framsteg och framtidsutsikter som cancerterapi. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. cellcykelreglering och melanom. Aktuella Onkologiska Rapporter. 2016, 18(6):34.
- Malumbres M, Barbacid M. cellcykel, CDKs och cancer: ett föränderligt paradigm. Nature Recensioner Cancer. 2009, 9(3):153-166.
