elektronegativitet och Bindningspolaritet
Även om vi definierade kovalent bindning som elektrondelning delas elektronerna i en kovalent bindning inte alltid lika av de två bundna atomerna. Om inte bindningen förbinder två atomer av samma element kommer det alltid att finnas en atom som lockar elektronerna i bindningen starkare än den andra atomen gör, som visas i Figur 4.3 ”polära kontra icke-polära kovalenta bindningar”. När en sådan obalans uppstår, det finns en resulterande uppbyggnad av någon negativ laddning (kallas en partiell negativ laddning och betecknad sackarios−) på ena sidan av bindningen och en viss positiv laddning (betecknad sackarios+) på den andra sidan av bindningen. En kovalent bindning som har en ojämn delning av elektroner, som i del (b) i Figur 4.3 ”polära kontra icke-polära kovalenta bindningar”, kallas en polär kovalent bondA kovalent bindning med en obalanserad elektronfördelning över bindningen.. En kovalent bindning som har en lika stor delning av elektroner (del (A) i Figur 4.3 ”polära kontra icke-polära kovalenta bindningar”) kallas en icke-polär kovalent bondA kovalent bindning med en balanserad elektronfördelning över bindningen..
figur 4.3 polära kontra icke-polära kovalenta bindningar
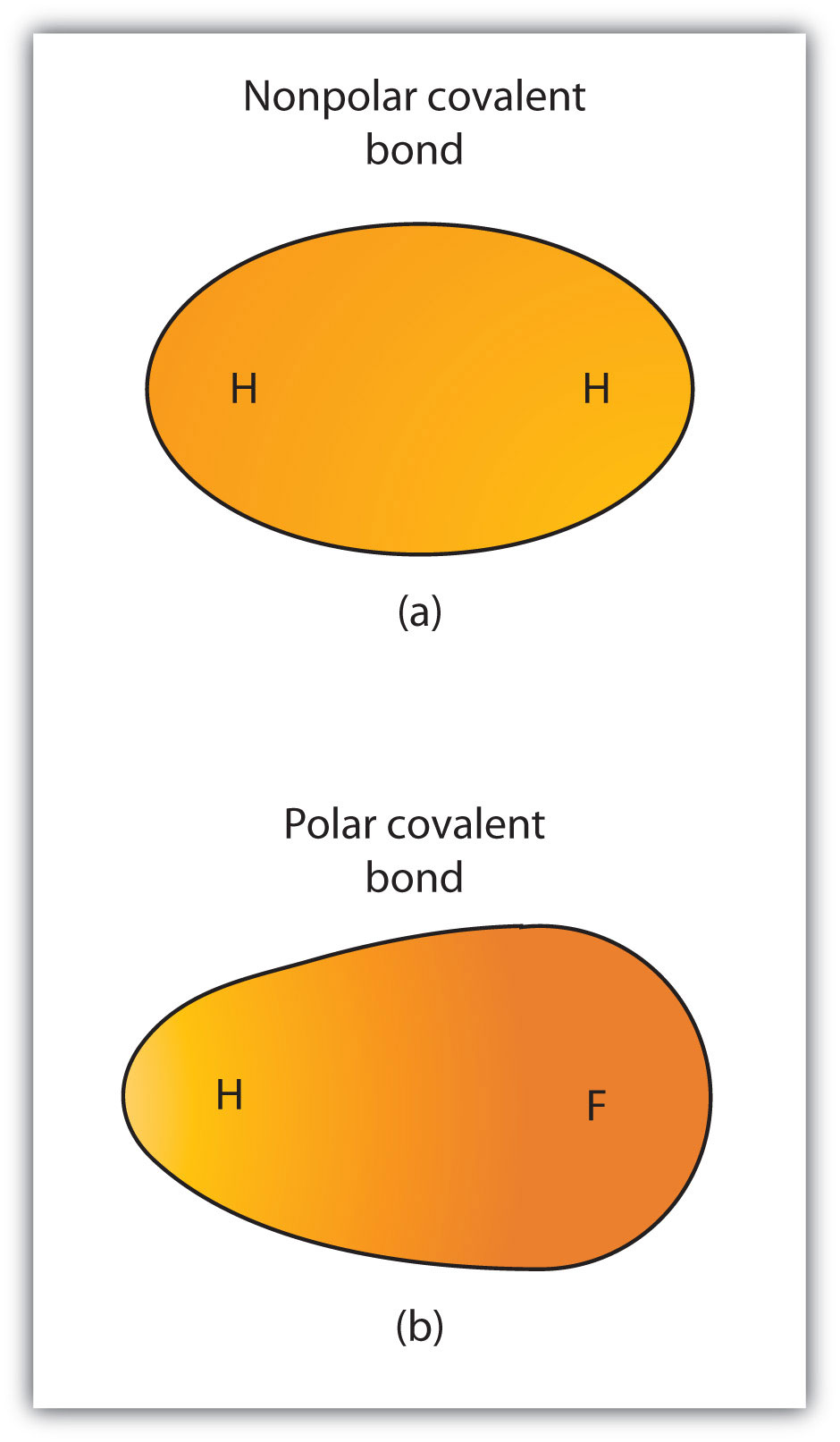
(a) elektronerna i den kovalenta bindningen delas lika av båda väteatomerna. Detta är en icke-polär kovalent bindning. (B) fluoratomen lockar elektronerna i bindningen mer än väteatomen gör, vilket leder till en obalans i elektronfördelningen. Detta är en polär kovalent bindning.
varje kovalent bindning mellan atomer av olika element är en polär bindning, men graden av polaritet varierar mycket. Vissa bindningar mellan olika element är endast minimalt polära, medan andra är starkt polära. Joniska bindningar kan betraktas som den ultimata polariteten, med elektroner som överförs snarare än delas. För att bedöma den relativa polariteten hos en kovalent bindning använder kemister elektronegativitetett relativt mått på hur starkt en atom lockar elektroner när den bildar en kovalent bindning., vilket är ett relativt mått på hur starkt en atom lockar elektroner när den bildar en kovalent bindning. Det finns olika numeriska skalor för att betygsätta elektronegativitet. Figur 4.4 ”elektronegativiteter av olika element” visar en av de mest populära—Pauling-skalan. Polariteten hos en kovalent bindning kan bedömas genom att bestämma skillnaden i elektronegativiteterna hos de två atomer som gör bindningen. Ju större skillnaden i elektronegativiteter desto större är obalansen i elektrondelning i bindningen. Även om det inte finns några hårda och snabba regler är den allmänna regeln om skillnaden i elektronegativiteter är mindre än cirka 0,4, bindningen anses vara icke-polär; om skillnaden är större än 0,4 anses bindningen vara polär. Om skillnaden i elektronegativiteter är tillräckligt stor (i allmänhet större än ca 1,8) anses den resulterande föreningen vara jonisk snarare än kovalent. En elektronegativitetsskillnad på noll indikerar naturligtvis en icke-polär kovalent bindning.
Figur 4.4 elektronegativiteter av olika element
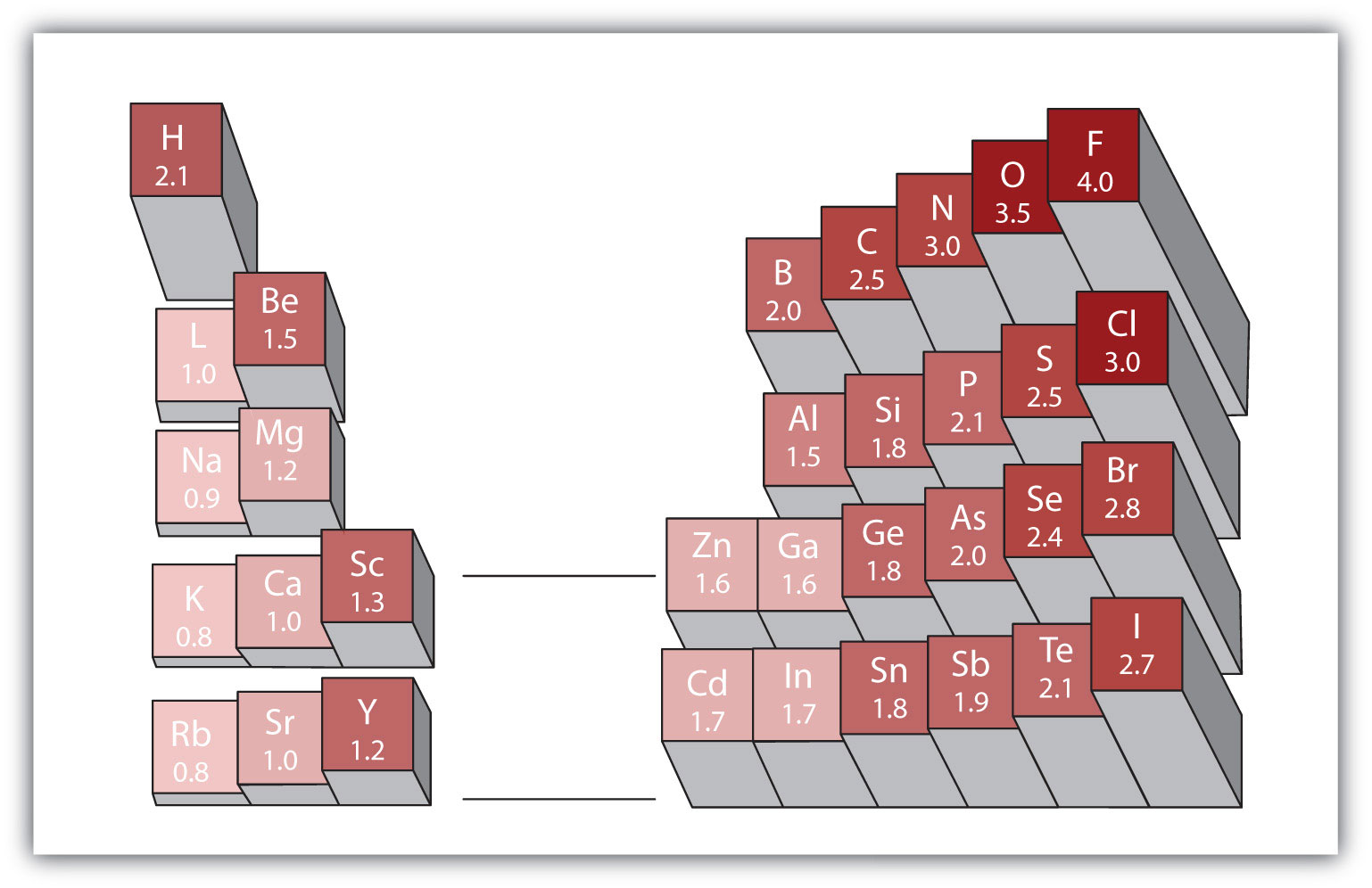
en populär skala för elektronegativiteter har värdet för fluoratomer satt till 4,0, det högsta värdet.
titta närmare: Linus Pauling
förmodligen den mest inflytelserika kemisten i 20-talet, Linus Pauling (1901-94) är den enda personen som har vunnit två individuella (det vill säga odelade) Nobelpriser. På 1930-talet använde Pauling nya matematiska teorier för att förklara några grundläggande principer för kemisk bindning. Hans bok The Nature of the Chemical Bond från 1939 är en av de mest betydelsefulla böcker som någonsin publicerats i kemi.år 1935 vände sig Paulings intresse till biologiska molekyler, och han tilldelades 1954 Nobelpriset i kemi för sitt arbete med proteinstruktur. (Han var mycket nära att upptäcka DNA: s dubbla helixstruktur när James Watson och James Crick tillkännagav sin egen upptäckt av dess struktur 1953.) Han tilldelades senare Nobels fredspris 1962 för sina ansträngningar att förbjuda testning av kärnvapen.
under sina senare år blev Pauling övertygad om att stora doser C-vitamin skulle förhindra sjukdom, inklusive förkylning. De flesta kliniska undersökningar visade inte ett samband, men Pauling fortsatte att ta stora doser dagligen. Han dog 1994, efter att ha tillbringat en livstid med att skapa ett vetenskapligt arv som få någonsin kommer att motsvara.

Linus Pauling var en av 20-talets mest inflytelserika kemister.
exempel 6
beskriv elektronegativitetsskillnaden mellan varje par atomer och den resulterande polariteten (eller bindningstypen).
- C och H
- h och H
- Na och Cl
- o och H
lösning
- kol har en elektronegativitet på 2,5, medan värdet för väte är 2,1. Skillnaden är 0,3, vilket är ganska liten. C – H-bindningen anses därför vara icke-polär.
- båda väteatomerna har samma elektronegativitetsvärde—2.1. Skillnaden är noll, så bindningen är icke-polär.
- natriums elektronegativitet är 0,9, medan klor är 3,0. Skillnaden är 2,1, vilket är ganska högt, och så bildar natrium och klor en jonförening.
- med 2,1 för väte och 3,5 för syre är elektronegativitetsskillnaden 1,4. Vi förväntar oss en mycket polär bindning, men inte så polär att O–H-bindningen anses vara jonisk.
färdighetsbyggande övning
-
C och O
-
k och Br
-
N och N
-
Cs och F
beskriv elektronegativitetsskillnaden mellan varje par atomer och den resulterande polariteten (eller bindningstypen).
När en molekyls bindningar är polär, molekylen som helhet kan visa en ojämn fördelning av laddning, beroende på hur de enskilda bindningarna är orienterade. Till exempel böjs orienteringen av de två O–H-bindningarna i en vattenmolekyl (figur 4.5 ”fysikaliska egenskaper och polaritet”): den ena änden av molekylen har en partiell positiv laddning och den andra änden har en partiell negativ laddning. Kort sagt är molekylen i sig polär. Vattnets polaritet har en enorm inverkan på dess fysikaliska och kemiska egenskaper. (Till exempel är kokpunkten för vatten hög för en så liten molekyl och beror på det faktum att polära molekyler lockar varandra starkt.) Däremot, medan de två C=O-bindningarna i koldioxid är polära, ligger de mittemot varandra och avbryter varandras effekter. Således är koldioxidmolekyler totalt sett icke-polära. Denna brist på polaritet påverkar några av koldioxidens egenskaper. (Till exempel blir koldioxid en gas vid -77 CCG, nästan 200 CGG lägre än den temperatur vid vilken vatten kokar.)
figur 4.5 fysikaliska egenskaper och polaritet

de fysikaliska egenskaperna hos vatten och koldioxid påverkas av deras polariteter.
Konceptgranskningsövningar
-
vad heter avståndet mellan två atomer i en kovalent bindning?
-
vad indikerar elektronegativiteten hos en atom?
-
vilken typ av bindning bildas mellan två atomer om skillnaden i elektronegativiteter är liten? Medium? Stor?
svar
-
bindningslängd
-
elektronegativitet är ett kvalitativt mått på hur mycket en atom lockar elektroner i en kovalent bindning.
-
icke-polär; polär; jonisk
viktiga Takeaways
- kovalenta bindningar mellan olika atomer har olika bindningslängder.
- kovalenta bindningar kan vara polära eller icke-polära, beroende på elektronegativitetsskillnaden mellan de involverade atomerna.
övningar
-
vilket är längre – en C – h-Bindning eller en C–o-bindning? (Se tabell 4.2 ”ungefärliga Obligationslängder för vissa enskilda obligationer”.)
-
vilken är kortare-en Nh-bindning eller en ch–bindning? (Se tabell 4.2 ”ungefärliga Obligationslängder för vissa enskilda obligationer”.)
-
en nanometer är 10-9 m. med hjälp av data i tabell 4.2 ”ungefärliga bindningslängder för vissa Singelbindningar” och Tabell 4.3 ”jämförelse av bindningslängder för enkla och multipla bindningar”, bestäm längden på varje bindning i nanometer.
- en C–o–bindning
- a C=o-bindning
- en H-n-bindning
- en C-C-bindning n-bindning
-
en Ångström (kg) definieras som 10-10 m. med användning av tabell 4.2 ”ungefärliga bindningslängder för vissa enkelbindningar” och tabell 4.3 ”jämförelse av bindningslängder för enkla och multipla bindningar”, bestäm längden på varje bindning i Ångström.
- en C – C-bindning
- en C=C-bindning
- en n-o-bindning
-
se övning 3. Varför är nanometerenheten användbar som en enhet för att uttrycka bindningslängder?
-
se övning 4. Varför är ångströmenheten användbar som en enhet för att uttrycka bindningslängder?
-
använd figur 4.4″ elektronegativiteter av olika element”, bestäm vilken atom i varje par som har högre elektronegativitet.
- h eller C
- O eller Br
- Na eller Rb
- i eller Cl
-
använd figur 4.4 ”elektronegativiteter av olika element”, bestäm vilken atom i varje par som har den lägre elektronegativiteten.
- Mg eller o
- S eller F
- al eller Ga
- O eller I
-
kommer elektronerna att delas lika eller ojämnt över varje kovalent bindning? Om ojämnt, till vilken atom dras elektronerna starkare?
- en C – o-bindning
- en F–f–bindning
- en S–N-bindning
- en I-Cl-bindning
kommer elektronerna att delas lika eller ojämnt över varje kovalent bindning? Om ojämnt, till vilken atom dras elektronerna starkare?
- en C – C-bindning
- en S–Cl–bindning
- en O–H-Bindning
svar
-
en C-o-bindning är längre.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
faktiska bindningslängder är mycket små, så nanometerenheten gör uttrycket av längd lättare att förstå.
-
- C
- Na
- Cl
-
- ojämnt mot o
- lika
- ojämnt mot N
- ojämnt mot Cl
