inlärningsmål
- skriv den kemiska formeln för en enkel jonisk förening.
- känna igen polyatomiska joner i kemiska formler.
Vi har redan stött på några kemiska formler för enkla joniska föreningar. En kemisk formel är en kortfattad lista över elementen i en förening och förhållandena för dessa element. För att bättre förstå vad en kemisk formel betyder måste vi överväga hur en jonförening är konstruerad från dess joner.
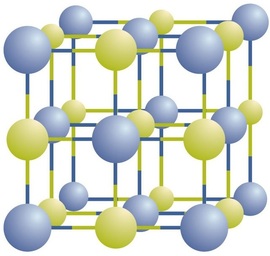
joniska föreningar finns som alternerande positiva och negativa joner i vanliga, tredimensionella arrayer som kallas kristaller (figur \(\PageIndex{1}\)). Som du kan se finns det inga enskilda \(\ce{NaCl}\) ”partiklar” i matrisen; istället finns det en kontinuerlig gitter av alternerande natrium-och kloridjoner. Vi kan emellertid använda förhållandet mellan natriumjoner och kloridjoner, uttryckt i lägsta möjliga heltal, som ett sätt att beskriva föreningen. När det gäller natriumklorid är förhållandet mellan natriumjoner och kloridjoner, uttryckt i lägsta heltal, 1:1, Så vi använder \(\ce{NaCl}\) (en \(\ce{Na}\) symbol och en \(\ce{Cl}\) symbol) för att representera föreningen. Således är \(\ce{NaCl}\) den kemiska formeln för natriumklorid, vilket är ett kortfattat sätt att beskriva det relativa antalet olika joner i föreningen. Ett makroskopiskt prov består av myriader av NaCl-par; varje enskilt par kallas en formelenhet. Även om det är bekvämt att tro att \(\ce{NaCl}\) kristaller består av enskilda \(\ce{NaCl}\) enheter, visar figur \(\PageIndex{1}\) att ingen enskild Jon uteslutande är associerad med någon annan enskild Jon. Varje jon är omgiven av joner med motsatt laddning.
formeln för en jonförening följer flera konventioner. Först skrivs katjonen före anjonen. Eftersom de flesta metaller bildar katjoner och de flesta icke-metaller bildar anjoner, listar formler vanligtvis metallen först och sedan den icke-metall. För det andra skrivs inte avgifter i en formel. Kom ihåg att i en jonförening är komponentarterna joner, inte neutrala atomer, även om formeln inte innehåller laddningar. Slutligen har den korrekta formeln för en jonförening alltid en netto nollladdning, vilket innebär att den totala positiva laddningen måste motsvara den totala negativa laddningen. För att bestämma den korrekta formeln för vilken kombination av joner som helst, bestämma hur många av varje jon som behövs för att balansera de totala positiva och negativa laddningarna i föreningen.
denna regel är i slutändan baserad på det faktum att materien är totalt sett elektriskt neutral.
enligt konvention, anta att det bara finns en atom om ett abonnemang inte finns. Vi använder inte 1 som ett abonnemang.
om vi tittar på den joniska föreningen som består av litiumjoner och bromidjoner ser vi att litiumjonen har en 1+ laddning och bromidjonen har en 1− laddning. Endast en jon av varje behövs för att balansera dessa avgifter. Formeln för litiumbromid är \(\ce{LiBr}\).
när en jonförening bildas av magnesium och syre har magnesiumjonen en 2+ laddning och syreatomen har en 2− laddning. Även om båda dessa joner har högre laddningar än jonerna i litiumbromid, balanserar de fortfarande varandra i ett en-till-ett-förhållande. Därför är den korrekta formeln för denna Joniska förening \(\ce{mgo}\).
nu överväga den joniska föreningen som bildas av magnesium och klor. En magnesiumjon har en 2 + laddning, medan en klorjon har en 1-laddning:
\
att kombinera en jon av varje balanserar inte helt de positiva och negativa laddningarna. Det enklaste sättet att balansera dessa laddningar är att anta närvaron av två kloridjoner för varje magnesiumjon:
\
nu är de positiva och negativa laddningarna balanserade. Vi kan skriva den kemiska formeln för denna Joniska förening som \(\ce{MgClCl}\), men konventionen är att använda ett numeriskt abonnemang när det finns mer än en jon av en given typ—\(\ce{mgcl2}\). Denna kemiska formel säger att det finns en magnesiumjon och två kloridjoner i denna formel. (Läs inte” Cl2 ” – delen av formeln som en molekyl av det diatomiska elementära kloret. Klor existerar inte som ett diatomiskt element i denna förening. Snarare finns det som två individuella kloridjoner.) Enligt konvention används det lägsta heltalsförhållandet i formlerna av joniska föreningar. Formeln \(\ce{Mg2Cl4}\) har balanserade laddningar med jonerna i ett förhållande 1:2, men det är inte det lägsta heltalsförhållandet.
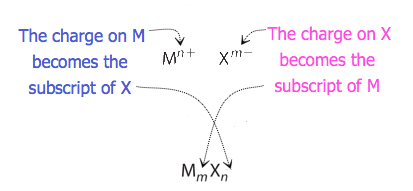
för föreningar där förhållandet mellan joner inte är lika uppenbart kan prenumerationerna i formeln erhållas genom att korsa laddningar: använd det absoluta värdet av laddningen på en jon som prenumerationen för den andra Jonen. Denna metod visas schematiskt i Figur 3.3.2.
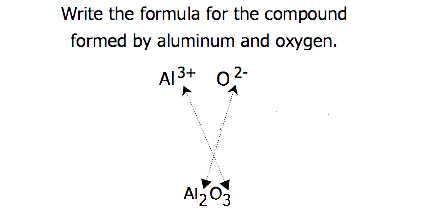
Vid korsning av avgifter är det ibland nödvändigt att minska prenumerationerna till deras enklaste förhållande för att skriva den empiriska formeln. Tänk till exempel föreningen bildad av Pb4+ och O2−. Genom att använda de absoluta värdena för laddningarna på jonerna som Prenumerationer ger formeln Pb2O4. Detta förenklar till sin korrekta empiriska formel PbO2. Den empiriska formeln har en Pb4 + Jon och två O2− joner.
exempel \(\PageIndex{1}\)
skriv den kemiska formeln för en jonförening som består av varje par joner.
- natriumjonen och svaveljonen
- aluminiumjonen och fluoridjonen
- 3+ järnjonen och syrejonen
lösning
- för att erhålla en valensskaloktett bildar natrium en jon med en 1+ laddning, medan svaveljonen har en 2− laddning. Två natrium 1 + joner behövs för att balansera 2-laddningen på svaveljonen. I stället för att skriva formeln som \(\ce{NaNaS}\), förkortar vi den genom konvention till \(\ce{Na2S}\).
- aluminiumjonen har en 3 + laddning, medan fluoridjonen som bildas av fluor har en 1− laddning. Tre fluor 1-joner behövs för att balansera 3 + laddningen på aluminiumjonen. Denna kombination är skriven som \(\ce{AlF3}\).
- järn kan bilda två möjliga joner, men Jonen med en 3+ laddning anges här. Syreatomen har en 2-laddning som en jon. För att balansera de positiva och negativa laddningarna ser vi till den minst vanliga multipeln—6: två järn 3+ joner ger 6+, medan tre 2− syrejoner ger 6− och därigenom balanserar de övergripande positiva och negativa laddningarna. Således är formeln för denna Joniska förening \(\ce{Fe2O3}\). Alternativt kan du använda metoden för korsningsavgifter som visas i Figur 3.3.2.
övning \(\PageIndex{1}\)
skriv den kemiska formeln för en jonförening som består av varje par joner.
- kalciumjonen och syrejonen
- 2 + kopparjonen och svaveljonen
- 1 + kopparjonen och svaveljonen
svar a:
CaO
svar b:
CuS
svar c:
Cu2S
polyatomiska joner
vissa joner består av grupper av atomer kovalent bundna ihop och har en total elektrisk laddning. Eftersom dessa joner innehåller mer än en atom kallas de polyatomiska joner. Lewis-strukturerna, namnen och formlerna för vissa polyatomiska joner finns i tabell 3.3.1.
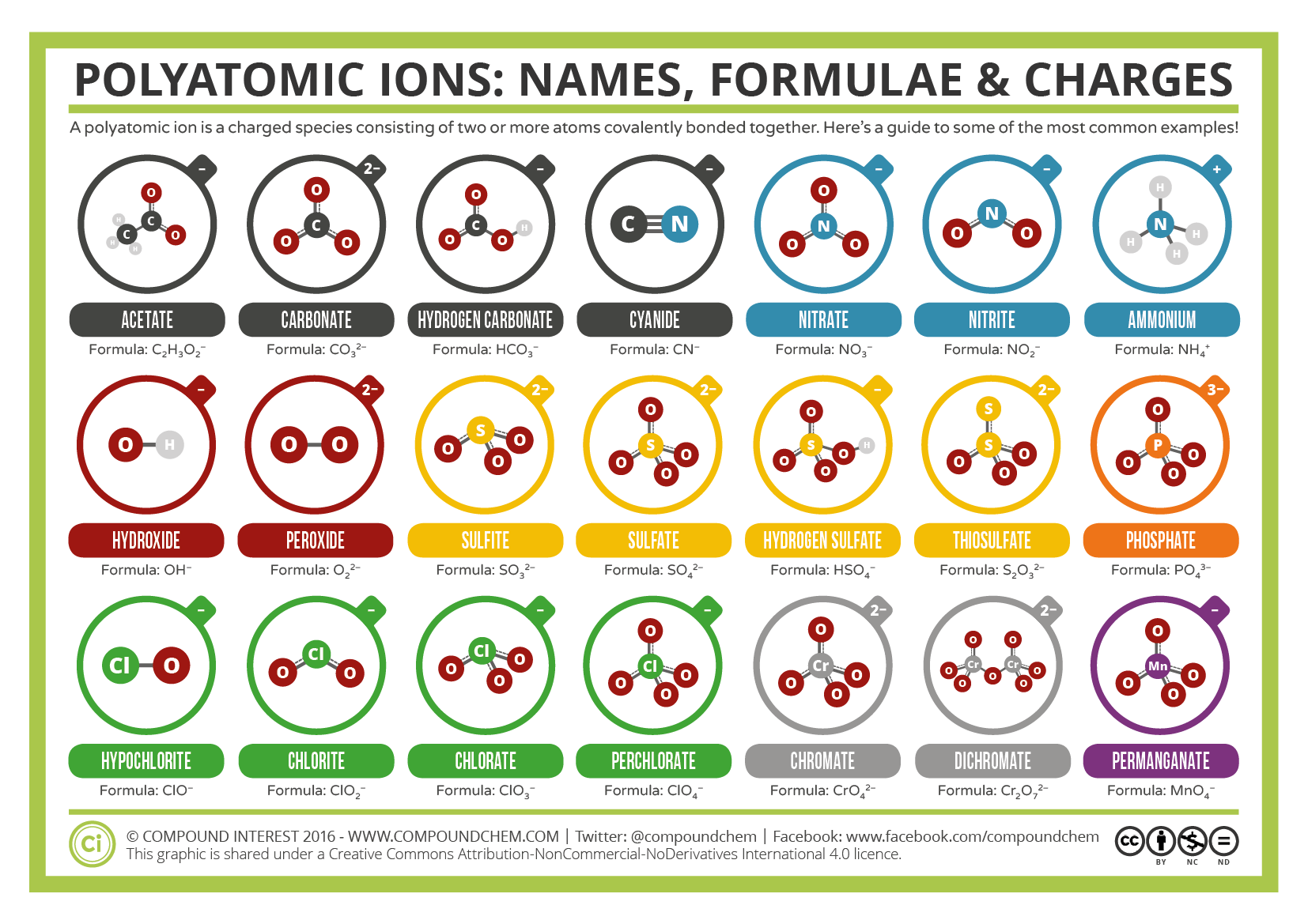
tabell \(\PageIndex{1}\): Vissa polyatomiska joner
polyatomiska joner har definierade formler, namn och laddningar som inte kan ändras på något sätt. Tabell \(\PageIndex{2}\) listar jonnamnen och jonformlerna för de vanligaste polyatomiska jonerna. Till exempel är \(\ce{NO3^{−}}\) nitratjonen; den har en kväveatom och tre syreatomer och en total 1− laddning. Figur \(\PageIndex{2}\) listar de vanligaste polyatomiska jonerna.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. De återstående polyatomiska jonerna är alla negativt laddade och klassificeras därför som anjoner. Emellertid namnges endast två av dessa, hydroxidjonen och cyanidjonen, med hjälp av suffixet ”-ide” som vanligtvis indikerar negativt laddade partiklar. De återstående polyatomiska anjonerna, som alla innehåller syre, i kombination med en annan icke-metall, existerar som en del av en serie där antalet oxygener inom den polyatomiska enheten kan variera. Som har upprepats betonats i flera avsnitt av denna text, inga två kemiska formler bör dela ett gemensamt Kemiskt namn. Ett enda suffix,” – ide”, är otillräckligt för att skilja namnen på anjonerna i en relaterad polyatomisk serie. Därför används suffixerna”- ate” och ”- ite ” för att beteckna att motsvarande polyatomiska joner ingår i en serie. Dessutom indikerar dessa suffixer också det relativa antalet oxygener som finns i de polyatomiska jonerna. Observera att alla polyatomiska joner vars namn slutar i ”-ate” innehåller ett mer syre än de polyatomiska anjonerna vars namn slutar i ”-ite.”Tyvärr, precis som det vanliga systemet för namngivning av övergångsmetaller, indikerar dessa suffixer bara det relativa antalet oxygener som finns i de polyatomiska jonerna. Till exempel har nitratjonen, som symboliseras som NO3−1, ett mer syre än nitritjonen, som symboliseras som NO2−1. Sulfatjonen symboliseras emellertid som SO4-2. Medan både nitratjonen och sulfatjonen delar ett ”-ate” suffix, innehåller den förra tre oxygener, men den senare innehåller fyra. Dessutom innehåller både nitratjonen och sulfitjonen tre oxygener, men dessa polyatomiska joner delar inte ett gemensamt suffix. Tyvärr kräver den relativa naturen hos dessa suffixer att jonformeln / jonnamnkombinationerna av de polyatomiska jonerna helt enkelt måste memoreras.
regeln för att konstruera formler för joniska föreningar som innehåller polyatomiska joner är densamma som för formler som innehåller monatomiska (enatomiska) joner: de positiva och negativa laddningarna måste balansera. Om mer än en av en viss polyatomisk jon behövs för att balansera laddningen måste hela formeln för den polyatomiska Jonen vara innesluten inom parentes och det numeriska prenumerationen placeras utanför parenteserna. Detta för att visa att prenumerationen gäller för hela polyatomjonen. Två exempel visas nedan:

exempel \(\PageIndex{2}\)
skriv den kemiska formeln för en jonförening som består av varje par joner.
- kaliumjonen och sulfatjonen
- kalciumjonen och nitratjonen
lösning
- kaliumjoner har en laddning av 1+, medan sulfatjoner har en laddning av 2−. Vi behöver två kaliumjoner för att balansera laddningen på sulfatjonen, så den korrekta kemiska formeln är \(\ce{K_2SO_4}\).
- kalciumjoner har en laddning av 2+, medan nitratjoner har en laddning av 1−. Vi behöver två nitratjoner för att balansera laddningen på varje kalciumjon. Formeln för nitrat måste bifogas inom parentes. Således skriver vi \(\ce{Ca (NO3)2}\) som formeln för denna Joniska förening.
övning \(\PageIndex{2}\)
skriv den kemiska formeln för en jonförening som består av varje par joner.
- magnesiumjonen och karbonatjonen
- aluminiumjonen och acetatjonen
svar a:
Mg2+ och CO32- = MgCO3
svar b:
Al3+ och C2H3O2- = Al(C2H3O2)3
känna igen joniska föreningar
det finns två sätt att känna igen joniska föreningar. För det första är föreningar mellan metall och icke-metallelement vanligtvis Joniska. Till exempel innehåller CaBr2 ett metalliskt element (kalcium, en grupp 2A-metall) och ett icke-metalliskt element (brom, en grupp 7A-icke-metall). Därför är det troligtvis en jonförening. (Det är faktiskt joniskt.) Däremot innehåller föreningen NO2 två element som är båda icke-metaller (kväve, från grupp 5A och syre, från grupp 6A). Det är inte en jonisk förening; det tillhör kategorin kovalenta föreningar diskutera någon annanstans. Observera också att denna kombination av kväve och syre inte har någon elektrisk laddning specificerad, så det är inte nitritjonen.
För det andra, om du känner igen formeln för en polyatomisk jon i en förening, är föreningen jonisk. Om du till exempel ser formeln \(\ce{ba(NO3)2}\) kan du känna igen ”NO3″−delen som nitratjonen, \(\rm{NO_3^ -}\). (Kom ihåg att konventionen för att skriva formler för joniska föreningar inte ska inkludera jonisk laddning.) Detta är en ledtråd att den andra delen av formeln, \(\ce{Ba}\), faktiskt är \(\ce{Ba^{2+}}\) jon, med 2+ laddning som balanserar den totala 2− laddningen från de två nitratjonerna. Således är denna förening också jonisk.
exempel \(\PageIndex{3}\)
identifiera varje förening som jonisk eller inte jonisk.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
lösning
- natrium är en metall och syre är en icke-metall; därför förväntas \(\ce{Na2O}\) vara jonisk.
- både fosfor och klor är icke-metaller. Därför är \(\ce{PCl3}\) inte jonisk.
- \(\ce{NH4}\) i formeln representerar ammoniumjonen, \(\ce{NH4^ {+}}\), vilket indikerar att denna förening är jonisk.
- både syre och fluor är icke-metaller. Därför är \(\ce{OF2}\) inte jonisk.
övning \(\PageIndex{3}\)
identifiera varje förening som jonisk eller inte jonisk.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce {(NH4)3PO4}\)
- \(\ce{SOCl2}\)
svar a:
inte jonisk
svar b:
jonisk
svar c:
jonisk
svar d:
inte jonisk
titta närmare: blod och havsvatten
vetenskapen har länge insett att blod och havsvatten har liknande kompositioner. När allt kommer omkring har båda vätskorna joniska föreningar upplösta i dem. Likheten kan vara mer än bara en slump, många forskare tror att de första formerna av liv på jorden uppstod i oceanerna. En närmare titt visar dock att blod och havsvatten är helt annorlunda. En 0,9% lösning av natriumklorid approximerar saltkoncentrationen som finns i blod. Däremot är havsvatten huvudsakligen en 3% natriumkloridlösning, över tre gånger koncentrationen i blod. Här är en jämförelse av mängden joner i blod och havsvatten:
| Ion | procent i havsvatten | procent i blod |
|---|---|---|
| na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Denna skillnad är signifikant eftersom vätekarbonatjonen och vissa relaterade joner har en avgörande roll för att kontrollera syrabasegenskaperna hos blod. Mängden vätefosfatjoner – \(\ce{HPO4^{2−}}\) och \(\ce{H2PO4^{—}}\)-i havsvatten är mycket låg, men de finns i högre mängder i blod, där de också påverkar syrabasegenskaper. En annan anmärkningsvärd skillnad är att blod inte har betydande mängder sulfatjon (\(\ce{SO4^{2−}}\)), men denna jon är närvarande i havsvatten.
viktiga Takeaways
- korrekta kemiska formler för joniska föreningar balanserar den totala positiva laddningen med den totala negativa laddningen.
- grupper av atomer med en total laddning, kallad polyatomiska joner, finns också.
övningar
-
vilken information finns i formeln för en jonförening?
-
varför innehåller de kemiska formlerna för vissa joniska föreningar Prenumerationer, medan andra inte gör det?
3. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Mg2+ och i−
- Na+ och O2−
4. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Na + och Br –
- Mg2 + och Br−
- Mg2+ och S2 –
5. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- K + och Cl –
- Mg2 + och Cl−
- Mg2+ och Se2 –
6. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Na+ och N3−
- Mg2+ och N3−
- Al3+ och S2−
7. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Li + och N3 –
- Mg2 + och P3 –
- Li + och P3 –
8. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Fe3 + och Br –
- Fe2 + och Br−
- Au3+ och S2−
- Au+ och S2−
9. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Cr3 + och O2-
- Cr2 + och O2−
- Pb2+ och Cl−
- Pb4+ och Cl−
10. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- Cr3 + och NO3-
- Fe2 + och PO43 –
- Ca2 + och CrO42-
- Al3 + och OH−
11. Skriv den kemiska formeln för den joniska föreningen som bildas av varje par joner.
- NH4 + och NO3 –
- H + och Cr2O72 –
- Cu + och CO32−
- Na+ och HCO3 –
12. För varje par av element bestämmer du laddningen för deras joner och skriver rätt formel för den resulterande jonföreningen mellan dem.
- Ba och S
- Cs och i
13. För varje par av element bestämmer du laddningen för deras joner och skriver rätt formel för den resulterande jonföreningen mellan dem.
- K och S
- Sc och Br
14. Vilka föreningar skulle du förutsäga att vara Joniska?
- Li2O
- (NH4) 2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Vilka föreningar skulle du förutsäga att vara Joniska?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
svar
1. förhållandet mellan varje typ av Jon i föreningen
2. Ibland behövs mer än en jon för att balansera laddningen på den andra Jonen i en jonförening.
- MgI2
- Na2O
- NaBr
- MgBr2
- MGS
- KCl
- mgcl2
- mgse
- na3n
- Mg3n2
- AL2S3
- Li3n
- mg3p2
- li3p
- febr 3
- Feb2
- AU2S3
- au2s
- Cr2O3
- Cro
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- H2cr2o7
- cu2co3
- NaHCO3
- BA2+, S2−, bas
- cs+, i−, CSI
- k+, s2−, K2s
- sc3+, br−, scbr3
- jonisk
- inte jonisk
- jonisk
- inte jonisk
- inte jonisk
- inte jonisk
- inte jonisk
- inte jonisk
- inte jonisk
- inte jonisk
- jonisk
- inte jonisk
- div >
- ionic
inte ionic inte ionic - ionic
inte ionic inte ionic
- ionic
