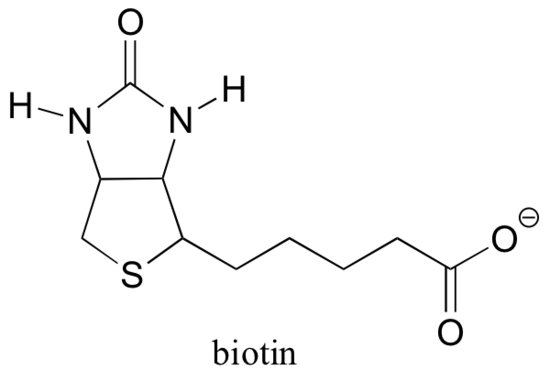
13.5 D: Biotin är ett CO2-bärande koenzym
minns från avsnitt 6.5 B att många enzymer är beroende av hjälp av koenzymer, som är små (i förhållande till protein) organiska molekyler som binder – kovalent eller icke-kovalent – i ett enzym aktiva plats och hjälpa den att katalysera dess reaktion. S-adenosylmetionin (SAM, avsnitt 9.1 a) och ATP (avsnitt 10.2) är två exempel som vi hittills har stött på, och vi kommer att se flera fler i de kommande kapitlen. Även om Rubisco (beskrivs i del B i detta avsnitt) är ett undantag, är de flesta enzymer som katalyserar karboxyleringsreaktioner beroende av ett koenzym som kallas biotin, vilket tjänar som en tillfällig bärare av koldioxid.
Pyruvatkarboxylas, enzymet som katalyserar det första steget i glukoneogenisvägen, är ett bra exempel på en biotinberoende karboxyleringsreaktion. Observera att CO2 i denna reaktion härrör från bikarbonat, till skillnad från Rubisco-reaktionen där CO2 är ’fixerad’ direkt från atmosfären.

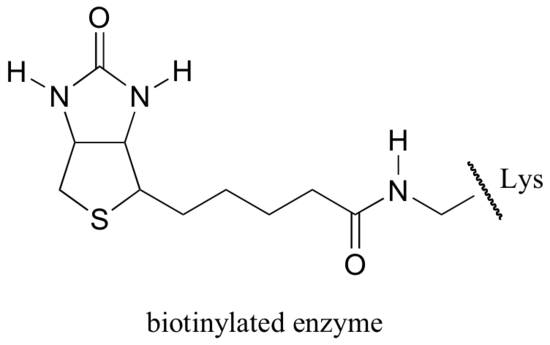
Biotin är kovalent bundet till enzymet genom en amidbindning till en aktiv plats lysin.
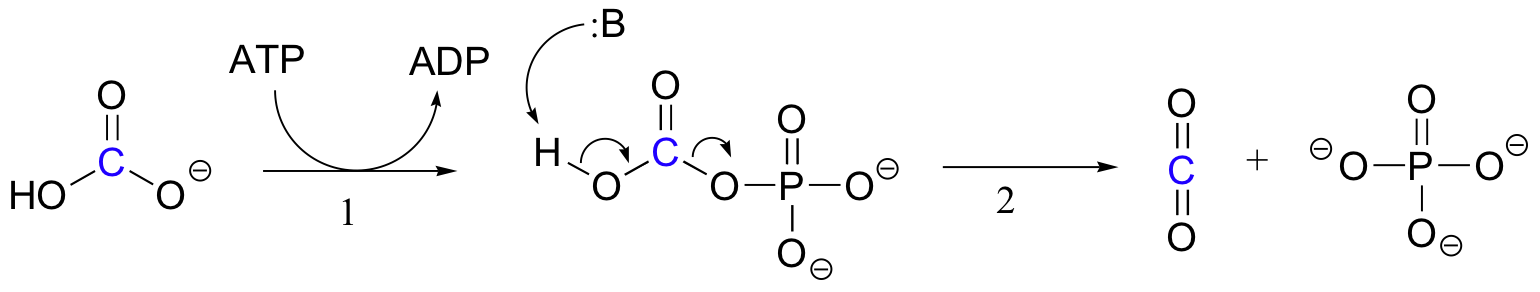
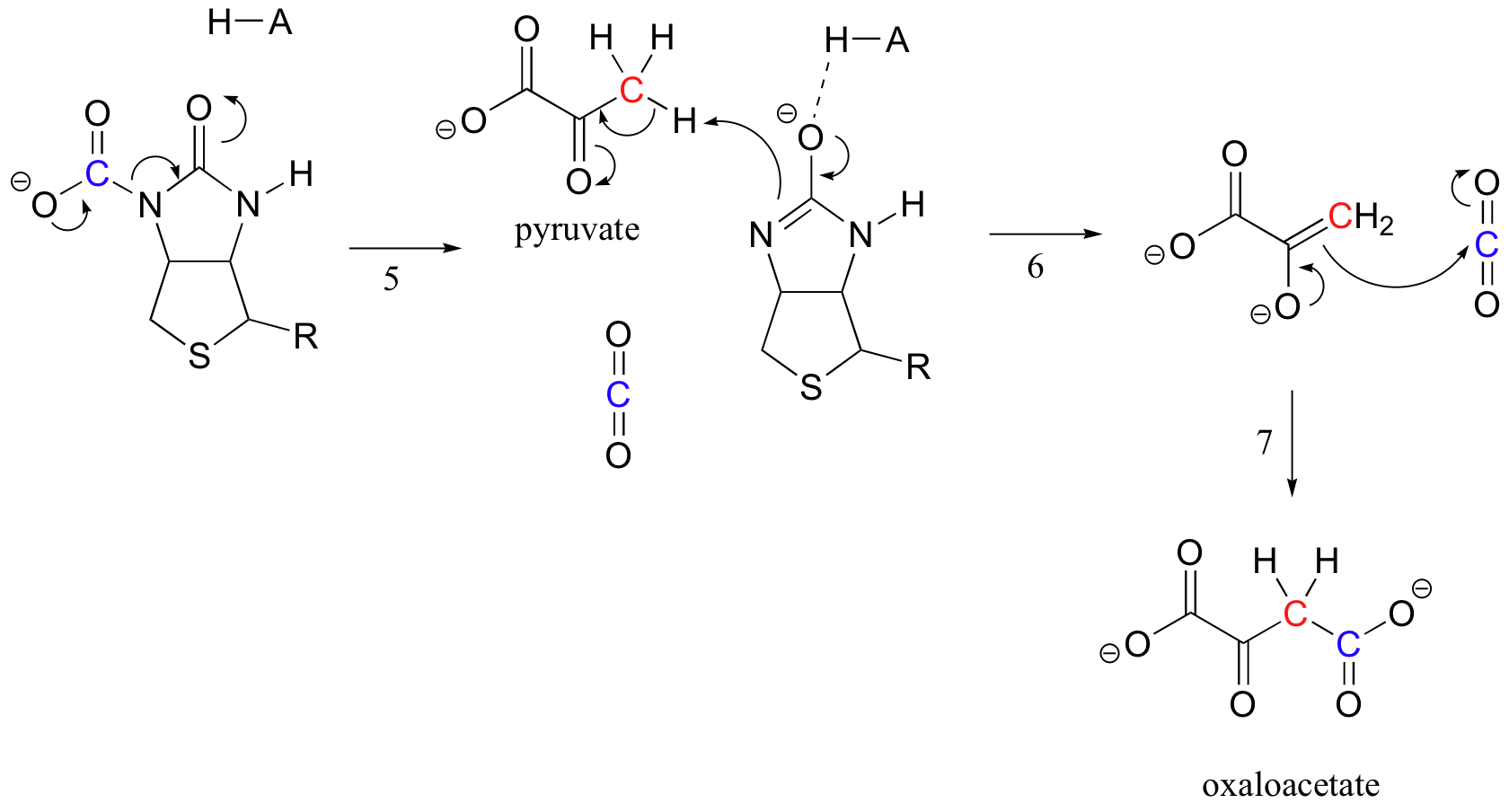
den exakta mekanismen genom vilken biotinberoende karboxyleringsreaktioner fungerar är fortfarande inte fullständigt förstådd, men följande är en sannolik bild. För det första fosforyleras bikarbonatjonen av ATP (steg 1, Se avsnitt 10.2) och aktiveras således för dekarboxylering, vilket genererar fri CO2 (steg 2).
Biotins uppgift är att hålla fast vid koldioxidmolekylen tills pyruvat kommer in i den aktiva platsen. Karboxylering av biotin innefattar deprotonering av amidkvävet för att bilda en enolatliknande mellanprodukt (steg 3-amider har en pKa av ungefär 17, Och detta sänks genom närvaron av en aktiv plats syra nära syret). Detta steg följs av attack av det nukleofila kvävet på koldioxid för att bilda karboxybiotinylerat enzym (steg 4).
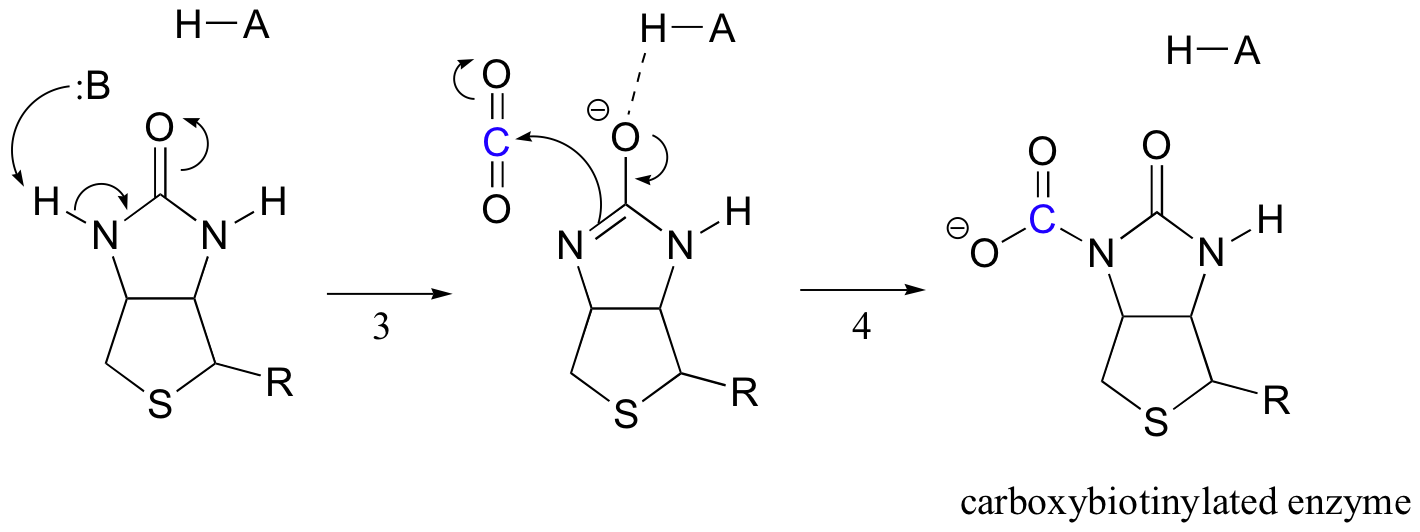
när en pyruvatmolekyl binder, orsakar omläggning av den aktiva platsarkitekturen att föregående steg går i omvänd ordning (steg 5), frigör CO2 och genererar en biotin bas för att deprotonera alfa-kolet i pyruvat så att det kan kondensera, på ett aldolliknande sätt, med CO2 för att bilda oxaloacetat (steg 6-7).
om du har studerat lite biokemi kanske du har hört talas om biotin i ett något annorlunda sammanhang än vad som diskuteras i det här avsnittet. Ett protein som kallas avidin, som finns i överflöd i äggvita, binder icke-kovalent och extremt tätt mot biotin (i själva verket är avidin-biotin det tätaste protein-ligandbindande paret som är känt för vetenskapen). Biokemister använder ofta denna egenskap genom att kovalent länka en biomolekyl av intresse för biotin. De’ biotinylerade ’ arterna kan sedan lätt isoleras från en komplex blandning genom att köra blandningen genom en ’affinitetskolonn’ som är belagd med avidin.
