det finns ett antal sätt på vilka en cell kan flytta från en punkt i rymden till en annan. I ett flytande medium kan den metoden vara någon form av simning, med användning av ciliär eller flagellär rörelse för att driva cellen. På fasta ytor fungerar dessa mekanismer tydligt inte effektivt, och cellen genomgår en krypningsprocess. I det här avsnittet börjar vi med en diskussion om ciliär/flagellär rörelse, och sedan överväga de mer komplicerade kraven på cellulär krypning.
Cilia och flagella, som skiljer sig främst i längd snarare än konstruktion, är mikrotubuli-baserade organeller som rör sig med en fram och tillbaka rörelse. Detta översätts till” rodd ” av den relativt korta cilia, men i den längre flagellen orsakar strukturens flexibilitet att fram och tillbaka rörelsen sprids som en våg, så flagellarrörelsen är mer böljande eller whiplike (tänk på vad som händer när du vaggar en trädgårdsslang snabbt från sida till sida jämfört med en kort bit av samma slang). Kärnan i endera strukturen kallas axonemet, som består av 9 mikrotubuli-dubbletter kopplade till varandra av ciliära dyneinmotorproteiner och omger en central kärna av två separata mikrotubuli.
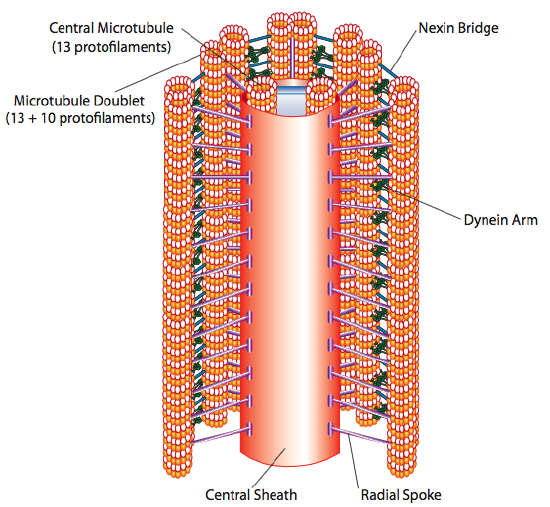
detta kallas” 9+2 ” – formationen, även om de nio dubbletterna inte är desamma som de två centrala mikrotubuli. A-tubulen är en full 13-protofilament, Men B-tubulen smält till den innehåller endast 10 protofilament. Var och en av de centrala mikrotubuli är en full 13 protofilament. 9 + 2 axoneme förlänger längden på cilium eller flagellum från spetsen tills den når basen och ansluter till cellkroppen genom en basal kropp, som består av 9 mikrotubuli tripletter ordna i en kort fat, ungefär som centriolerna från vilka de härrör.
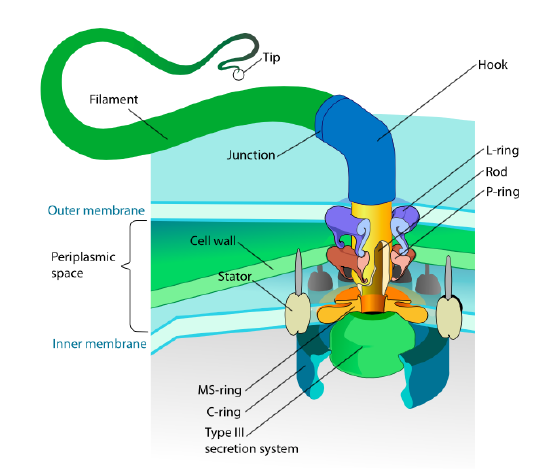
detta avsnitt avser endast eukaryoter. Vissa prokaryoter har också rörliga bilagor som kallas flagella, men de är helt olika i både struktur och mekanism. Flagella själva är långa spiralformiga polymerer av proteinet flagellin, och basen av flagellinfibrerna är ansluten till ett rotationsmotorprotein, inte en translationell motor. Denna motor (figur \(\PageIndex{18}\)) använder Jon (H+ eller Na+ beroende på Art) ner en elektrokemisk gradient för att ge energi att rotera så många som 100000 varv per minut. Man tror att rotationen drivs av konformationsförändringar i statorringen, inbäddat i cellmembranet.
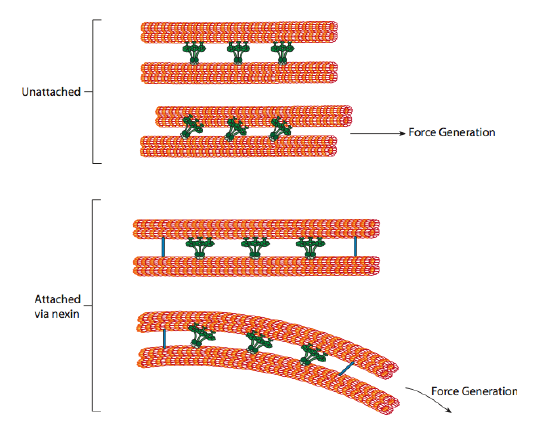
ciliary dyneins ger motorförmågan, men det finns också två andra länkproteiner i axonemet. Det finns nexiner som förenar A-tubulen i en dubblett till B-tubulen i dess intilliggande dubblett och därmed förbinder den yttre ringen. Och det finns radiella ekrar som sträcker sig från A-tubulen i varje dubblett till det centrala paret av mikrotubuli i axonemets kärna. Ingen av dessa har någon motorisk aktivitet. De är dock avgörande för rörelsen av cilia och flagella eftersom de hjälper till att omvandla en glidande rörelse till en böjningsrörelse. När ciliary dynein (mycket lik cytoplasmiska dyneiner men har tre huvuden istället för två) är förlovat, binder den en a-mikrotubuli på ena sidan, en B-mikrotubuli från den intilliggande dubbletten och flyttar en i förhållande till den andra. En linje av dessa dyneiner som rör sig i samförstånd skulle således glida en dubblett i förhållande till den andra, om (och det är en stor ”om”) de två dubbletterna hade fullständig rörelsefrihet. Men eftersom dubbletterna är sammankopplade av nexin-proteinerna, vad som händer när en dubblett försöker glida är att den böjer den anslutna strukturen istället (figur \(\PageIndex{17}\)). Denna böjning står för roddrörelsen hos cilia, som är relativt korta, liksom den långa flagellens piskningsrörelse, som sprider böjningsrörelsen nerför axonemet.
Även om vi tänker på ciliär och flagellär rörelse som metoder för framdrivning av en cell, såsom flagellär simning av spermier mot ett ägg, finns det också ett antal viktiga platser där cellen är stillastående och cilia används för att flytta vätska förbi cellen. Faktum är att det finns celler med cilia i de flesta större organ i kroppen. Flera ciliary dyskinesier har rapporterats, varav den mest framträdande, primära ciliary dyskinesi (PCD), som inkluderar Kartagener syndrom (KS), beror på mutation av DNAI1-genen, som kodar för en subenhet (mellanliggande kedja 1) av axonemal (ciliary) dynein. PCD kännetecknas av andningsbesvär på grund av återkommande infektion, och diagnosen KS ställs om det också finns situs inversus, ett tillstånd där kroppens normala vänster-höger asymmetri (t.ex. Mage till vänster, lever till höger) vänds. Det första symptomet beror på inaktivitet hos de många cilia av epitelceller i lungorna. Deras normala funktion är att hålla slem i andningsvägarna ständigt i rörelse. Normalt hjälper slemet till att hålla lungorna fuktiga för att underlätta funktionen, men om slemet blir stillastående blir det en grogrund för bakterier, liksom att bli ett irriterande och hinder för korrekt gasutbyte.
Situs inversus är en intressant missbildning eftersom den uppstår vid embryonal utveckling och påverkar endast 50% av PCD-patienterna eftersom den försämrade ciliärfunktionen orsakar randomisering av vänster-höger asymmetri, inte reversering. I mycket enkla termer, under tidig embryonal utveckling, beror vänster-höger asymmetri delvis på rörelsen av molekylära signaler i ett vänsteröde genom den embryonala noden. Detta flöde orsakas av koordinerad slagning av cilia, så när de inte fungerar störs flödet och randomisering sker.
andra symtom på PCD-patienter pekar också på arbetet med cilia och flagella i kroppen. Manlig infertilitet är vanligt på grund av immotila spermier. Kvinnlig infertilitet, men mindre vanligt, kan också uppstå, på grund av dysfunktion av cilia i äggledaren och äggledaren som normalt flyttar ägget från äggstocken till livmodern. Intressant finns det också en låg förening av hydrocephalus internus (överfyllning av hjärnans ventrikel med cerebrospinalvätska, vilket orsakar deras utvidgning som komprimerar hjärnvävnaden runt dem) med PCD. Detta beror troligen på dysfunktion av cilia i ependymala celler som fodrar ventriklarna, och som hjälper till att cirkulera CSF, men är uppenbarligen inte helt nödvändiga. Eftersom CSF-bulkflöde tros drivas främst av systole / diastolförändringen i blodtrycket i hjärnan, antar vissa att cilia kan vara involverad främst i ow genom några av de stramare kanalerna i hjärnan.
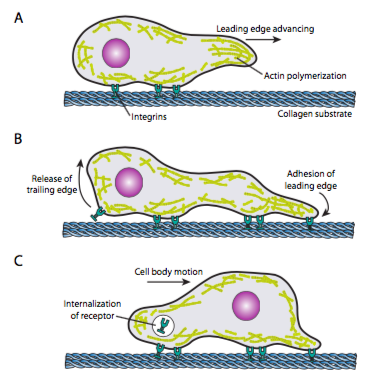
cellkrypning (figur \(\PageIndex{19}\)) kräver en samordnad omläggning av det främre mikrofilamentnätverket, som sträcker sig (genom både polymerisation och glidande filament) och sedan bildar vidhäftningar vid den nya punkten framåt. Detta kan ha formen av filopodia eller lamellipodia,och ofta båda samtidigt. Filopodia är långa och mycket tunna utsprång med kärnbuntar av parallella mikrofilament och höga koncentrationer av cellytreceptorer. Deras syfte är främst att känna av miljön. Lamellipodia sträcker sig ofta mellan två lopodier och är mer av en bred ruffle än ett finger. Internt bildar aktinet mer i maskor än buntar, och den bredare kanten möjliggör att fler vidhäftningar görs till substratet. Mikrofilamentnätverket omarrangeras sedan igen, den här gången öppnar ett utrymme i cytoplasman som fungerar som en kanal för rörelsen av mikrotubuli mot cellens framsida. Detta sätter transportnätet på plats för att hjälpa till att flytta intracellulärt bulkmaterial framåt. När detta inträffar frigörs de gamla vidhäftningarna på cellens svansände. Denna frisättning kan ske genom två primära mekanismer: endocytos av receptorn eller deaktivering av receptorn genom signalering/konformationsförändring. Naturligtvis motsäger denna förenkling komplexiteten i att samordna och kontrollera alla dessa åtgärder för att åstadkomma riktad rörelse av en cell.
en modell av mikrofilamentkraftgenerering, den elastiska Brownska Spärrmodellen (Mogilner och Oster, 1996), föreslår att på grund av brunisk rörelse av cellmembranet som härrör från kontinuerlig minut termisk fluktuation böjs aktinfilamenten som skjuter ut mot membranets kanter i varierande grad. Om flexen är tillräckligt stor kan en ny aktinmonomer passa in mellan membranet och filamentets spets, och när det nu längre filamentet böjer sig tillbaka kan det utöva ett större tryck på membranet. Uppenbarligen genererar ett enda filament inte mycket kraft, men den samordnade förlängningen av många filament kan driva membranet framåt.
När en cell får en signal att röra sig, är det initiala cytoskeletala svaret att polymerisera aktin, bygga fler mikrofilament för att införliva i framkanten. Beroende på signalen (attraktiv eller repulsiv) kan polymerisationen uppträda på samma eller motsatta sida av cellen från signalreceptoraktiveringspunkten. Signifikant kan polymerisationen av ny f-aktin ensam generera tillräcklig kraft för att flytta membranet framåt, även utan involvering av myosinmotorer! Modeller av kraftgenerering diskuteras, men börjar i allmänhet med införlivandet av nytt g-aktin i ett filament vid dess spets; det vill säga vid filament-membrangränssnittet. Även om det tekniskt kan vara tillräckligt, i en levande cell, är myosiner involverade och hjälper till att driva och ordna filament i riktning för att ställa in den nya framkanten. Dessutom måste vissa filament och nätverk snabbt avskiljas och nya anslutningar göras, både mellan filament och mellan filament och andra proteiner såsom vidhäftningsmolekyler eller mikrotubuli.
hur kontrolleras polymerisationen och aktinomläggningen? Receptorerna som signalerar cellrörelse kan initiera något olika vägar, men många delar vissa gemensamma drag för att aktivera en eller flera medlemmar av Ras-familjen av små Gtpaser. Dessa signalmolekyler, såsom Rac, Rho och cdc42 kan aktiveras av receptortyrosinkinaser (se RTK-Ras aktiveringsvägar, Kap. 14). Var och en av dessa har en något annorlunda roll i cellmotilitet: cdc42-aktivering leder till filopodibildning, Rac aktiverar en väg som inkluderar Arp2/3 och cofilin till lamellipodibildning, och Rho aktiverar myosin II för att kontrollera fokal vidhäftning och stressfiberbildning. En annan typ av receptorkaskad, g-proteinsignalkaskaden (även kapitel 14), kan leda till aktivering av PLC och efterföljande klyvning av PIP2 och ökning av cytosolisk Ca2+. Dessa förändringar, som nämnts tidigare, kan också aktivera myosin II, liksom ombyggnadsenzymerna gelsolin, cofilin och profilin. Detta bryter ner befintliga aktinstrukturer för att göra cellen mer flytande, samtidigt som den bidrar med mer g-aktin för att bilda det nya ledande cytoskelettet.
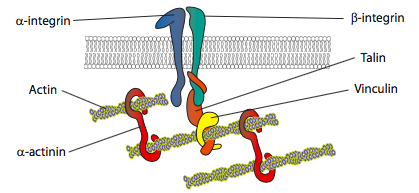
in vitro-experiment visar att när membranet skjuter framåt görs nya limkontakter genom vidhäftningsmolekyler eller receptorer som binder substratet (ofta cellodlingsglas eller rätter är belagda med kollagen, filaminin eller andra extracellulära matrisproteiner). Kontakterna rekryterar sedan cytoskeletala element för större stabilitet för att bilda en fokal vidhäftning (figur \(\PageIndex{20}\)). Bildandet av fokala vidhäftningar verkar emellertid vara en artefakt av cellodling, och det är oklart om de typer av vidhäftningar som bildas in vivo rekryterar samma typer av cytoskeletala komponenter.
det tredje steget till cellrörelse är massrörelsen av cellinnehållet framåt. Mekanismerna för denna fas är oklara, men det finns vissa bevis för att med hjälp av kopplingar mellan aktincytoskelettet vid framkanten och framåt delar av mikrotubuli cytoskelettet ordnas mikrotubuli om för att bilda en effektiv transportväg för bulkrörelse. En annan aspekt på detta kan vara en ”corralling” – effekt av actin-nätverken, som i riktning öppnar upp utrymme mot framkanten. Mikrotubuli kommer sedan in i det utrymmet lättare än att arbeta genom ett tätt aktinnät, vilket tvingar flödet i rätt riktning.
mycket av arbetet med mikrotubuli-aktininteraktioner i cellmotilitet har gjorts genom forskning om neuronal tillväxtkon, som ibland kallas en cell i koppel, eftersom den verkar nästan oberoende som en krypande cell och söker efter rätt väg för att leda sin axon från cellkroppen till sin korrekta synaptiska anslutning (Aw Schaefer et al, dev. Cell 15: 146-62, 2008).
slutligen måste cellen ångra sina gamla vidhäftningar på bakkanten. Detta kan hända på ett antal olika sätt. In vitro har krypningsceller observerats rippa sig av substratet och lämna bakom små bitar av membran och associerade vidhäftningsproteiner i processen. Den genererade kraften antas komma från aktin-myosin-stressfibrer som leder från de mer framåtriktade vidhäftningarna. Det finns emellertid mindre destruktiva mekanismer tillgängliga för cellerna. I vissa fall kan vidhäftningen hos den cellulära receptorn för det extracellulära substratet regleras internt, kanske genom fosforylering eller defosforylering av en receptor. En annan möjlighet är endocytos av receptorn och tar bort den från cellytan. Det kan helt enkelt återvinna upp till framkanten där det behövs (dvs transcytos), eller om det inte längre behövs eller skadas kan det brytas ner i en lysosom.
