introducerea inhibitorului ciclului celular
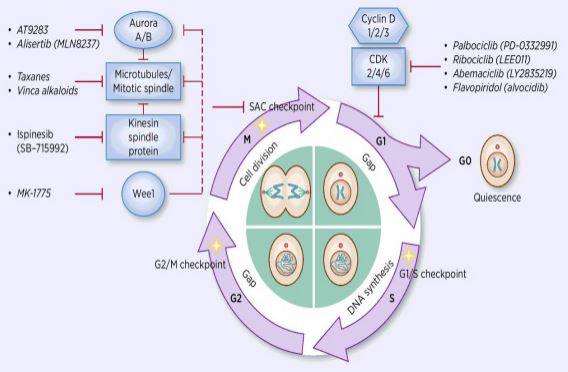
procesul de reglare a ciclului celular este activarea sau inactivarea diferiților factori de reglementare sub supravegherea punctelor de control, inițiind astfel procesul de replicare și divizare a ADN-ului celular în două celule fiice. Printre mulți regulatori ai ciclului celular, kinaza dependentă de ciclină (CDK) este la bază și este un sistem de rețea care reglează ciclul celular cu inhibitori de ciclină și kinază dependentă de ciclină (CKIs). CDK-urile sunt o clasă de serină/treonin kinaze și, în prezent, se găsesc 13 specii, inclusiv CDK1~13, care joacă un rol în reglarea ciclului celular a CDK-urilor și reglarea transcripțională a CDK-urilor. Reglarea ciclului celular este, de fapt, reglarea punctelor de control, punctele de reglementare G1/S fiind cele mai importante. Când ciclul celular este stimulat de semnale externe, cum ar fi factorii de creștere, subunitatea catalitică CDK4/CDK6 se leagă de subunitatea reglatoare Ciclind, iar reziduurile CDKs sunt activate prin fosforilare/defosforilare. După activarea CDKs, proteina Rb este fosforilată. Gena rb, cunoscută și sub numele de gena retinoblastomului, este prima genă supresoare tumorală clonată, iar capacitatea sa de a forma un complex cu factori de transcripție (cum ar fi E2F) după fosforilarea proteinei se pierde. E2F joacă un rol important în reglarea ciclului celular și induce expresia Ciclinei și CDK2 și formează un complex ciclină/CDK2, care fosforilează în continuare proteina Rb și eliberează complet E2F. ulterior, E2F intră în nucleu pentru a activa o serie de cicluri celulare în faza S. În faza târzie a replicării ADN-ului în timpul fazei S, CDK2 este activat de ciclină, care inactivează factorul de transcripție E2F în timp, prevenind apoptoza cauzată de E2F activat persistent. statisticile de cercetare arată că mai mult de 90% din cancerele umane au mutații în genele înrudite în căile CDK, ciclină, CKI și Rb, CDK și subunitatea sa de reglementare corespunzătoare ciclină fiind cel mai frecvent disfuncționale. În plus, fluctuațiile ciclului celular promovează rezistența la chimioterapie și reduc efectele chimioterapiei. Prin urmare, reglarea activității CDK/ciclină, care restabilește ciclul celular normal, este una dintre strategiile de tratare a tumorilor.
inhibitorii ciclului celular sunt acum utilizați clinic
cercetătorii de droguri s-au concentrat pe găsirea diferitelor tipuri de inhibitori CDK și ciclină ca medicamente anti-cancer de ultimă oră. În prezent, inhibitorii CDK sunt împărțiți în principal în endogeni și exogeni. Cea mai mare clasă de inhibitori endogeni ai moleculelor mici este proteinele cu greutate moleculară mică, care sunt clasificate în două mari categorii în funcție de diferențele dintre funcțiile structurale, iar o clasă se numește familia specifică duală Ink4, inclusiv p15, p16, p18, p19, care inhibă familia de proteine. Proteina dependentă de inhibitor a kinazei asociate Ciclindei se leagă de CDK4 liber corespunzător, blocând astfel legarea CDK4 de ciclindul corespunzător pentru a forma un complex dimer catalitic. Cealaltă clasă se numește familia Kip, inclusiv P21,P27, P57. Această familie de proteine poate forma un trimer cu un complex dimeric compus din ciclina e/CDK2 și ciclina/CDK1, prin blocarea centrului catalitic activ al dimerului. Inhibarea acestor inhibitori endogeni, atunci când este combinată cu complexul kinazei, reglează în mod specific activitatea sa, reglând astfel cu precizie transformarea celulei de la faza G1 la S. Studiile au arătat că apariția și dezvoltarea tumorilor multiple sunt asociate cu scăderea expresiei CDKs/cicline sau scăderea expresiei inhibitorilor endogeni, cum ar fi ștergerea P16, care are legătură cu dezvoltarea melanomului, a cancerului pulmonar, a cancerului de sân și a cancerului colorectal. Eliminarea proteinei P27 este frecventă în cancerul de sân, cancerul de prostată, cancerul de colon și cancerul gastro-intestinal. Prin urmare, eliminarea inhibitorului CDKs endogen sau a mutației genetice este o referință importantă pentru diagnosticul tumorii. Inhibitorii endogeni ai moleculelor mici sunt, de asemenea, o clasă de ARN-uri importante necodificatoare descoperite în ultimii ani. Regiunile site-ului țintă se leagă între ele pentru a degrada rapid și eficient ARNm sau pentru a inhiba traducerea proteinei, controlând proteina la un nivel inferior sau optim și necesitând activități de viață. Mai mult de 10 microARN-uri au fost descoperite implicate în reglarea ciclului celular. Dintre acestea, miR1-2 și miR3-4 vizează CDK4, respectiv, iar ciclul celular este arestat în faza G1, care inhibă proliferarea celulelor tumorale; mir-22 vizează celulele CDK6. Ciclul este stagnant în faza G1, care induce senescența în celulele cancerului de sân. În diferite procese biologice, aceste miARN reglează progresia ciclului celular prin direcționarea E2F, CDK, ciclină, P21, P27, ADN polimerază alfa etc. pentru a promova sau bloca regulatorii cheie ai ciclului celular. Inhibitorii exogeni includ acizi nucleici antisens, anticorpi, interferențe mici de interferență ARN (siARN) și compuși cu molecule mici. Compușii cu molecule mici sunt cea mai importantă clasă de inhibitori CDK exogeni. În ultimii ani, deoarece înțelegerea structurii cristaline permite oamenilor să efectueze studii de simulare moleculară, s-au făcut progrese în proiectarea și dezvoltarea unor studii extrem de eficiente și selective asupra inhibitorilor chimici ai CDK. Se poate spune că astfel de compuși au membri noi în fiecare zi. În prezent, inhibitorii CDK cu molecule mici pot fi împărțiți în următoarele 13 categorii, Roscovitină și Olomouc, pirimidine (PD-033299), flavonoide (Flavopiridoli), Tiazoli (SNS03), antracen și derivații săi (SU951), piperidonă (Paullone), imidazopiridină, pirazolopiridină (AZ703), pirazine ( AT751), Butirolactonă-1 (Butirolactonă-1), scorpionină (UCN-01) și alte două specii. Treisprezece inhibitori de molecule mici au intrat în studii clinice. Toate sunt substanțe chimice cu molecule mici ale heterociclurilor plane care concurează cu ATP pentru legarea la situl de legare ATP al CDK kinazei. Experimentele in vivo au arătat că CYC202 are o bună rezistență la medicamente și o bună activitate fiziologică orală și are efecte inhibitoare evidente asupra tumorilor solide la șoarecii nud inoculați de cancerul de colon uman și celulele canceroase uterine. În studiile de fază Ib, 10 pacienți cu cancer ovarian au luat CYC mai mult de 20 de luni, fără o creștere a tumorilor sau efecte secundare severe legate de tratament, printre care tumora unui pacient s-a micșorat cu mai mult de 30%, iar unii pacienți care au fost tratați mai mult de un an au o stare stabilă. Studiile clinice de fază II au descoperit că CYC202 singur are un efect ușor mai slab și este eficient în combinație cu alte medicamente chimioterapeutice. De asemenea, sunt în curs studii clinice de fază IIb cu CYC202 în asociere cu capecitabină pentru tratamentul cancerului de sân, combinate cu 2,2-difluorodeoxicitidină sau cisplatină pentru tratamentul cancerului pulmonar și carcinomului nazofaringian. Dezvoltarea și aplicarea tehnologiei de interferență a ARN-ului cu molecule mici au făcut posibilă studierea expresiei genetice a moleculelor țintă specifice de intervenție și mulți oameni de știință au început să intervină în sinteza CDK/Ciclinei la nivel genetic. Limaet al. transfectat ciclina-direcționarea siRNA în Hep3B, HepG2, SNU449 (supraexprimarea Ciclinei) și HuH7 (supraexprimarea Ciclinei) și a constatat că expresia Ciclinei a fost redusă cu 90% în celule. Sinteza ADN este redusă semnificativ, iar celulele suferă apoptoză. Galimberti și colab. siARN transfectat care vizează ciclina, CDK2 și CDK1 în celulele cancerului pulmonar de șoarece HOP-62, H-522 și respectiv H-23 și a constatat că ciclina/CDK2 poate induce apoptoza și poate inhiba proliferarea celulelor canceroase pulmonare. Scăderea expresiei CDK1 cauzată de interferența CDK1 siRNA provoacă doar oprirea fazei celulare și încetinește proliferarea celulelor; în timp ce cdk1 și CDK2 cointervenția siRNA duce la o scădere simultană a expresiei CDK1 și CDK2, provocând rezistență în fazele ciclului celular s și G2/M. Stagnarea a indus și apoptoza celulelor. Cao Yinfang și alte transfecții reușite ale vectorului de Expresie recombinant cdk2/ciclină siRNA în celulele HepG2 au arătat că expresia ARNm CDK2 și ciclină a scăzut semnificativ, ciclul celular a fost arestat în faza S, celulele de fază G1 au crescut semnificativ, activitatea caspazei-3 îmbunătățită, celulele HepG2 au suferit apoptoză, iar modificările ciclului celular au fost în concordanță cu proliferarea scăzută a celulelor Hepg2in vitro după transfecție.
funcția inhibitorului ciclului celular
odată cu aprofundarea înțelegerii rolului important al reglării ciclului celular în formarea tumorii și apoptoză, reglarea ciclului celular a fost studiată în continuare în rezistența la chimioterapie tumorală. Kinazele dependente de ciclină (CDK), care joacă un rol în conducerea motorului celular în timpul ciclului celular, sunt ținte ideale pentru terapia tumorală. Majoritatea celulelor canceroase au activare, supraexpresie a genei ciclului de diviziune celulară (cdk) și defecte ale funcției CDKIs. Inhibitorul CDK exercită o acțiune de rupere care inhibă ciclul celular. În ultimii ani, CDKIs au devenit un punct culminant major al terapiei cancerului, care inhibă activitatea CDK-urilor în ciclul celular. O serie de studii clinice au arătat, de asemenea, că o singură aplicare poate avea efecte moderate. Cu toate acestea, în combinație cu medicamentele chimioterapeutice citotoxice tradiționale, CDKIs poate spori semnificativ efectul antitumoral al medicamentelor chimioterapeutice tradiționale. Prin urmare, cercetările privind efectele anticanceroase ale medicamentelor CDKIs și ale altor medicamente chimioterapeutice au devenit un punct fierbinte în tratamentul actual al rezistenței tumorale.
referință
- Bendris n, Lemmers B, Blanchard J M. ciclul celular, dinamica citoscheletului și nu numai: numeroasele funcții ale ciclinelor și inhibitorilor CDK. Ciclul Celular. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, și colab. Direcționarea kinazelor nucleare în cancer: dezvoltarea inhibitorilor kinazei ciclului celular. Farmacologie & terapeutică. 2014, 142(2):258-269.
- Stone a, Sutherland R L, Musgrove E A. inhibitori ai kinazelor ciclului celular: progrese recente și perspective viitoare ca terapie pentru cancer. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. reglarea ciclului celular și melanomul. Rapoarte Oncologice Actuale. 2016, 18(6):34.
- Malumbres M, Barbacid M. ciclul celular, CDKs și cancer: o paradigmă în schimbare. Natura Revizuiește Cancerul. 2009, 9(3):153-166.
