mesaj Urgent: când un pacient relativ tânăr se prezintă la îngrijiri urgente cu dureri în piept, poate exista sau nu o cauză „tipică”. Evaluarea promptă și evaluarea corectă a factorilor de risc sunt esențiale pentru îngrijirea eficientă și, adesea, pentru supraviețuirea pacientului.
Max Palatnik, MD
prezentare de caz
un bărbat în vârstă de 35 de ani a prezentat la 21: 59 cu o plângere șef de dureri în piept; la 22:03, am observat următoarele:
Temp: 98.9
puls: 103
Resp: 16
Syst: 122
Diast: 69
O2Sat: 99%
istoria bolii prezente (22:47) (textual)
pt. Bărbat în vârstă de 38 de ani cu un PMH de miocardită și pericardită în 1983 și 1991, care a mâncat cina la 6:30 și a început să simtă presiune pe pieptul anterior în timp ce se uita la televizor la 7:30 PM. – m-am simțit ca „unii stăteau pe pieptul meu”. Asociat suspin și radiații în umăr și mâna stângă „furnicături”. A avut arsuri la stomac, dar acest lucru s-a simțit diferit. A luat bicarbonat de sodiu (pe care îl ia în mod normal pentru arsurile la stomac) și acest lucru nu a ajutat. Fără sincopă, greață, vărsături, febră, durere RUQ sau antecedente de intoleranțe alimentare. El a avut unele simptome virale în urmă cu 2 săptămâni (tuse neproductivă, sinus HA și PND care s-a rezolvat.) Fără ortopnee, PND, relația durerii cu exercițiile fizice, traumatisme toracice, componentă pleuritică
antecedente medicale/Triaj
medicamente, alergii comune: niciuna
PMH: miocardită/pericardită
PSH: niciuna
Sochx: nefumător
FamHx: pozitiv pentru CAD cu frate de 52 de ani cu MI, tată CABG la 53
examen (22:52)
General: bine apărut; bine hrănit; în nici o primejdie aparentă.
Cap: Normocefalic; atraumatic.
ochi: PERLA; EOM intact
ENT: TM normal; nas normal; fără rinoree; gâtul este roșu și exudate ușoare.. Membrane mucoase umede.
gât: suplu; nontender; fără limfadenopatie cervicală. Nu există semne meningeale
cardiovasculare: Normal S1, S2; fără murmure, freacă sau galop. Nu există sensibilitate reproductibilă a peretelui toracic
respirator: excursie normală în piept cu respirație; respirația sună clar și egal bilateral; fără respirație, rhonchi sau rales.
Abdomen: sunete intestinale normale; non-distins; nontender; fără organomegalie palpabilă.
extremități: ROM Normal în toate cele patru extremități; nontender la palpare; pulsurile distale sunt normale și egale.
piele: Normal pentru vârstă și rasă; cald; uscat; turgor bun; fără leziuni aparente sau exudat
note de progres (23:12)
el a primit 2 aspirină pentru copii și SL NTG cu ameliorarea disconfortului toracic. Apoi a pus 1 inch de Nitropaste. La 00:44 durerea i-a revenit și ECG-ul i s-a repetat. El a fost dat 15mg Maalox fără ameliorare, apoi inch mai mult NTP, care a făcut scuti disconfort.EKG 1: turtit undele T inferioare și în V2-V6.
EKG 2: Nici o modificare
Labs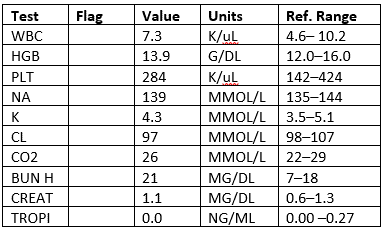
CXR: negativ
diagnostic (01:57)
dureri în piept, antecedente de miocardita
dispoziție (02:02)
pacientul a fost internat la spital sub telemetrie.
curs de spital
pt. a suferit enzime seriale și repetați ECG dimineața. El a exclus pentru MI și a fost eliberat. Un ecou de stres ulterior a fost negativ după exerciții fizice timp de 12,5 minute, fără disconfort toracic sau modificări ECG.
A doua vizită
- pacientul a urmat PCP, a fost diagnosticat cu GERD și a fost început pe un IPP.
- pacientul a revenit la ED 6 săptămâni mai târziu cu senzație de constricție toracică și dispnee în stabilirea unei mese. Simptomele sale au fost agravate de efort, apar în repaus și sunt îmbunătățite prin poziționarea verticală, precum și cu Prilosec.
- fără febră asociată, tuse, radiații, diaforeză, dureri de vițel, edem periferic.
- pacientul are semne vitale normale, cu o examinare neremarcabilă și adecvată.EKG dezvăluie TWI în aVL, precum și noi unde q în modificările V1-V2 și NSST.
- CXR este negativ.
- laboratoarele arată o troponină care este>de 20 de ori limita superioară a normalului.
- pacientul primește aspirină, heparină, Plavix, nitroglicerină și este admis pentru sindromul coronarian acut.
- pacientul suferă o intervenție coronariană percutanată (PCI) cu plasarea cu succes a stentului și este ulterior evacuat în stare bună.
discuție
durerea toracică este plângerea care prezintă mai mult de 5% dintre pacienții din departamentele de urgență (EDs) din Statele Unite. Evaluarea pacientului cu durere toracică este o provocare extraordinară, în mare parte datorită diagnosticului diferențial larg, dar și din cauza riscului asociat cu diagnosticul greșit. Printre cele mai rapide afecțiuni fatale din medicina de urgență—dintre care multe pot prezenta inițial îngrijiri urgente—se numără sindromul coronarian acut (ischemie miocardică și infarct), disecția aortică, embolie pulmonară, pericardită cu tamponadă cardiacă, miocardită, pneumotorax de tensiune și ruptură esofagiană. Toate aceste condiții tind să se manifeste cu dureri în piept și toate ar trebui luate în considerare la începutul evaluării pacientului cu dureri în piept.
este responsabilitatea medicului de a evalua acești pacienți cu lista potențialelor amenințări de viață în partea de sus a diagnosticului diferențial. Un istoric detaliat, un examen fizic (cu accent pe examinările cardiace, pulmonare și vasculare) și informații de testare de bază (de exemplu, electrocardiogramă, radiografie toracică) pot adesea exclude rapid aceste amenințări de viață cu o precizie rezonabilă. Cu toate acestea, în cazurile în care această evaluare rapidă inițială nu reușește să excludă unul dintre diagnosticele mortale, poate fi justificată o examinare suplimentară într-un cadru cu acuitate mai mare.
deși simptomele tipice ale ACS sunt descrise ca un debut treptat al durerii dureroase sau de presiune în piept cu radiații la brațul stâng, gât sau maxilar, într-adevăr atipicul poate fi mai „tipic.”Într-o sinteză mare de date, cele mai utile caracteristici istorice care au crescut probabilitatea de infarct miocardic acut au fost radiațiile la brațul sau umărul drept, radiațiile la ambele brațe, durerea care s-a agravat cu efort, diaforeză și greață sau vărsături.1 anumite subseturi, inclusiv femeile, diabeticii și vârstnicii, sunt mai susceptibile de a avea simptome anginoase care sunt reprezentate de dispnee, vărsături, diaforeză, slăbiciune generalizată; unele pot avea prezentări nedureroase.2 chiar și la acei pacienți cu simptome atipice, cum ar fi durerea pleuritică sau sensibilitatea palpabilă în peretele toracic, probabilitatea posttest este suficient de scăzută doar la cei care au deja un risc scăzut.1 enumerarea factorului istoric de risc cardiac sarcina are o valoare prognostică redusă, în special la pacienții cu vârsta peste 40 de ani.3
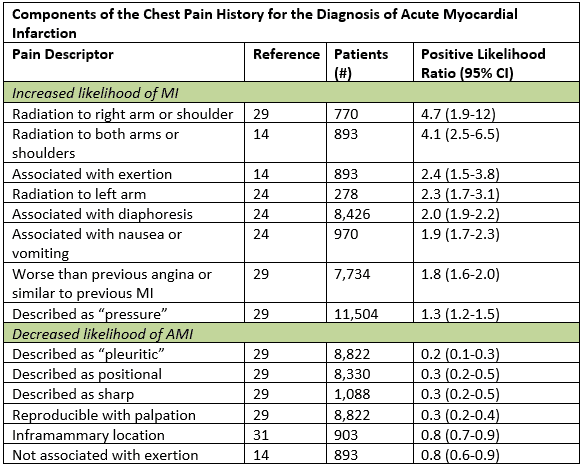
adaptat de la Swap CJ, și colab. JAMA. 2005;294:2623-2629.
pacienții tineri (<45 de ani) reprezintă un grup cu risc crescut de diagnostic greșit al SCA, în primul rând din cauza tendinței medicilor de a subestima riscul cardiac. Până la 10% din infarcturile miocardice din SUA apar la pacienții <cu vârsta de 45 de ani, majoritatea fiind legate de boala cardiacă aterosclerotică. Boala aterosclerotică a fost observată la 17% dintre adolescenți într-un studiu,4 și boala multivessel observată la 20% dintre adulții tineri (vârsta medie: 26 de ani) într-un studiu de autopsie a victimelor violenței din interiorul orașului.5 un studiu recent de ED a constatat că 5,4% dintre pacienții cu vârsta de 24 de ani, de 39 de ani, care prezintă dureri toracice, au condus la ACS, iar 2,2% au avut un eveniment cardiac advers (de exemplu, deces, im, nevoie de intervenție coronariană percutanată sau chirurgie de bypass cardiac) în decurs de 30 de zile.6 deși incidența generală a SCA este mai mică la pacienții tineri, medicii nu ar trebui să reducă a în ceea ce privește IPH pe baza vârstei pacientului.
diabetul zaharat (DM) reprezintă o altă afecțiune cu risc ridicat în ceea ce privește potențialul de diagnostic greșit al ACS. Pacienții cu DM sunt predispuși la prezentări nedureroase atunci când au ischemie cardiacă. Prezentările atipice (de exemplu, dispnee, confuzie, vărsături, oboseală) apar în până la 40% din cazuri. Pacienții diabetici sunt, de asemenea, mai susceptibili de a avea rezultate adverse din ACS.7 prin urmare, medicii curanți nu trebuie să se bazeze pe prezentarea plângerilor tipice pentru a iniția o examinare cardiacă la pacienții diabetici și nici nu trebuie să se bazeze pe biomarkeri cardiaci pozitivi pentru a determina o abordare agresivă a tratamentului la acești pacienți.
consumul de cocaină trebuie considerat un factor de risc suplimentar independent pentru boala cardiacă aterosclerotică și IM, în special la pacienții tineri. Unii autori estimează că cocaina reprezintă până la 25% din MIs acută la pacienții <45 de ani.7 Utilizarea acută a cocainei poate induce vasoconstricție coronariană, agregare plachetară crescută și/sau stimulare adrenergică care duce la disritmii și ischemie. Utilizarea cronică a cocainei este asociată și cu MI, provocând aterogeneză semnificativ accelerată și IM precoce ulterioară. În general, consumatorii de cocaină au un risc crescut de șapte ori mai mare de IM.8
lupusul eritematos sistemic (les) este un factor de risc semnificativ, dar subapreciat, pentru ateroscleroza precoce și infarctul miocardic. Se estimează că pacienții tineri cu LES prezintă un risc de nouă ori mai mare de IM precoce.9 femei <45 de ani, în special, prezintă un risc crescut, cu estimări ale riscului crescut de IM precoce de până la cincizeci de ori.10 cauza aterosclerozei premature în LES este probabil multifactorială, dar în mare parte legată de inflamația sistemică coexistentă și dislipidemiile.
infecția cu virusul imunodeficienței umane (HIV) a fost identificată și ca un factor de risc independent pentru ateroscleroza prematură. Dovezile sugerează că infecția cu HIV provoacă leziuni endoteliale vaselor coronare, inițiind o cascadă inflamatorie care duce la leziuni aterosclerotice.11 constatarea aterosclerozei premature este deosebit de proeminentă la pacienții cu stadii ulterioare ale infecției cu HIV (numărul CD4 <200).12 regimurile de medicamente care sunt utilizate în prezent în tratarea HIV (inhibitori de protează) exacerbează, de asemenea, riscul de ateroscleroză precoce. În general, pacienții cu HIV cu ACS sunt prezenți la o vârstă cu peste 10 ani mai mică decât pacienții non-HIV.13
boala renală cronică (CRD) a fost, de asemenea, recent identificată ca un factor de risc independent pentru ateroscleroza accelerată. CRD este asociat cu inflamația cronică14 și creșterea agregării plachetare.15 acești factori, combinați cu o prevalență crescută a factorilor de risc convenționali concomitenți, produc un risc disproporționat de mare de evenimente cardiace la acești pacienți.14
deși trebuie obținut și evaluat în decurs de 10 minute de la prezentare în ceea ce privește ischemia cardiacă, ECG nu trebuie utilizat pentru a exclude SCA. Până la 50% dintre pacienții cu ischemie cardiacă sau infarct vor avea un ECG nespecific sau normal.16 ECG-uri seriale pot crește randamentul diagnostic la confirmarea prezenței ACS la pacienții cu simptome în curs de desfășurare.la fel ca ECG, biomarkerii cardiaci sunt utili atunci când sunt pozitivi, dar au o utilitate limitată atunci când sunt normali. Testarea biomarkerilor seriali pe parcursul a 3 ore de la 6 ore a devenit un protocol de rutină în multe EDs și are o sensibilitate excelentă la detectarea dovezilor de MI. Cu toate acestea, biomarkerii nu pot fi invocați pentru a exclude ischemia cardiacă. Validarea prospectivă a scorului” HEART ” a oferit practicienilor capacitatea de a diferenția în mod fiabil un subset de pacienți cu risc scăzut, care probabil nu ar beneficia de teste suplimentare.17
testarea stresului și angiografia coronariană sunt utilizate mai frecvent la începutul evaluării pacienților cu dureri toracice pentru a se pronunța în ACS. Deși un test de stres negativ sau angiogramă este asociat cu un risc mai mic de CAD subiacent, niciunul dintre teste nu poate exclude definitiv ACS sau prezența trombozelor coronariene subiacente semnificative. Majoritatea modalităților de testare a stresului detectează dovezi ale leziunilor coronariene semnificative cu doar 85% până la 95% sensibilități.18-19 angiografia coronariană este, de asemenea, un test imperfect; interpretările fals negative ale angiografiei nu sunt neobișnuite în prezența bolii difuze, a plăcilor excentrice, a ocluziilor „flush”, a leziunilor ostiale ramificate, a ramurilor laterale suprapuse și chiar și atunci când leziunile sunt prezente în artera coronară principală stângă.20 în plus, compromiterea fiabilității acestor teste sunt date care indică faptul că majoritatea MIs apar din ocluzii în interiorul arterelor care au fost anterior <50% obstrucționate înainte de apariția infarctului.21-23
aceste tipuri de leziuni sunt de obicei asociate cu teste de stres negative sau angiograme „nesemnificative” dacă testele sunt efectuate înainte de infarct. Prin natura lor de a detecta stenoza coronariană fixă, testele de stres nu sunt în măsură să evalueze sau să prezică plăcile coronare vulnerabile care sunt expuse riscului de a fi dislocate, ducând la un eveniment coronarian acut. Într-un studiu al pacienților evaluați pentru SCA care au avut un test de stres negativ în ultimii 3 ani, Peste 20% au atins indicele compozit al IMA, test de stres pozitiv, CABG sau cateterism cu intervenție, marea majoritate a testelor negative având loc în decurs de 1 an de la prezentare.24 în mod similar, la teste și mai invazive, bărbații și femeile cu CAD normal sau „minim” la cateterism cardiac (1,2% și, respectiv, 3,3%) au avut fie AMI, fie deces în decurs de 1 an de la urmărire.25 este vital ca clinicianul să nu se bazeze pe teste obiective prealabile în fața unui pacient cu semne și simptome care indică SCA.
rezumat
evaluarea durerii toracice și a posibilelor SCA este un efort cu risc ridicat. Decizia de a urmări o „lucrare cardiacă completă” ar trebui să se bazeze în primul rând pe un HPI amănunțit. Medicii trebuie să fie conștienți de frecvența prezentărilor atipice, în special la femei, vârstnici și pacienți diabetici. Pacienții tineri merită, de asemenea, o atenție specială, deoarece riscul lor este adesea subapreciat. Factorii suplimentari de risc cardiac netradiționali, inclusiv cocaina, lupusul eritematos sistemic, virusul imunodeficienței umane și boala renală cronică necesită o atenție suplimentară. Testarea diagnosticului constă în electrocardiografie (utilă pentru a se pronunța în ACS, dar nu pentru a exclude diagnosticul) și testarea biomarker cardiac, care sunt, de asemenea, utile în primul rând atunci când sunt pozitive. Important, testul de stres negativ sau angiograma este foarte util la stratificarea pacienților la un risc scăzut de ACS și CAD, dar nu exclud definitiv diagnosticul.
citare: Palatnik M. Un bărbat de 38 de ani cu dureri în piept. J Urgent Care Med. Martie 2018. Disponibil la: https://www.jucm.com/a-38-year-old-man-with-chest-pain/.
- Swap CJ, Nagurney JT. Valoarea și limitările istoricului durerii toracice în evaluarea pacienților cu sindroame coronariene acute suspectate. JAMA. 2005;294:2623-2629.
- El-Menyar a, Zubaid M, Sulaiman K. prezentarea atipică a sindromului coronarian acut: un predictor independent semnificativ al mortalității în spital. J Cardiol. 2011;57;165-171.
- Han JH, Lindsell CJ, Storrow AB și colab. Rolul sarcinii factorului de risc cardiac în diagnosticarea sindroamelor coronariene acute în cadrul Departamentului de urgență. Ann Emerg Med. 2007;49;145-152.
- Tuzcu EM, Kapadia SR, Tutar E, și colab. Prevalența ridicată a aterosclerozei coronariene la adolescenți asimptomatici și adulți tineri: dovezi din ultrasunetele intravasculare. Circulație. 2001;103:2705-2710.
- Joseph a, Ackerman D, Talley JD, și colab. Manifestări ale aterosclerozei coronariene la tinerii victime ale traumei—un studiu de autopsie. J Sunt Coll Cardiol. 1993;222:459-467.
- Marsan RJ Jr., aparat de ras KJ, Sease KL, și colab. Evaluarea unei reguli de decizie clinică pentru pacienții adulți tineri cu dureri toracice. Acad Emerg Med. 2005;12:26-32.
- Fergus TS, Fazel R, Fang J, și colab. Prezentarea, managementul și rezultatele pacienților diabetici comparativ cu pacienții non-diabetici admiși pentru sindroame coronariene acute. Inima. 2004;90:1051-1052.
- Qureshi AI, Suri MF, Guterman LR și colab. Consumul de cocaină și probabilitatea infarctului miocardic non-fatal și a accidentului vascular cerebral: date din cel de-al treilea sondaj național de sănătate și nutriție. Circulație. 2001;103:502-506.
- D ‘ Agate DJ, Kokolis S, Belilos E, și colab. Boala arterială coronariană prematură în lupusul eritematos sistemic cu reocluzie extinsă după operația de bypass coronarian. J Cardiol Invaziv. 2003;15:157-163.
- Manzi S, Meilahn EN, Rairie JE și colab. Ratele de incidență specifice vârstei infarctului miocardic și anginei la femeile cu lupus eritematos sistemic: comparație cu studiul Framingham. Sunt J Epidemiol. 1997;145:408-415.
- Varriale P, Saravi G, Hernandez E, și colab. Infarct miocardic acut la pacienții infectați cu virusul imunodeficienței umane. Am Heart J. 2004; 147: 55-59.
- Hsue PY, Lo JC, Franklin a, și colab. Progresia aterosclerozei, evaluată prin grosimea intimei-mediei carotide la pacienții cu infecție cu HIV. Circulație. 2004;109:1603-1608.
- Hsue PY, Giri K, Erickson S, și colab. Caracteristicile clinice ale sindroamelor coronariene acute la pacienții cu infecție cu virusul imunodeficienței umane. Circulație. 2004;109:316-319.
- Yerkey MW, Kernis SJ, Franklin BA, și colab. Disfuncția renală și accelerarea bolii coronariene. Inima. 2004;90:961-966.
- Aggarwal A, Kabbani SS, Rimmer JM, și colab. Efectele bifazice ale hemodializei asupra reactivității plachetare la pacienții cu boală renală în stadiu final: un potențial contribuitor la riscul cardiovascular. Am J Rinichi Dis. 2002;40:315-322.
- Brady WJ, Aufderheide TP, Chan T, și colab. Diagnosticul electrocardiografic al infarctului miocardic acut. Emerg Med Clin Nord Am. 2001;19:295-320.
- Backus BE, șase AJ, Kelder JC, și colab. O validare prospectivă a scorului cardiac pentru pacienții cu dureri toracice la Departamentul de urgență. Int J Cardiologie. 2013;168;2153-2158.
- Ioannidis JPA, Salem D, Chew PW și colab. Precizia tehnologiilor imagistice în diagnosticul ischemiei cardiace acute în departamentul de urgență: o meta-analiză. Ann Emerg Med. 2001;37:471-477.
- Lateef F, Gibler WB. Teste provocatoare pentru dureri în piept. Sunt J Emerg Med. 2000;18:793-801.
- Schwartz L, Gourassa MG. Evaluarea pacienților cu dureri toracice și angiograme coronariene normale. Arch Int Med. 2001;161:1825-1833.
- Giroud D, Li JM, Urban P, și colab. Relația locului infarctului miocardic acut cu cea mai severă stenoză arterială coronariană la angiografia anterioară. Sunt J Cardiol. 1992;69:729-732.
- Hackett D, Davies G, Maseri A. stenozele coronariene preexistente la pacienții cu primul infarct miocardic nu sunt neapărat severe. Eur Inima J. 1988; 9:1317-23.
- Hackett D, Verwilghen J, Davies G, și colab. Stenoza coronariană înainte și după infarctul miocardic acut. Sunt J Cardiol. 1989;63:1517-1518.
- Walker J, Galuska M, Vega D. boala coronariană la pacienții cu dureri toracice de urgență cu teste de stres negative recente. West J Emerg Med. 2010;11;384-388.
- Hemingway H, McCallum A, Shipley M, și colab. JAMA 2006; 295; 1404-1411.
