scurtă descriere a două tipuri de moarte celulară programată: apoptoza și autofagia
apoptoza sau moartea celulară programată de tip I este cea mai studiată dintre formele de moarte celulară. Caracteristicile sale morfologice pot fi identificate prin microscopie luminoasă și includ contracția celulară, compactarea cromatinei, blebbingul membranei citoplasmatice și, în final, formarea corpurilor apoptotice (Figura 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
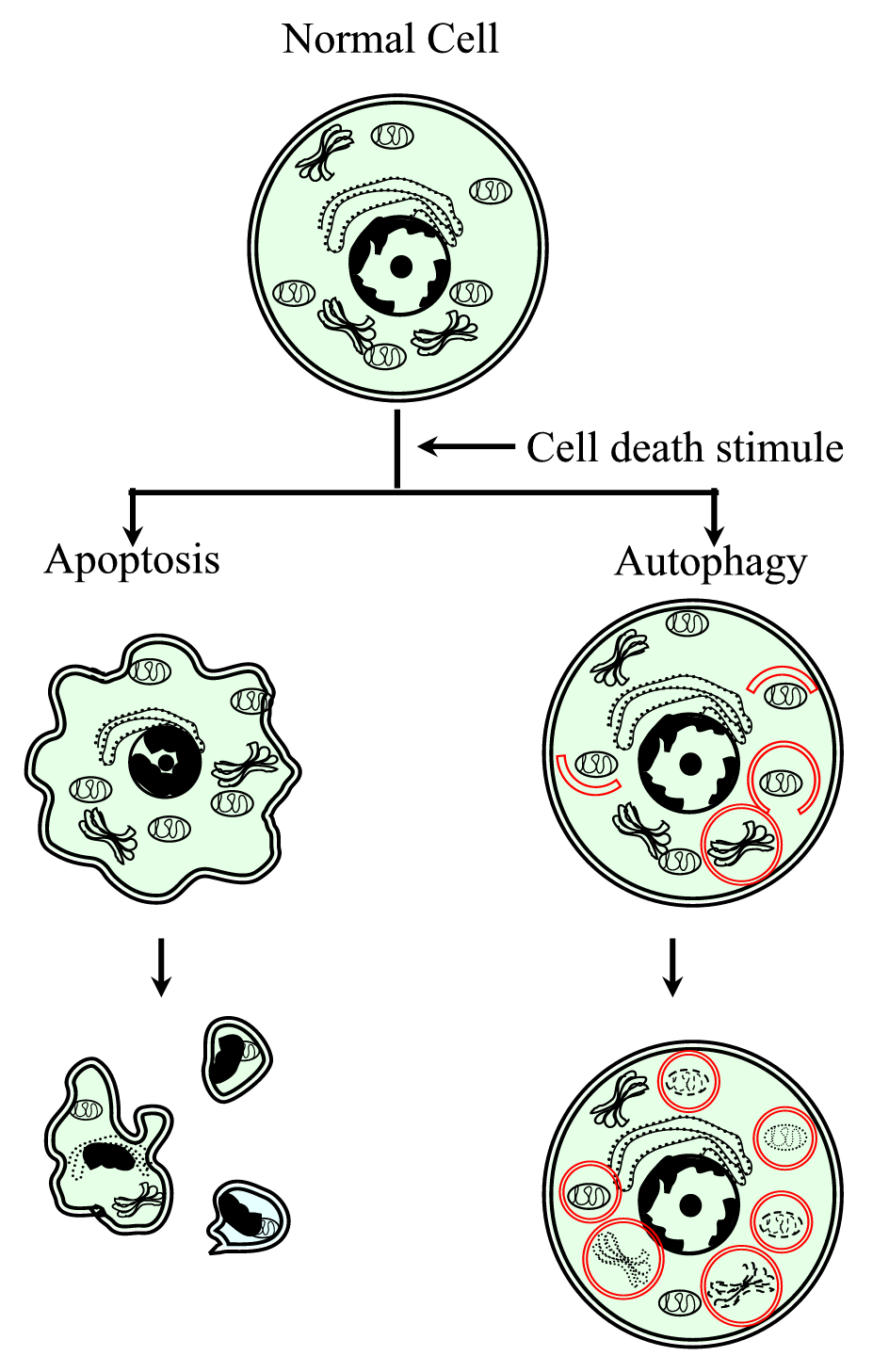
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceReprezentarea schematică a procesului de moarte celulară programată tip I (apoptoză) și tip II (autofagie). Apoptoza se caracterizează printr-o contracție celulară, compactarea cromatinei, blebele membranoase și formarea corpurilor apoptotice. Autofagia se caracterizează prin prezența unui număr mare de autofagozomi cu conținut citoplasmatic. Ambele tipuri de moarte celulară nu generează un răspuns inflamator, deoarece membrana citoplasmatică este conservată până când resturile celulare sunt eliminate prin vecinătate sau prin cele specializate.
caspazele sunt proteaze specifice cisteinil-aspartatului care sunt sintetizate într-o formă inactivă ca chimogeni numiți pro-caspaze (Figura 2). Această formă inactivă permite executarea controlată a procesului de moarte celulară. Caspazele au fost identificate pentru prima dată în nematodul ceanorhabditis elegans, dar formele omoloage sunt prezente la mamifere .
semnele distinctive ale apoptozei, cum ar fi fragmentarea ADN-ului și cromatina compactată, rezultă din activitatea caspazei. În timpul apoptozei, ADN-ul este fragmentat în dimensiunea nucleozomilor (200 bp) . Factorul responsabil pentru fragmentarea ADN-ului în timpul apoptozei este o Dnază specifică (CAD, dnază activată de caspază) care este activată de caspaza activă-3 . Caspaza activă-3, la rândul său, este implicată în modificările morfologice ale celulelor în timpul apoptozei, unde scindează kinaza-1 asociată rho (roca-1) pentru a o activa și aceasta, în cele din urmă, afectează aranjamentul citoscheletal provocând morfologia contracției apoptotice .

Figura 2.
xmlns:xlink= „http://www.w3.org/1999/xlink ” xmlns:MML=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancecaspazele implicate în procesul apoptotic sunt sintetizate într-o formă inactivă ca zimogeni, sunt constituite dintr-un pro-domeniu, o subunitate mare și o subunitate mică. Chimogenii sunt activați formând tetrameri.
moartea celulelor apoptotice este foarte reglementată de membrii familiei limfomului cu celule B 2 (Bcl-2). Membrii familiei Bcl-2 au fost clasificați ca proteine anti-apoptotice și pro-apoptotice în funcție de omologia lor Bcl-2 (BH) și organizarea domeniului (Figura 3). Prezența domeniilor BH1, BH2, BH3 și BH4 corespunde grupului care inhibă apoptoza. Grupul pro-apoptotic, în schimb, este împărțit în două grupuri: cele cu domenii BH1, BH2 și BH3 și cele cu doar domeniile BH3 (definite doar ca BH3; vezi recenzia din ). Această familie de proteine își îndeplinește funcțiile la nivel intracelular în interiorul mitocondriilor, un element cheie în apoptoză.

Figura 3.
xmlns:xlink=”http://www.w3.org/1999/xlink ” xmlns: mml=” http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceproteine din familia limfomului cu celule B 2 (Bcl-2). A) schematizarea generală a structurii proteinelor Bcl-2. B) membrii anti-apoptotici – posedă toate cele patru domenii BH. C) membrii pro-apoptotici care la rândul lor sunt împărțiți în două grupuri: numai multidomain și BH3.
apoptoza poate fi inițiată prin două căi bine descrise: căile extrinseci și intrinseci (Figura 4). Activarea extrinsecă se realizează prin participarea liganzilor de moarte (cum ar fi factorul de necroză tumorală – TNF – superfamilie, și liganzii induși de apoptoză legați de TNF sau TRAIL) cu receptorii lor de moarte de suprafață celulară înrudită (cum ar fi receptorul TNF 1, Fas, receptorul TRAIL 1 sau receptorul TRAIL 2) (revizuit în ). Odată ce ligandul recunoaște și se leagă de receptorul său, se formează o serie de complexe intracelulare pentru a activa caspazele inițiatoare (cum ar fi -8 și -10), care apoi activează caspazele călăului (cum ar fi -3, -6 și -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Interacțiunea ligand-receptor induce asamblarea complexului de semnalizare care induce moartea (DISC) pentru a promova activarea caspazei-8, care la rândul său este capabilă să activeze la executorul caspazei -3, -6 sau -7, conducând la modificările morfologice ale apoptozei. Calea intrinsecă este direcționată de permeabilizarea membranei exterioare mitocondriale, care permite eliberarea elementelor pro-apoptotice ca citocrom-C. citocromul-C induce factorul 1 de activare a proteazei de apoptoză (Apaf-1) pentru a promova activarea caspazei-9 pentru asamblarea apoptozomului. Apoptozomul este capabil să activeze caspazele executorului.
calea apoptotică intrinsecă, în schimb, poate fi activată de diverși stimuli, inclusiv deteriorarea ADN-ului, înfometarea factorului de creștere și stresul oxidativ . În timpul expunerii celulelor la acești stimuli, mitocondriile sunt afectate, deoarece mai mulți membri ai familiei Bcl-2 sunt activați și promovează permeabilizarea membranei exterioare a mitocondriilor (MOMP). Membrana mitocondrială externă permeată permite eliberarea citocromului c (cyt c), care este asociat cu proteina Apaf-1. Uniunea cyt c și Apaf-1 se leagă apoi de inițiatorul caspaza-9 pentru a forma complexul care constituie apoptozomul, care are capacitatea de a activa caspazele inițiatoare care își îndeplinesc funcțiile prin scindarea substraturilor celulare specifice.al doilea proces de moarte celulară, autofagia, este un proces programat genetic și conservat evolutiv care produce degradarea organitelor și proteinelor învechite. Este activat de astfel de stimuli extracelulari, cum ar fi înfometarea nutrienților, hipoxia, temperatura ridicată și condițiile intracelulare modificate, inclusiv acumularea de organite deteriorate sau inutile (revizuite în ).
în organismele eucariote, au fost descrise trei tipuri de autofagie: microautofagie, macroautofagie (denumită în mod obișnuit simplu autofagie) și autofagie mediată de chaperone (Figura 5). Microautofagia implică înghițirea componentelor citoplasmatice direct la nivelul lizozomului prin intermediul unui proces de invaginare, în timp ce macroautofagia implică formarea veziculelor cu membrană dublă care conțin componente celulare, care se fuzionează cu lizozomii pentru a forma un autofagolizozom. În interiorul autofagolizozomului, componentele intra-veziculare sunt degradate și, dacă este posibil, reciclate de celulă (revizuite în ). Autofagia mediată de Chaperone, în cele din urmă, implică participarea chaperonelor la recunoașterea proteinelor desemnate pentru eliminare de către lizozomi .

Figura 5.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instance reprezentări schematice ale diferitelor mecanisme ale autofagiei. Macroautofagia-autofagia-implică formarea unei vezicule cu membrană dublă, care înghite conținutul citoplasmatic care va fi condus la lizozomul care urmează să fie degradat. Microautofagia se caracterizează prin înghițirea directă a componentelor citoplasmatice de către lizozom. Acest proces implică remodelarea membranei organelle prin formarea unei invaginări a membranei lizozomale. În timpul autofagiei mediate de chaperone, proteinele care trebuie degradate sunt vizate pentru un Hsp70, care la rândul său transportă încărcătura țintă către lizozom.
Autofagia este direcționată de genele Atg(legate de autofagie), care sunt necesare pentru a activa complexul de semnalizare care declanșează formarea autofagozomilor . Atgenii au fost descoperiți în drojdie, dar mulți au ortologi în eucariote superioare (Figura 6). Formarea autofagozomilor implică participarea proteinei citoplasmatice LC3 (Atg8), care suferă lipidarea prin fosfatidiletanolamină și este apoi recrutată în membrana autofagozomică în curs de formare (Figura 7). Acumularea proteinei lipidate LC3 (cunoscută sub numele de LC3-II) este utilizată ca marker al autofagiei .

Figura 6.
xmlns:xlink=”http://www.w3.org/1999/xlink ” xmlns: mml=” http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. Proteina LC3 este lipidată de fosfatidiletanolamină.
moartea celulară Autofagică sau moartea celulară programată de tip II se caracterizează printr-o înghițire masivă a citoplasmei de vezicule autofagice. Această activitate autofagică intensă diferă substanțial de autofagia care apare continuu la niveluri bazale. Studiile ultrastructurale în Drosophila au evidențiat acumularea de vacuole autofagice în majoritatea țesuturilor larvare. Acest tip de moarte celulară programată începe cu degradarea organitelor citoplasmatice prin autofagie, deși elementele citoscheletice sunt conservate până la etapele târzii ale procesului (revizuite în ).
