obiective de învățare
- descrieți structura fundamentală a unui aminoacid
- descrieți structurile chimice ale proteinelor
- rezumați caracteristicile unice ale proteinelor
la începutul acestui capitol, a fost descris un experiment celebru în care oamenii de știință au sintetizat aminoacizii în condiții care simulează pe cei prezenți pe pământ cu mult înainte de evoluția vieții așa cum o cunoaștem. Acești compuși sunt capabili să se unească în esență în orice număr, producând molecule de orice dimensiune care posedă o gamă largă de proprietăți fizice și chimice și îndeplinesc numeroase funcții vitale pentru toate organismele. Moleculele derivate din aminoacizi pot funcționa ca componente structurale ale celulelor și entităților subcelulare, ca surse de nutrienți, ca rezervoare de stocare a atomilor și a energiei și ca specii funcționale precum hormoni, enzime, receptori și molecule de transport.
aminoacizi și legături peptidice

Figura 1.
un aminoacid este o moleculă organică în care un atom de hidrogen, o grupare carboxil (–COOH) și o grupare amino (–NH2) sunt toate legate de același atom de carbon, așa-numitul carbon de la sută. Cel de-al patrulea grup legat de carbonul de la suta variază între diferiții aminoacizi și se numește un reziduu sau un lanț lateral, reprezentat în formule structurale prin litera R. un reziduu este un monomer care rezultă atunci când doi sau mai mulți aminoacizi se combină și elimină moleculele de apă. Structura primară a unei proteine, un lanț peptidic, este formată din reziduuri de aminoacizi. Caracteristicile unice ale grupărilor funcționale și ale grupărilor R permit acestor componente ale aminoacizilor să formeze legături de hidrogen, ionic și disulfură, împreună cu interacțiunile polare/nepolare necesare pentru a forma structuri proteice secundare, terțiare și cuaternare. Aceste grupuri sunt compuse în principal din carbon, hidrogen, oxigen, azot și sulf, sub formă de hidrocarburi, acizi, amide, alcooli și amine. Câteva exemple care ilustrează aceste posibilități sunt prezentate în Figura 1.
aminoacizii se pot lega chimic prin reacția grupului de acid carboxilic al unei molecule cu grupul aminic al alteia. Această reacție formează o legătură peptidică și o moleculă de apă și este un alt exemplu de sinteză a deshidratării (Figura 2). Moleculele formate prin legarea chimică a unui număr relativ modest de aminoacizi (aproximativ 50 sau mai puțini) se numesc peptide, iar prefixele sunt adesea folosite pentru a specifica aceste numere: dipeptide (doi aminoacizi), tripeptide (trei aminoacizi) și așa mai departe. Mai general, este desemnat numărul aproximativ de aminoacizi: oligopeptidele se formează prin unirea a aproximativ 20 de aminoacizi, în timp ce polipeptidele sunt sintetizate de la aproximativ 50 de aminoacizi. Când numărul de aminoacizi legați între ei devine foarte mare sau când mai multe polipeptide sunt utilizate ca subunități de construcție, macromoleculele care rezultă se numesc proteine. Lungimea variabilă continuă (numărul de monomeri) a acestor biopolimeri, împreună cu varietatea posibilelor grupări R pe fiecare aminoacid, permite o diversitate aproape nelimitată în tipurile de proteine care pot fi formate.

Figura 2. Formarea legăturii peptidice este o reacție de sinteză a deshidratării. Gruparea carboxil a primului aminoacid (alanină) este legată de gruparea amino a celui de-al doilea aminoacid (alanină). În acest proces, se eliberează o moleculă de apă.
gândiți-vă la asta
- câți aminoacizi sunt în polipeptide?
structura proteinei
dimensiunea (lungimea) și secvența specifică de aminoacizi a unei proteine sunt determinanți majori ai formei sale, iar forma unei proteine este esențială pentru funcția sa. De exemplu, în procesul de fixare biologică a azotului (vezi cicluri biogeochimice), microorganismele din sol cunoscute în mod colectiv sub numele de rhizobia interacționează simbiotic cu rădăcinile plantelor leguminoase, cum ar fi soia, arahidele sau fasolea, pentru a forma o structură nouă numită nodul pe rădăcinile plantei. Planta produce apoi o proteină purtătoare numită leghemoglobină, o proteină care transportă azot sau oxigen. Leghemoglobina se leagă cu o afinitate foarte mare de oxigenul său substrat într-o regiune specifică a proteinei unde forma și secvența de aminoacizi sunt adecvate (situsul activ). Dacă forma sau mediul chimic al sitului activ este modificat, chiar ușor, substratul poate să nu se poată lega la fel de puternic sau poate să nu se lege deloc. Astfel, pentru ca proteina să fie pe deplin activă, trebuie să aibă forma adecvată funcției sale.
structura proteinei este clasificată în termeni de patru niveluri: primar, secundar, terțiar și cuaternar. Structura primară este pur și simplu secvența de aminoacizi care alcătuiesc lanțul polipeptidic. Figura 3 descrie structura primară a unei proteine.
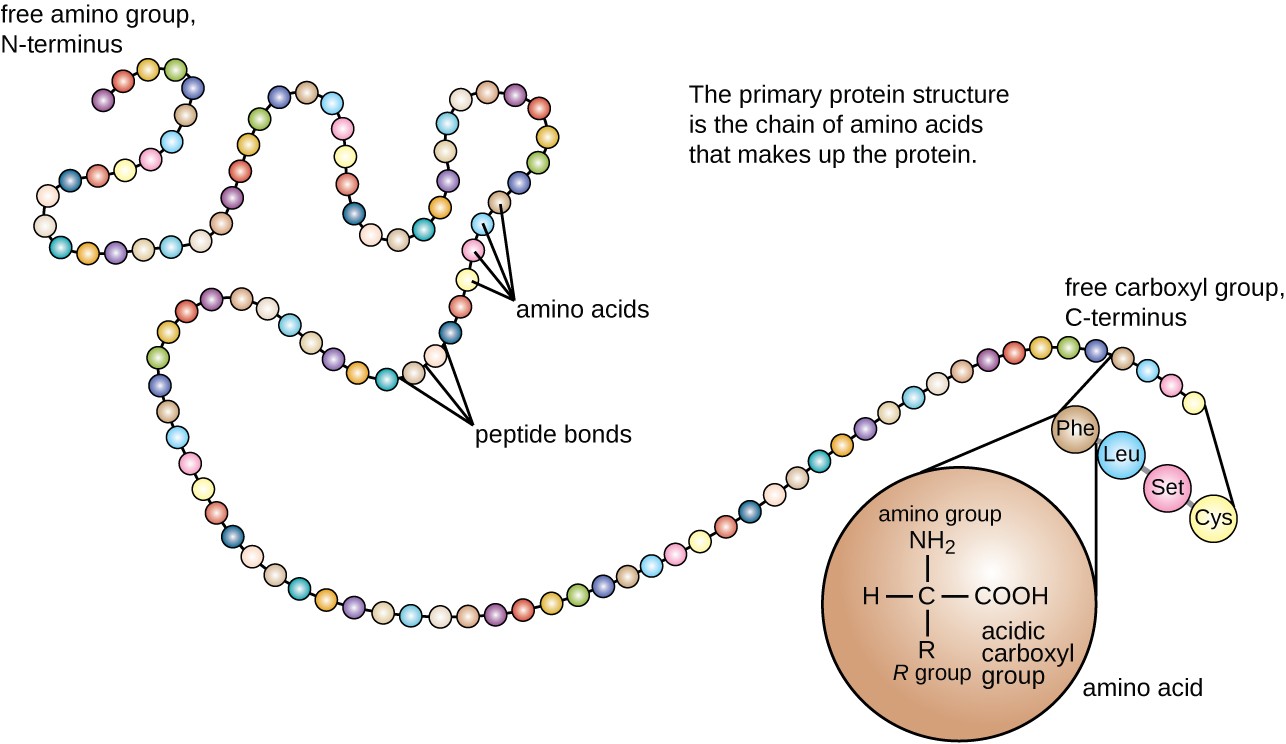
Figura 3. Faceți clic pentru a vizualiza o imagine mai mare. Structura primară a unei proteine este secvența de aminoacizi. (credit: modificarea muncii de către Institutul Național de cercetare a Genomului Uman)
lanțul de aminoacizi care definește structura primară a unei proteine nu este rigid, ci este flexibil din cauza naturii legăturilor care țin aminoacizii împreună. Când lanțul este suficient de lung, se poate produce legătura de hidrogen între grupările funcționale amină și carbonil din coloana vertebrală a peptidei (excluzând grupul lateral R), rezultând plierea localizată a lanțului polipeptidic în helice și foi. Aceste forme constituie structura secundară a unei proteine. Cele mai comune structuri secundare sunt foile plisate de la clasa a VIII-a-helix și de la clasa a VIII-a. În structura de helix-uri, helixul este ținut de legături de hidrogen între atomul de oxigen într-o grupare carbonil a unui aminoacid și atomul de hidrogen al grupării amino care este la doar patru unități de aminoacizi mai departe de-a lungul lanțului. În foaia plisată de la XV, pliurile sunt formate din legături de hidrogen similare între secvențele continue de grupări carbonil și amino care sunt separate în continuare pe coloana vertebrală a lanțului polipeptidic (Figura 4).

Figura 4. Structura secundară a unei proteine poate fi o helix-uri sau o foaie plisată-URI-URI-uri, sau ambele.
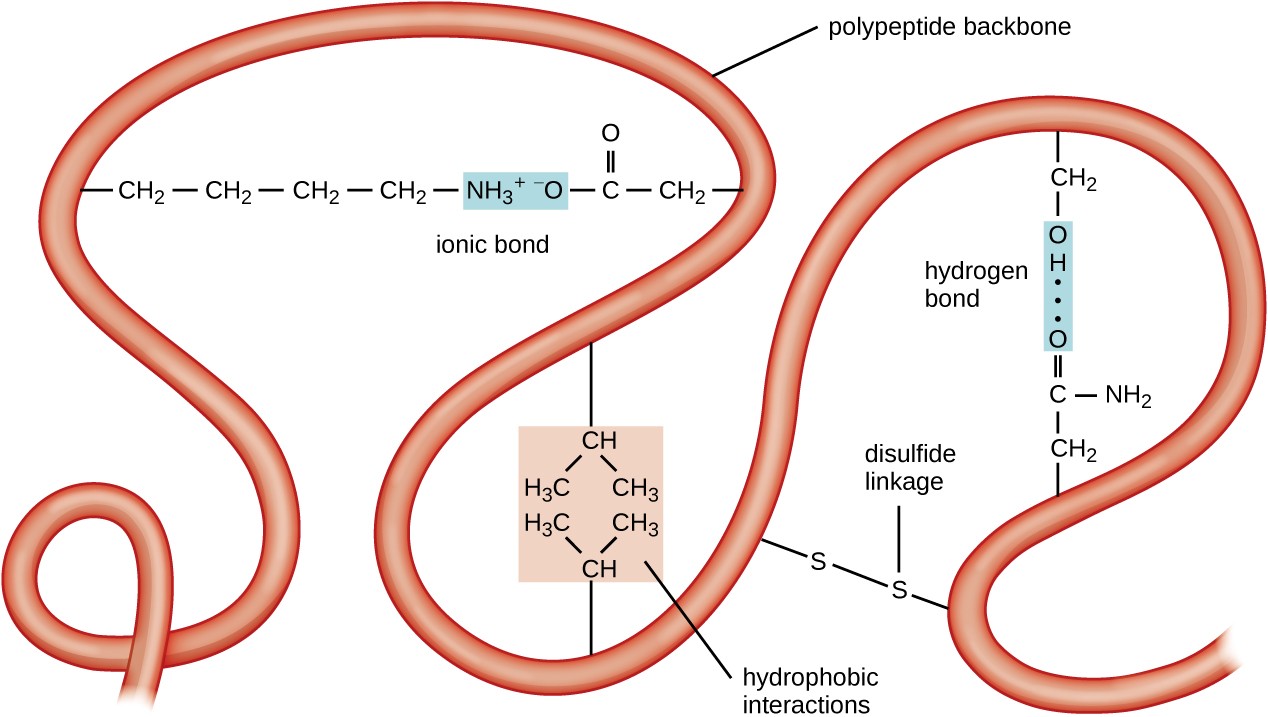
Figura 5. Faceți clic pentru a vizualiza imaginea mai mare. Structura terțiară a proteinelor este determinată de o varietate de forțe atractive, inclusiv interacțiuni hidrofobe, legături ionice, legături de hidrogen și legături disulfidice.
următorul nivel de organizare a proteinelor este structura terțiară, care este forma tridimensională pe scară largă a unui singur lanț polipeptidic. Structura terțiară este determinată de interacțiunile dintre reziduurile de aminoacizi care sunt departe în lanț. O varietate de interacțiuni dau naștere structurii terțiare proteice, cum ar fi punți disulfidice, care sunt legături între sulfhidril (–SH) grupări funcționale pe grupări laterale de aminoacizi; legături de hidrogen; legături ionice; și interacțiuni hidrofobe între lanțurile laterale nepolare. Toate aceste interacțiuni, slabe și puternice, se combină pentru a determina forma tridimensională finală a proteinei și funcția acesteia (Figura 5).
procesul prin care un lanț polipeptidic își asumă o formă tridimensională pe scară largă se numește pliere proteică. Proteinele pliate care sunt pe deplin funcționale în rolul lor biologic normal se spune că posedă o structură nativă. Când o proteină își pierde forma tridimensională, este posibil să nu mai fie funcțională. Aceste proteine desfăcute sunt denaturate. Denaturarea implică pierderea structurii secundare și a structurii terțiare (și, dacă este prezentă, a structurii cuaternare) fără pierderea structurii primare.
unele proteine sunt ansambluri de mai multe polipeptide separate, cunoscute și subunități proteice. Aceste proteine funcționează adecvat numai atunci când toate subunitățile sunt prezente și configurate corespunzător. Interacțiunile care țin aceste subunități împreună constituie structura cuaternară a proteinei. Structura generală cuaternară este stabilizată prin interacțiuni relativ slabe. Hemoglobina, de exemplu, are o structură cuaternară formată din patru subunități proteice globulare: două polipeptide de la XV și două de la XV, fiecare conținând un hem pe bază de fier (Figura 6).

Figura 6. O moleculă de hemoglobină are două polipeptide de la XV și două de la XV împreună cu patru grupe heme.
o altă clasă importantă de proteine sunt proteinele conjugate care au o porțiune nonproteină. Dacă proteina conjugată are un carbohidrat atașat, se numește glicoproteină. Dacă are o lipidă atașată, se numește lipoproteină. Aceste proteine sunt componente importante ale membranelor. Figura 7 rezumă cele patru niveluri ale structurii proteinelor.

Figura 7. Structura proteinelor are patru niveluri de organizare. (credit: modificarea muncii de către Institutul Național de cercetare a Genomului Uman)
gândiți-vă la asta
- ce se poate întâmpla dacă structura primară, secundară, terțiară sau cuaternară a unei proteine este schimbată?
structura primară, proteinele disfuncționale și fibroza chistică

figura 8. Faceți clic pentru a vizualiza o imagine mai mare. Proteina CFTR normală este o proteină de canal care ajută sarea (clorura de sodiu) să se deplaseze în și din celule.
proteinele asociate membranelor biologice sunt clasificate ca extrinseci sau intrinseci. Proteinele extrinseci, numite și proteine periferice, sunt asociate vag cu o parte a membranei. Proteinele intrinseci, sau proteinele integrale, sunt încorporate în membrană și funcționează adesea ca parte a sistemelor de transport ca proteine transmembranare. Fibroza chistică (CF) este o tulburare genetică umană cauzată de o modificare a proteinei transmembranare. Afectează mai ales plămânii, dar poate afecta și pancreasul, ficatul, rinichii și intestinul. CF este cauzată de o pierdere a aminoacidului fenilalanină într-o proteină transmembranară de fibroză chistică (CFTR). Pierderea unui aminoacid modifică structura primară a unei proteine care, în mod normal, ajută la transportul sării și apei în și din celule (figura 8).
schimbarea structurii primare împiedică funcționarea corectă a proteinei, ceea ce determină organismul să producă mucus neobișnuit de gros care înfundă plămânii și duce la acumularea de mucus lipicios. Mucusul obstrucționează pancreasul și oprește enzimele naturale să ajute organismul să descompună alimentele și să absoarbă substanțele nutritive vitale.în plămânii persoanelor cu fibroză chistică, mucusul modificat oferă un mediu în care bacteriile pot prospera. Această colonizare duce la formarea de biofilme în căile respiratorii mici ale plămânilor. Cei mai frecvenți agenți patogeni găsiți în plămânii pacienților cu fibroză chistică sunt Pseudomonas aeruginosa (figura 9a) și Burkholderia cepacia. Pseudomonas se diferențiază în interiorul biofilmului din plămâni și formează colonii mari, numite Pseudomonas „mucoid”. Coloniile au o pigmentare unică care apare în testele de laborator (figura 9b) și oferă medicilor primul indiciu că pacientul are CF (astfel de colonii sunt rare la persoanele sănătoase).

Figura 9. (a) un micrograf electronic de scanare arată bacteria oportunistă Pseudomonas aeruginosa. (b) P care produce pigmenți. aeruginosa pe agar cetrimidă prezintă pigmentul verde numit piocianină. (credit a: modificarea muncii de către Centrele pentru Controlul și Prevenirea Bolilor)
concepte cheie și rezumat
- aminoacizii sunt molecule mici esențiale pentru toată viața. Fiecare are un carbon la care sunt legați un atom de hidrogen, o grupare carboxil și o grupare amină. Al patrulea grup legat, reprezentat de R, variază în ceea ce privește compoziția chimică, dimensiunea, polaritatea și încărcarea între diferiți aminoacizi, oferind variații ale proprietăților.
- peptidele sunt polimeri formați prin legătura aminoacizilor prin sinteza deshidratării. Legăturile dintre aminoacizii legați se numesc legături peptidice. Numărul de aminoacizi legați împreună poate varia de la câțiva La mulți.
- proteinele sunt polimeri formați prin legătura unui număr foarte mare de aminoacizi. Ei îndeplinesc multe funcții importante într-o celulă, servind ca nutrienți și enzime; molecule de stocare pentru carbon, azot și energie; și componente structurale.
- structura unei proteine este un determinant critic al funcției sale și este descrisă printr-o clasificare gradată: primară, secundară, terțiară și cuaternară. Structura nativă a unei proteine poate fi perturbată prin denaturare, ducând la pierderea structurii sale de ordin superior și a funcției sale biologice.
- unele proteine sunt formate din mai multe subunități proteice separate, interacțiunea acestor subunități compunând structura cuaternară a complexului proteic.
- proteinele conjugate au o porțiune nonpolipeptidică care poate fi un carbohidrat (formând o glicoproteină) sau o fracție lipidică (formând o lipoproteină). Aceste proteine sunt componente importante ale membranelor.
alegere multiplă
care dintre următoarele grupuri variază între diferiți aminoacizi?
- atom de hidrogen
- grup carboxil
- grup R
- grup amino
aminoacizii prezenți în proteine diferă în care dintre următoarele?
- Dimensiune
- formă
- grupuri laterale
- toate cele de mai sus
care dintre următoarele obligațiuni nu sunt implicate în structura terțiară?
- legături peptidice
- legături ionice
- interacțiuni hidrofobe
- legături de hidrogen
completați martorul
secvența aminoacizilor dintr-o proteină se numește its __________.
denaturarea implică pierderea __________ și __________ structuri fără pierderea __________ structura.
True/False
o modificare a unui aminoacid într-o secvență de proteine duce întotdeauna la o pierdere a funcției.
gândiți-vă
- încălzirea suficientă a unei proteine poate duce la denaturarea acesteia. Având în vedere definiția denaturării, ce spune această afirmație despre punctele forte ale legăturilor peptidice în comparație cu legăturile de hidrogen?
- imaginea prezentată reprezintă o tetrapeptidă.

- câte legături peptidice sunt în această moleculă?
- identificați grupurile laterale ale celor patru aminoacizi care compun această peptidă.
