Introducere
celulele citotoxice sunt integrate în lupta împotriva celulelor infectate cu virusul și a celulelor canceroase. Aceste celule ucid prin trei căi diferite, eliberarea granulelor litice, calea receptor-ligand fas sau calea receptorului TRAIL–TRAIL. În scopul acestei lucrări, ne vom concentra pe degranulare. Când o celulă citotoxică întâlnește o celulă țintă, aceasta aderă strâns la ea formând sinapsa imună. Granulele litice sunt apoi polarizate spre sinapsa imunologică și eliberate din celula citotoxică îndreptată spre țintă (1). Aceste granule conțin diferiți mediatori citotoxici, cum ar fi perforina și granzimele. Perforina eliberată poate forma pori tranzitorii în membrana celulei țintă, permițând granzimelor să intre în celula țintă. Intrarea este probabil mediată și de oligomerii perforinei care formează pori incompleți (arce) (2) și s-a sugerat, de asemenea, că granzimele și perforina pot fi preluate în celulele țintă prin calea endozomală (3, 4). Datele din spatele acestor mecanisme propuse au fost discutate recent în detaliu (5). Când granzimele intră în celulele țintă, calea caspazei este activată, rezultând apoptoză (6, 7). Membrana acestor granule citotoxice conține membrana asociată lizozomal glicoproteină – 1 (LAMP1), cunoscută și sub denumirea de CD107a (8). Partea luminală a șobolanului CD107a este expusă tranzitoriu la partea extracelulară a membranei celulare după degranulare înainte de a fi din nou internalizată. Prin urmare, colorarea CD107a indică faptul că a avut loc un eveniment de degranulare (9). În timp ce rolul CD107a este încă determinat, studiile siRNA împotriva CD107a au arătat că este esențial pentru traficul de perforină în vezicule, deoarece livrarea perforinei în granulele litice este inhibată în absența CD107a (10). De asemenea, s-a demonstrat că CD107a are un rol în protejarea celulelor citotoxice de moarte prin legarea de perforină și prevenirea inserției în membrana celulară (11).
există două tipuri principale de limfocite citotoxice, celulele ucigașe naturale (NK) și celulele T CD8. Ambele tipuri de celule ucid prin eliberarea granulelor litice, receptorul Fas/calea ligandului Fas și calea receptorului TRAIL/TRAIL, dar stimulul necesar pentru activarea acestor două grupuri celulare este diferit. Celulele T recunosc antigenul prezentat de moleculele MHC clasa I prin receptorul lor de celule T Activatoare (TCR), în timp ce celulele NK recunosc antigenele celulelor țintă, deși diferiți receptori inhibitori și activatori. Receptorii inhibitori sunt importanți pentru prevenirea celulelor NK de la uciderea celulelor sănătoase în timp ce activarea receptorilor induce citotoxicitatea celulelor NK.
înainte de identificarea CD107a ca marker pentru degranularea în celulele NK (12), rezultatul pentru măsurarea capacității citotoxice a fost moartea celulelor țintă. Detectarea CD107a prin citometrie în flux a permis cercetătorilor să identifice celulele efectoare specifice cu capacitate citotoxică. De la descoperirea sa, o gamă largă de publicații de date din studiile pe șoareci și oameni au fost finalizate, arătând avantajul utilizării unui anticorp anti-CD107a. Șobolanul este un model animal imunologic valoros pentru studierea bolilor precum leucemia și grefa vs. boala gazdă (13), dar citirile funcționale au fost împiedicate de lipsa anticorpilor CD107a specifici anti-șobolan de înaltă calitate pentru citometria în flux. Această lucrare descrie crearea unui anticorp față de șobolanul CD107a și caracterizarea răspunsului de degranulare în celulele T de șobolan NK și CD8+.
materiale și metode
animale
hamsteri armeni consangvinizați (Cytogen Research and Development Inc., MA, SUA) au fost găzduite în departamentul de Medicină comparată de la Rikshospitalet, Spitalul Universitar din Oslo, în acord cu orientările instituționale. Tulpinile de șobolan PVG-RT1U, PVG-RT7b, PVG-RT1N și PVG-R23 au fost utilizate interschimbabil și întreținute pentru mai mult de 20 de generații și adăpostite în conformitate cu liniile directoare stabilite de Consiliul pentru animale experimentale din cadrul Ministerului Agriculturii din Norvegia și de Convenția Europeană pentru protecția animalelor Vertebrate utilizate în scop Experimental și în alte scopuri științifice. Șobolanii au fost folosiți până la vârsta de 8-12 săptămâni. Instalațiile pentru animale de laborator sunt supuse unui program de rutină de monitorizare a sănătății și testate pentru organisme infecțioase în conformitate cu o modificare a recomandărilor Asociației Europene de științe animale de laborator. Experimentele pe animale au fost reglementate prin reglementări de laborator, care sunt prezentate de Legea privind bunăstarea animalelor în care Norvegia urmează direcția de laborator a UE și Convenția europeană a Laboratorului.
Abs și reactivi
anticorpi împotriva NKp46 , NKR-P1A 3.2.3-PB, sau neconjugat (legare numai NKR-P1A, dar nu NKR-P1B, în tulpina PVG), CD8 (OX8-biotină), CD2 (OX34, neconjugat), TCR (R73-Alexa647), alotip IGD B de șoarece (TIB96-neconjugat, utilizat ca izotip IgG de șoarece) și CD45.2 (His41-FITC, utilizat ca izotip IgG de șoarece) au fost realizate în laboratorul nostru conjugat conform protocoalelor standard. Anticorpii împotriva CD3 (IF4, neconjugat) și izotipul său IgM de șoarece (MM-30, neconjugat) și controlul izotipului IgG de hamster armean (HTK88-FITC) au fost achiziționați de la Biolegend (San Diego, CA, SUA). Anticorpii anti-CD107a comerciali au fost achiziționați de la AbCam (Cambridge, Marea Britanie) (H4A3-FITC), eBioscience (San Diego, CA, SUA) (ID48-PerCP-eFluor) și Lifespan (Seattle, WA, SUA) (LS-C8580-neconjugat). LS-C8580 a fost conjugat cu esterul Alexa488 NHS (Sigma-Aldrich, St.Louis, MO, SUA) pentru utilizare în testele funcționale. Anticorpul anti-Pavilion (M2, neconjugat) și IgG anti-șoarece (goat policlonal-FITC) au fost achiziționate de la Sigma-Aldrich (St.Louis, MO, SUA). IL-2 a fost obținut dintr-un supernatant de cultură celulară dializat al unei linii celulare ovariene de hamster chinezesc (CHO) transfectate stabil cu un construct de Expresie IL-2 de șobolan. Peridinina clorofilă-o proteină (PerCP) streptavidină conjugată, FITC hamster IgG policlonal izotype control, FITC mouse IgG1 izotype control (MOPC-FITC) și GolgiStop au fost achiziționate de la bd biosciences (Franklin Lakes, NJ, SUA). Hamsterul anti-armean de capră (policlonal-FITC) a fost achiziționat de la Jackson Immunoresearch (West Grove, PA, SUA). Supernatanții de la hybridomas OX41, CD172a (SIRPa), R73 (Anti-rat TCRA), OX19 (anti-CD5), OX12 (lanț anti-Igk) și OX33 (anti-CD45RA) au fost realizate in-house. Serul de hamster de Control a fost derivat din hamsteri armeni neimunizați.
clonarea cd107a de șobolan
Cd107a de șobolan a fost amplificată PCR din ADNc generată de splenocitele de șobolan PVG și subclonată într-un vector de Expresie pMX care conține o genă de rezistență la puromicină (un cadou generos de la Dr.Michael R. Daws) (14). Grundurile CD107 au fost proiectate pe baza unei secvențe cd107a de șobolan (LAMP1) ADNc (GenBank: NM_012857). Forward primer: 5′-GCCCCAGCACTGTTCGAGGT-3′; grund invers: 5′-GTTGTTACCGTCCTGTACACACT-3′. O peptidă lider anionică de tripsină – 1 (MSALLILALVGAAVA) a fost utilizată în vectorul de Expresie, iar regiunea transmembranară originală CD107 a fost înlocuită cu un fragment transmembranar CD8 pentru a facilita exprimarea suprafeței ridicate. O etichetă de pavilion (DYKDDDDK) a fost legată de n-terminalul proteinei CD107 pentru a face expresia suprafeței detectabilă. Toate secvențele inserate și Cadrul de citire deschis în constructul plasmidic chimeric final au fost examinate și confirmate prin secvențierea ADN-ului Sanger.
Transfectarea BWZ.36 celule cu plasmidă pMX-CD107a
celulele 293t au fost însămânțate într-o placă de cultură celulară cu 6 godeuri, cu mediu RPMI 1640 de 4 ml, transfectate cu reactiv FuGENE6 de 7,5 unqql (Roche, protocolul producătorului) și incubate la 37 unqc cu 5% CO2. Reactivul FuGENE6 a fost pre-diluat cu Opti-mem (Gibco) și amestecat cu 1,5 plasmidă pmx-CD107a și 1 plasmidă retrovirală specifică rozătoarelor PCL-eco (Addgene #12371). La douăzeci și patru de ore de la transfecție, supernatantul a fost descantat și înlocuit cu mediu RPMI1640 cu 2% FBS și transferat la 32 CTC pentru producția retrovirală. Patruzeci și opt de ore mai târziu, supernatantul a fost recoltat și filtrat cu un filtru Filtropur s de 0,2-centimetri (Sarstedt) și salvat la -80 centimetric c Pentru transducție retrovirală.
105 BWZ.36 de celule au fost însămânțate pe godeu într-o placă de cultură celulară cu 24 de godeuri (Corning) și cultivate cu mediu RPMI1640 proaspăt cu 10% FBS, peste noapte. Supernatantul a fost îndepărtat și RPMI1640 conținând 10% FBS, 16% polibren (până la o concentrație finală de 8%/ml) și 1,5 ml supernatant retroviral a fost adăugat și centrifugat la 32% C la 2400 rpm Timp de 2 ore. Celulele au fost apoi incubate la 32% C timp de 1 oră după care supernatantul a fost îndepărtat și înlocuit cu mediu RPMI1640 proaspăt cu 10% FBS și cultivat timp de 3 zile, la 37% C cu 5% CO2 (în ziua 2, mediu complet cu 1 ng/ml puromicină ar putea fi utilizat). Transfectanții expandați BWZ. CD107a-FLAG au fost examinați pentru exprimarea suprafeței etichetei de pavilion și apoi au fost utilizați pentru imunizarea anticorpilor sau screeningul anticorpilor.
generatoare CD107a care exprimă Transfectanți
plasmida chimerică CD107a de șobolan a fost transfectată în celule CHO. Pe scurt, celulele CHO au fost cultivate în mediu RPMI1640 complet (cRPMI; mediu RPMI1640 cu 10% FBS, 1mm na Piruvat, 50 2-mercaptoetanol) până când au atins 30% confluență. Plasmida de 2,5 unqqg a fost amestecată cu 7,5 unqql de reactiv Fugene 6 (Roche) și adăugată în celule prin picurare. La două zile după aceea, celulele CHO au fost detașate cu mediu RPMI1640 suplimentat cu EDTA de 2 mm și au fost însămânțate în plăci de cultură celulară cu fund plat de 96 de godeuri (25 celule/godeu) cu mediu de selecție (cRPMI suplimentat cu puromicină de 20 hectolitri/ml) pentru clonarea transfectanților stabili. După 10-12 zile de cultură, clonele adulte au fost analizate cu anticorpi anti-Pavilion (M2). Una dintre clonele care exprimă cel mai înalt nivel de suprafață al FLAG și CD107a a fost utilizată pentru imunizări.
imunizare și fuziune celulară
hamsterii masculi armeni în vârstă de 3 până la 10 săptămâni au fost imunizați prin injecții intraperitoneale (i.p.) cu 2 celule de pavilion 106 CHO.CD107a o dată pe săptămână timp de 3 săptămâni. Un impuls cu 4 celule BWZ.CD107a transfectate stabil a fost administrat i. p.la 32 de zile de la prima imunizare, iar serurile au fost analizate pentru colorarea suprafeței atât a CHO.CD107a-FLAG, cât și a BWZ.CD107a-transfectanți de pavilion. Două dintre cele trei animale au fost pozitive, iar la 3 zile după stimulare, celulele splinei au fost recoltate și grupate de la cele două animale, dintre care unul avea splenomegalie. Aproximativ 2.0 108 celule de splină și 1.4 108 celule de mielom NS0 au fost spălate de trei ori în DMEM cu aditivi (1mm piruvat de sodiu, 0.05 mm 2-mercaptoetanol și antibiotic/antimicotic) și centrifugate la 90 g timp de 10 min. Păstrând totul la 37 centimetric C din acest punct înainte, peleta a fost dizolvată prin atingerea tubului și polietilen glicol 1500 (Roche) pre-încălzit a fost adăugat picătură cu picătură în timp ce se agită ușor timp de 1 min. Trei mililitri de DMEM cu aditivi au fost adăugați treptat pentru următoarele 3 minute, terminând cu 7 ml în plus înainte de centrifugare la 500 g. peleta a fost spălată prin spălare atentă (fără omogenizare) cu DMEM cu aditivi și 20% FBS (DMEM-20) și cultivată peste noapte. Celulele au fost recoltate a doua zi și s-au adăugat 100 ml DMEM–20 cu 2 hipoxantină–aminopterină-timidină (SIGMA) și 10% supliment de clonare hybridoma (HCS) (PAA). Suspensia celulară a fost transferată pe plăci cu 96 de puțuri. După 12 zile, supernatanții din clonele în creștere au fost testați prin citometrie în flux pentru colorarea antigenelor de suprafață prezente pe BWZ.CD107a-FLAG și CHO.CD107a-FLAG, dar nu pe BWZ.36 de celule transfectate cu antigene irelevante marcate ca fiind controale negative. 9 din cele 12 clone pozitive care produc anticorpi specifici au fost subclonate în continuare folosind DMEM-20 suplimentat cu hipoxantină-timidină și HCS. O singură clonă (SIM1) a mai produs anticorpi după subclonare și aceasta a fost subclonată încă o dată. CD107a anticorpi IgG specifici hamsterului au fost detectați de FITC anti-armean hamster IgG (Jackson Immunoresearch). Anti-CD107a din HIBRIDOMUL SIM1 a fost purificat prin proteina HiTrap G HP (GE Healthcare, Life Sciences) și FITC-conjugat conform procedurilor standard sau Alexa488-conjugat conform protocolului producătorului.
generarea de celule efectoare
suspensiile cu o singură celulă au fost preparate din splină. Limfocitele au fost izolate folosind un gradient Limfoprep și apoi au trecut peste o coloană de lână de nailon pentru a îndepărta celulele B și macrofagele. Pentru generarea de celule NK activate de IL-2 (LAK), celulele rămase au fost cultivate peste noapte în IL-2. A doua zi, celulele neaderente au fost îndepărtate prin spălare cu PBS și celulele NK aderente au fost menținute în RPMI suplimentat cu IL-2, 10% FBS inactivat termic, 1% streptomicină/penicilină, 1mm piruvat de sodiu și 50 2-mercaptoetanol. Celulele au fost cultivate timp de 8-10 zile. Pentru generarea de celule NK îmbogățite sau celule T și NK sortate, celulele au fost îmbogățite prin selecție negativă după etapa de lână de nailon. Pentru îmbogățirea celulelor NK, Dynabead-urile IgG pan-șoarece (Invitrogen Dynal) au fost acoperite cu anticorpi împotriva macrofagelor (OX41), celulelor T (R73 și OX19) și celulelor B (OX12 și OX33). Pentru îmbogățirea celulelor T, Dynabead-urile IgG pan-șoarece au fost colorate cu anticorpi împotriva macrofagelor (OX41) și a celulelor B (OX12 și OX33). Celulele au fost imbogatite prin doua etape de selectie negativa cu margele colorate timp de 30 min la 4 C. Celulele NK îmbogățite au avut o puritate de aproximativ 50-60% și au fost utilizate pentru studii de degranulare. Celulele T îmbogățite (puritate 79-85%) au fost sortate în continuare pentru celulele TCR+ folosind o arie FACS (bd Biosciences).
teste de degranulare
pentru a măsura răspunsul de degranulare prin colorarea cu CD107a (SIM1) Anti-șobolan în timpul stimulării celulelor țintă, efectorii NK și celulele țintă YAC au fost incubate, la un raport de 1 la 1 de 3 celule / sondă (dacă nu se specifică altfel) în medii care conțin MAB SIM1, ceilalți anticorpi anti-CD107a disponibili în comerț sau controlul izotipului. Pentru a măsura răspunsul de degranulare la stimularea anticorpilor din celulele NK, am folosit plăci cu fund plat cu 96 de puțuri acoperite cu concentrații variabile de anti-nkp46 (Wen23), anti-NKr-P1A (3.2.3) și un control izotip IgG1 de șoarece (TIB96). A doua zi, plăcile au fost spălate cu PBS și blocate cu cRPMI înainte de adăugarea a 3 celule NK îmbogățite cu 105, suspendate în cRPMI care conțin SIM1, au fost adăugate pe godeu. Pentru a măsura degranularea din celulele T, acestea au fost sortate și cultivate în cRPMI cu IL-2 timp de 2-3 zile. Plăcile cu fund plat cu 96 de puțuri au fost acoperite peste noapte cu anticorpi împotriva CD3 (IF4), CD2 (OX34) sau un control izotip IgM (MM-30). S-au adăugat aproximativ 3 celule T 105 la fiecare godeu în cRPMI conținând SIM1. Toate testele au fost incubate timp de 4 ore. Golgistop a fost adăugat pentru ultimele 3 ore de incubație pentru a preveni degradarea CD107a internalizată. celulele au fost apoi spălate și colorate cu anticorpi către receptorii de suprafață corespunzători și analizate folosind FACS Canto sau LSR II (BD Biosciences).
testul de eliberare a cromului
celule țintă YAC-1 (5 celule 106 / ml crpmi) cu adaos de 3.7 MBq51Cr s-au incubat la 37 centimetric C timp de 1 oră, amestecând la fiecare 15 minute. Celulele au fost apoi spălate de trei ori cu PBS cu 2% FBS și omogenizate la 1 105 celule/ml în cRPMI. Celulele efectoare LAK și celulele țintă au fost placate la raporturile specificate într-un volum final de 200 ect. Celulele au fost centrifugate și incubate timp de 4 ore la 37 C. eliberarea specifică a 51cr a fost măsurată folosind Cobra auto-gamma (Packard).
rezultate
pentru a crea un anticorp împotriva CD107a, am realizat un vector de Expresie care conține regiunea membranei extracelulare a CD107a de șobolan, Regiunea transmembranară a CD8 de șobolan și o etichetă de pavilion 3′-terminal pentru a detecta expresia suprafeței (figura 1a). Vectorul a fost transfectat în celule CHO și BWZ.36 linie de celule T și ecranate pentru expresia CD107a folosind un anticorp anti-Pavilion (M2) (figura 1b). CD107a celulele CHO transfectate Stabil Au fost injectate în hamsterii armeni consangvinizați o dată pe săptămână timp de 3 săptămâni, cu o creștere finală a celulelor BWZ Transfectate stabil CD107a cu 3 zile înainte de fuziunea cu linia celulară de mielom NS0. Supernatanții din diferitele clone au fost testați pentru specificitate față de BWZ.CD107a-FLAG, dar nu irelevant BWZ etichetat cu pavilion.36 de transfectanți. S-a constatat că o clonă, SIM1, se leagă în mod specific de transfectantul care exprimă CD107a, dar nu de controlul TRANSFECTAT al steagului (figura 1C).

Figura 1. Generarea unui anticorp monoclonal CD107a Anti-șobolan (SIM1). (A) Harta vectorială schematică a vectorului de Expresie pMX cu peptidă leader, etichetă de pavilion, inserție CD107a și domeniul transmembranar al CD8. (B) ovar de hamster chinezesc transfectat stabil și BWZ.36 de celule au fost testate pentru expresia suprafeței celulare a CD107a marcată cu pavilion folosind un anticorp anti-Pavilion (M2) (histograme umbrite). Controlul negativ este anticorpul secundar singur (histogramă transparentă). (C) celulele BWZ transfectate cu CD107a-FLAG sau antigen irelevant (NKR-P1F-FLAG) au fost colorate cu ser de control pentru hamster, supernatant SIM1 sau un anticorp anti-FLAG (m2).
clona SIM1 a fost testată în continuare în teste funcționale în paralel cu doi anticorpi CD107a disponibili în comerț, care ar putea reacționa încrucișat cu cd107a de șobolan în citometria de flux. Clonele de anticorpi testate au fost H4A3 de la AbCam (care cross reacționează cu om, șobolan, șoarece și primate în citometria de flux) și clona de anticorpi LS-C8580 de la LifeSpan BioSciences (care cross reacționează cu CD107a de la șoarece, om și șobolani în imunohistochimie și Western blots conform site-ului web al producătorului). Clona noastră de anticorpi SIM1 a identificat celule degranulante în prezența celulelor țintă și a arătat puțină colorare de fundal în absența țintelor (panoul superior figura 2a). Clona H4A3 a colorat cel mai mare procent de celule NK după stimularea celulelor țintă (panoul din mijloc). Cu toate acestea, a existat, de asemenea, un nivel ridicat de colorare a fundalului în absența celulelor țintă, indicând legarea nespecifică. Nivelurile foarte scăzute de degranulare, dacă există, au fost măsurate de clona ls-C8580 mAb (panoul inferior). Specificitatea acestor anticorpi a fost confirmată prin colorarea pozitivă a transfectantului BWZ.CD107a-FLAG, dar nu și BWZ.NKr-P1F-controlul steagului (figura 2B). Clona de anticorpi H4A3, care s-a dovedit a se lega de CD107a umană (16), nu a pătat celulele BWZ transfectate de șobolan CD107a, indicând că nu există nicio reacție încrucișată cu CD107a de șobolan. clona anti-șoarece CD107a ID48 nu a reușit, de asemenea, să coloreze transfectantul CD107a de șobolan. LS-C8580 neconjugat, pe de altă parte, a arătat o colorare specifică a celulelor transfectate CD107a (datele nu sunt prezentate). Cu toate acestea, clona LS-C8580 este disponibilă numai ca anticorp neconjugat care nu este potrivit pentru studiile de degranulare. Încercările repetate din laboratorul nostru de a conjuga LS-C8580 la Alexa488 nu au furnizat, din păcate, conjugați puternici de colorare, deși dimensiunea mică a eșantionului și concentrația LS-C8580 pot fi cauza conjugării slabe. LS-c8580 conjugat prezintă o colorare redusă, dar specifică, a celulelor transfectate CD107a (figura 2b), dar așa cum se arată în figura 2a, nu am putut detecta celulele degranulate în timpul testelor funcționale cu acest conjugat. În concluzie, SIM1 mAb colorează în mod specific celulele NK de șobolan degranulate după stimularea cu celulele țintă.

Figura 2. SIM1 măsoară degranularea din celulele natural killer (NK) și CD8 T. (A) procentul de celule degranulante a fost măsurat folosind anticorpi anti-CD107a SIM1, H4A3 și LS-C8580, cu sau fără celule țintă YAC-1 ca stimul. Este prezentat un experiment reprezentativ din patru (B). Colorarea liniei celulare BWZ. CD107a-FLAG cu clone de anticorpi SIM1, H4A3, LS-C8580 sau ID48. BWZ.36 de celule transfectate cu antigen irelevant marcat cu pavilion (BWZ.NKR-P1G-FLAG) a fost inclus ca un control negativ, (C) celulele NK îmbogățite au fost stimulate cu anti-nkp46, anti-NKr-P1A sau IgG1 de șoarece ca control izotip, iar SIM1 a fost utilizat pentru a măsura procentul de celule degranulate. Celulele NKp46+ (Wen23) sau NKr-P1Abright (3.2.3) au fost închise. (D) celulele TCR+ au fost sortate (Puritate 99%) și cultivate în IL-2 timp de 2-3 zile. Celulele au fost apoi stimulate cu anti-CD3 legat de placă și anti-CD2 sau control izotip IgM de șoarece pentru anti-CD3. Panoul inferior prezintă stimulare cu anti-CD3 și anti-CD2 și colorare cu un control izotip SIM1 (FITC hamster IgG policlonal). Celulele T au fost sortate folosind anticorpi R73-Alexa647 și 3.2.3-PB, închizându− se pe celulele R73+/3.2.3. Datele prezentate provin dintr-un experiment reprezentativ din trei experimente independente separate.
stimularea directă a activării receptorilor NK prin anticorpi legați de plăci este o altă metodă puternică de inducere a degranulării. Pentru a testa clona SIM1 în acest test funcțional, am incubat celule NK îmbogățite pe plăci acoperite cu anticorpi față de receptorii de activare NKp46 și NKR-P1A (figura 2c). Ca martor negativ, plăcile au fost acoperite cu un control izotip IgG1 de șoarece. Colorația cu anticorpul SIM1 a identificat 25,5 sau 44% celule degranulante după stimularea celulelor NK în plăci acoperite cu 5 hectolitri/ml anti-nkp46 sau respectiv anti-NKr-P1A. Procentul de celule degranulante a crescut și mai mult atunci când plăcile au fost acoperite cu o concentrație mai mare de anticorpi stimulatori (10%/ml). Nu a fost indusă degranularea în godeurile acoperite cu controlul izotipului IgG1 de șoarece.
am văzut clar degranularea în celulele NK stimulată fie cu celule țintă, fie cu anticorpi împotriva receptorilor de activare prin utilizarea anticorpului nostru SIM1. De asemenea, am vrut să confirmăm acest lucru în celulele T citotoxice. Celulele T au fost sortate din celulele splinei și cultivate în IL-2 timp de 2-3 zile. Celulele T au fost apoi stimulate cu anti-CD3 și anti-CD2 legate de placă (figura 2D). Degranularea a fost măsurată din celulele T CD8 + cultivate atunci când a fost stimulată cu anti-CD3 și anti-CD2 în ambele zile 2 și 3. Nu a fost măsurată degranularea din celulele T CD4 non-citotoxice sau după stimularea cu anticorpi de control izotip, demonstrând în continuare specificitatea anticorpului nostru SIM1.celulele killer activate de Limfokină (LAK) sunt create prin cultivarea celulelor NK în IL-2 timp de 7-10 zile și sunt utilizate în mod obișnuit ca celule efectoare foarte puternice în testele de eliberare a cromului pentru a studia citotoxicitatea și, prin urmare, ar trebui să poată genera niveluri ridicate de degranulare. Pentru a măsura degranularea din celulele LAK, am folosit inițial un 1:1 raportul efectorului la ținte, dar a constatat niveluri neașteptat de scăzute de degranulare (datele nu sunt prezentate). Cu toate acestea, făcând o titrare pentru a găsi raportul optim efector-țintă, am văzut că nivelurile crescute de degranulare ar putea fi atinse atunci când raportul efector-țintă a fost sub 1 (Figura 3a). Prin urmare, raportul optim pentru testele de degranulare este în contrast cu testele de citotoxicitate în care nivelul citotoxicității crește cu un raport efector: țintă mai mare (figura 3b).
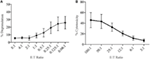
Figura 3. Efector scăzut:rapoartele țintă sunt importante pentru a asigura o sensibilitate adecvată în testele de degranulare cu celule NK de șobolan. (A) degranularea celulelor LAK cultivate 8-10 zile în IL-2 împotriva țintelor YAC-1 la diferite raporturi efector:țintă. (B) citotoxicitatea LAK cultivată cu IL-2 împotriva celulelor țintă YAC-1 a fost confirmată prin testul de eliberare a cromului finalizat în zilele 8-10. Toate graficele sunt cumulative de trei sau mai multe experimente separate cu bare care arată SD.
discuție
în testarea inițială a SIM1 și a diferiților anticorpi CD107a comerciali în testele de degranulare la șobolan, am ales o gamă mică de raporturi efector la țintă, cu o înclinare spre mai multe celule efectoare decât țintele pe baza literaturii actuale (12, 16, 17). Raporturile efector la celule țintă pot varia de la hârtie la hârtie, dar studiile anterioare care au titrat raporturile efector la țintă au arătat că degranularea optimă de la celulele NK de șoarece a atins un raport de 4,5:1 cu celulele țintă YAC-1 (18) și celulele NK umane au ucis celulele K562 cel mai bine la un raport de 5: 1:1 (12). Cu toate acestea, atunci când se utilizează o gamă mai mare de raporturi efector la țintă, arătăm că degranularea folosind celule Lak de șobolan a fost indusă mai eficient atunci când se utilizează patru sau mai multe ținte pe celulă efectoare. Această diferență în raportul optim efector: țintă între șobolan și alte specii s-ar putea datora tipului de celule țintă utilizate, deoarece titrările raportului efector la om și șoarece în studiile menționate mai sus au utilizat celule țintă care provin din aceeași specie. Celulele efectoare ar putea fi mai sensibile la celulele țintă din aceeași specie și, prin urmare, au nevoie de mai puține celule țintă pentru a se activa. Linia celulară YAC-1 utilizată în studiul nostru este un limfom cu celule T de șoarece, care a fost standardul de mulți ani pentru a stimula citotoxicitatea din celulele NK de șobolan. Nu putem exclude faptul că utilizarea unei celule țintă de șobolan ar duce la o stimulare mai puternică a celulelor NK și, ulterior, ar putea fi necesare mai puține celule țintă pentru a induce degranularea.
de asemenea, este clar din acest studiu că raportul efector-țintă utilizat pentru testele de citotoxicitate nu se corelează bine cu raportul necesar pentru a măsura răspunsul optim de degranulare în celulele efectoare. Acest lucru nu este surprinzător, deoarece citirile pentru aceste două teste sunt diferite, citotoxicitatea măsurând moartea celulelor țintă și degranularea măsurând răspunsul NK la ținte.
În concluzie, am crescut un anticorp împotriva șobolanului CD107a (SIM1) și i-am caracterizat capacitatea de a detecta degranularea în limfocitele citotoxice la șobolan. Am arătat că SIM1 este specific celulelor degranulatoare, iar prin optimizarea Protocolului de degranulare, am stabilit că utilizarea raporturilor efector:celule țintă mai mici de 1:4 asigură stimularea optimă a celulelor LAK. Dezvoltarea CD107a Anti-șobolan (SIM1) permite o mai bună analiză și caracterizare a răspunsurilor citotoxice ale limfocitelor de șobolan și va fi un instrument valoros în numeroasele modele de boală ale șobolanului.
declarație de etică
studiul este aprobat de Autoritatea Națională de cercetare a animalelor (FDU), Norvegia (numărul permisului: ID-1698).
contribuțiile autorului
AS a fost responsabil pentru analiza expresiei, testele funcționale și scrierea manuscrisului. K-ZD a efectuat clonarea ADNc și generarea de transfectanți. JTV a fost implicat în planificarea și supravegherea proiectului și în scrierea manuscrisului. LK a fost responsabil pentru imunizări, tehnologia hybridoma, scrierea manuscrisului și supravegherea proiectului.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
autorii mulțumesc Ulla Heggelund și Stine Martinsen pentru asistență tehnică în laborator, și personalul de la facilitatea de animale de la Departamentul de Medicina comparata la Rikshospitalet, Spitalul Universitar din Oslo pentru ajutor cu imunizări. Datorită Marit Inngjerdingen pentru discuții științifice.
finanțare
cercetarea a fost finanțată de Universitatea din Oslo, sud-estul Norvegiei sănătate Regională (2009104), și Legatet til Henrik Homans Minde.
1. Portocaliu JS. Formarea și funcția sinapsei imunologice a celulelor litice NK. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038 / nri2381
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ și colab. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, și colab. Porii perforinei din membrana endozomală declanșează eliberarea granzimei B endocitozate în citosolul celulelor țintă. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforină și granzime: funcție, disfuncție și patologie umană. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT și colab. Un al doilea transplant profilactic MHC-mismatched de măduvă osoasă protejează împotriva leucemiei mieloide acute de șobolan (BNML) fără boală letală grefă-contra-gazdă. Transplant (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Onishi M, Kinoshita s, Morikawa Y, Shibuya A, Phillips J, Lanier LL și colab. Aplicații ale clonării expresiei mediate de retrovirus. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Reducerea degranulării celulelor NK la pacienții cu herpes recurent frecvent. Vaccin Clin Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, lemn SM, BJ Unixtrkstr NK NK, Long eo, și colab. Analiza funcțională a celulelor NK umane prin citometrie în flux. Metode Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
