sistem îmbunătățit de cultivare continuă la scară mică
în acest studiu, prezentăm progrese suplimentare și posibilități de aplicare a unui sistem de cultivare continuă la scară mică, dezvoltat anterior de Klein și colab. , pentru un grad sporit de paralelizare și o manipulare îmbunătățită, precum și monitorizarea reactoarelor individuale. Aspectele cheie ale modificărilor aduse sistemului cuprind o creștere a setului de vase de cultură paralele de la 8 la 24 de reactoare și o scădere a volumului de lucru de la 10 la 6,5 mL. Sistemul actual constă în plus din capace personalizate care adăpostesc patru porturi fixe utilizate pentru aerare, alimentare cu medii, îndepărtarea bulionului, precum și inoculare sau prelevare de probe (Fig. 1). Pe lângă cele patru porturi, o sondă do în formă de tijă optică este introdusă prin capac pentru monitorizarea DO fără a perturba procesul de cultivare și, în acest fel, înlocuind locul senzorului fluorescent de oxigen al configurației anterioare . Baia de apă, care în configurația anterioară a menținut o temperatură constantă de cultivare, a fost înlocuită cu un bloc de încălzire din aluminiu personalizat, care este fuzionat cu o unitate de agitator microplacă. Deoarece versiunea anterioară a sistemului bioreactor la scară mică a fost validată folosind drojdia de fisiune Schizosaccharomyces pombe, prezentăm aici configurația îmbunătățită de cultivare pentru culturile S. cerevisiae.
etapele operaționale de bază, precum și ajustările ratelor de diluare prin selectarea diametrului adecvat al tubului și a ratei de pompare a pompei de influx media, au fost efectuate conform descrierii anterioare . Aici, greutatea conținutului de lichid al fiecărui bioreactor a fost determinată gravimetric la sfârșitul cultivării, permițând calcularea precisă a ratei de diluare respective cu un 5.1% abatere. Bulionul de cultură și faza gazoasă a reactorului au fost îndepărtate prin același orificiu al capacului reactorului cu ajutorul pompei de eflux (Fig. 1). Pentru toate experimentele de cultivare au fost utilizate rate ale pompei de eflux de 7,5 mL min−1. Viteza pompei de eflux a depășit cu mult viteza pompei de alimentare, generând o ușoară presiune negativă în interiorul vasului de cultură. Această diferență de presiune a dus la fluxul de aer prin orificiul de aerare. Coeficientul mediu de transfer al masei de oxigen KLA obținut a fost de 110 h−1, ceea ce a permis niveluri DO cu mult peste 30% saturație pe tot parcursul procesului de cultivare. PH-ul nu a fost monitorizat online și nici controlat în timpul cultivării, deoarece mediul a fost ajustat a priori la un pH de 6,0, ceea ce a dus la un pH final de 5,5 în bulionul de cultivare. PH-ul a fost măsurat zilnic la linia de ieșire a reactoarelor și după recoltare. PH-ul a rămas constant imediat ce starea de echilibru a fost atinsă și efluentul reactorului a arătat o abatere minoră de 0,1 unități de pH (datele nu sunt prezentate).
explorarea producției de 3 CP în chimiostatice la scară mică, la rate de diluare diferite în condiții de limitare a C
pentru a determina rata maximă specifică de creștere (cerevisiae st938), S. cerevisiae ST938 a fost cultivată în condiții de lot, aplicând disponibilitatea excesivă a nutrienților. Utilizând glucoza ca sursă de carbon, valoarea de 0,265 h−1, randamentul de biomasă a fost de 24,9 g mol−1, iar randamentul de carbon de 3 CP pe glucoză a fost de 0,6% C-mol (Tabelul 1). În acest mod de cultivare, cea mai mare parte a carbonului a fost metabolizată în etanol și CO2 , ca fluxuri glicolitice ridicate în tipul sălbatic S. cerevisiae sunt puternic legate de fermentația alcoolică . Culturile de Chemostat sunt controlate prin furnizarea unui substrat care limitează creșterea. La starea de echilibru, S. cerevisiae de tip sălbatic nu produce cantități semnificative de metaboliți de preaplin sub o anumită rată de creștere, marcând viteza critică de diluare [Dcrit (h−1)] din cauza lipsei de acumulare a sursei de carbon. La sau peste această rată critică de diluare sursa de carbon se acumulează în reactor și se declanșează metabolismul de preaplin, rezultând producerea de diverse subproduse, cum ar fi etanol, acetat și cantități minore de acizi organici . În consecință, culturile continue au fost utilizate pentru a investiga relația dintre rata de creștere și formarea produsului de 3 CP specific biomasei în S. cerevisiae ST938. Cele patru rate diferite de diluție D (h−1): 0,04, 0,09, 0,17 și 0,21 au fost alese pentru a fi mai mici decât valorile minime maxime ale tulpinii S. cerevisiae st938 determinate în cultivarea pe loturi. Au fost investigate randamentul biomasei pe glucoză, precum și randamentul de 3 CP, rata specifică de producție de 3 CP și rata specifică de absorbție a substratului (Fig. 2a-d, Tabelul 1). Toți parametrii relevanți de cultivare, adică randamentele și ratele cu abaterile standard respective, sunt rezumați în tabelul 1.

Selected rates and yields for C-limited aerobic chemostat cultivations of S. cerevisiae ST938 a 3-HP yield (C-mol C-mol−1) on glucose, b biomass yield on glucose (g mol−1), c specific 3-HP production rate (mmol gCDW−1 h−1) and d specific glucose uptake rate (mmol gCDW−1 h−1) at different dilution rates for S. cerevisiae ST938. Cultivations were carried out in triplicates at 30 °C and pH 5.5 under C-limited conditions. Erorile corespund abaterilor standard derivate din culturile triplicate
cultivarea S. cerevisiae ST938 în condiții de limitare C a arătat o trecere de la metabolismul predominant fermentativ observat în modul lot la un metabolism respirator în chimiostatice, care se reflectă în randamente mai mari de biomasă, precum și în formarea neglijabilă de etanol și glicerol (Tabelul 1). În plus, cantități minore de glucoză reziduală sub 0.S-au detectat 1 mM în probele prelevate din efluxul diferitelor reactoare, verificând că culturile sunt limitate la glucoză. Condițiile limitate de Carbon găsite în culturile de chemostat la starea de echilibru păreau să promoveze formarea de 3 CP, deoarece randamentele acestui produs au fost de 20 până la 25 de ori mai mari decât randamentul determinat în cultura lotului (Tabelul 1). Acest lucru se datorează cel mai probabil conversiei mai eficiente a carbonului în energie sub formă de ATP în timpul respirației în comparație cu fermentarea în culturile de lot. Interesant, cultivările lui S. cerevisiae ST938 în condiții de limitare C a arătat că, odată cu scăderea ratelor specifice de creștere, s-a observat o creștere constantă a randamentelor de carbon de 3 CP, cu cel mai mare randament de 3 CP de 16,6% c-mol observat la o rată de diluare de 0,04 h-1 (Fig. 2a). Randamentul de 3 CP pe biomasă este de zece ori mai mare decât randamentul în culturile de lot și a crescut mai mult de două ori de la 0,19 la 0,43 g gCDW−1 prin scăderea ratei de diluare de la 0,21 la 0,04 h−1 (Tabelul 1). Productivitatea specifică maximă pentru 3 CP de aproximativ 0,50 mmol gCDW−1 h−1 a fost observată la viteze de diluare de 0,17 și 0.21 h−1, Care este de aproximativ patru ori mai mare decât cea măsurată în culturile loturilor (Fig. 2c, Tabelul 1). Așa cum era de așteptat, rata specifică de absorbție a glucozei (qS) a crescut cu rate de diluare mai mari de la 0, 51 la 2, 1 mmol gCDW−1 h−1 (Fig. 2d). Aceste valori sunt de până la 20 de ori mai mici decât rata maximă specifică de absorbție a glucozei, de 10,7 mmol gCDW-1 h−1, observată la doza de xixtxmax în condiții de creștere cu limite de glucoză în modul lot (Tabelul 1). Valorile obținute pentru rata specifică de absorbție a substratului și randamentul biomasei la o rată de diluare de 0.09 h-1 (Tabelul 1) au fost în concordanță cu datele obținute din culturile de chimiostat cu S. cerevisiae de tip sălbatic la o rată de diluare de 0,10 h−1, indicând 1,1 și 1,25 mmol gCDW−1 h−1, precum și 0,49 G G−1, respectiv . S-a constatat că randamentul biomasei pe substrat crește odată cu creșterea ratelor de diluare, cu toate acestea, pentru S. cerevisiae de tip sălbatic, acest parametru este în general constant sub Dcrit, atâta timp cât metabolismul de întreținere constituie o chiuvetă considerabilă de carbon care reduce randamentul biomasei la rate de diluare scăzute . În cazul lui S. cerevisiae tulpina ST938, cu toate acestea, se părea că carbonul, care nu era îndreptat spre formarea biomasei, contribuie într-o oarecare măsură la formarea atât a 3-CP, cât și a subproduselor.
pentru a concluziona, diferențele experimentate în culturile continue la rate de diluare diferite, precum și în comparație cu set-up-uri similare cu S. cerevisiae de tip sălbatic sugerează că calea biosintetică integrată pentru a produce 3-HP are un impact extraordinar asupra fiziologiei drojdiei, care este probabil amplificată de răspunsurile adaptive la stres. În cele din urmă, cultivarea chimiostatului limitată de C la cea mai mică rată de diluare de 0.04 h-1 a avut ca rezultat cel mai mare randament de carbon de 3 CP.
investigarea limitării azotului și fosfatului pentru creșterea randamentelor de 3 CP în culturile de chimiostat la scară mică
după caracterizarea S. cerevisiae ST938 în condiții de limitare a C, s-au efectuat cultivări în condiții de limitare a azotului și fosfatului, deoarece acestea s-au dovedit anterior favorabile pentru producerea diferiților metaboliți nativi și non-nativi în diferite organisme . Aici, cultivările corespunzătoare sub limitarea azotului (N) și fosforului (P) au fost investigate în sistemul de cultivare continuă la scară mică (Fig. 1) cu o rată de diluare setată de 0,04 h−1, care a avut ca rezultat anterior cel mai mare randament de carbon de 3 CP în condiții limitate de C (Tabelul 1). Parametrii și abaterile standard respective de la cultivările limitate N și P ale tulpinii de drojdie ST938 sunt rezumate în tabelul 2.
pentru condiții de cultivare limitate de N și P, nu s – au detectat amoniu rezidual sau fosfat în probele prelevate din efluxul diferiților reactori, verificând culturile care trebuie limitate în raport cu limitarea corespunzătoare a substratului (Tabelul 2). Cu toate acestea, au fost detectate cantități minore de glucoză reziduală în intervalul 0,63 și 0,19 mM în limitele N și P (Tabelul 2). În timpul limitării C, nivelurile reziduale de glucoză au fost mult sub 0,1 mM (Tabelul 2). Cultivările care aplică limitări de N și P au evidențiat un randament de 3 CP de 17,7 și respectiv 21,1% c-mol, afișând o valoare semnificativ mai mare în condiții limitate de P comparativ cu randamentul de 3 CP de 16,6% c-mol calculat pentru condiții de cultivare limitate de C (tabelele 1, 2). În mod similar, productivitatea specifică pentru 3-HP a fost semnificativ crescută pentru cultivările limitate N și P, dezvăluind valori de 0,22 și 0,23 mmol gCDW – 1 h-1 în comparație cu 0,17 mmol gcdw−1 h−1 atinse în culturile limitate C. Mai mult, randamentele de 3 CP pe biomasă au arătat valori comparabile de 0,43 și 0.44 g gCDW−1 pentru condițiile de limitare a C și N, cu toate acestea, în cazul limitării P, S – a observat un randament crescut de 0,50 g gCDW-1. Datorită concentrațiilor globale scăzute de subproduse cuantificate, acestea sunt neglijabile (Tabelul 2). Valorile pentru rata specifică de absorbție a substratului (qS) pentru limitarea C și P au fost comparabile și s – a obținut o valoare ușor crescută de 0,61 mmol gCDW-1 h−1 în condiții limitate de N. Randamentele de biomasă pe substrat au evidențiat pentru condiții limitate de N și P valori similare de 72,4 și respectiv 75,2 g mol−1. Comparativ cu randamentul biomasei de 78.4 g mol – 1 realizat în condiții limitate C, aceste valori sunt similare. Studiul nostru susține rațiunea că randamentele mai mari ale produselor pe substrat au fost obținute în condiții de limitare a N și P. În consecință, se pare că o rată de absorbție specifică mai mare a substratului în cazul limitării N, combinată cu formarea minimă a subproduselor, a favorizat în cele din urmă formarea produsului. În condiții de limitare a P s-au format cele mai mici cantități de subproduse, ceea ce ar putea favoriza sinteza produsului. Se poate specula în continuare că unele modificări metabolice pot duce la o cantitate redusă de carbon eliberată sub formă de CO2.
în rezumat, cultivările de chimiostat sub limitarea N și P au evidențiat randamente crescute de 3 CP și rate de producție specifice în comparație cu condițiile limitate C, limitarea P permițând cele mai mari randamente ale produselor.
transferabilitatea parametrilor fiziologici măsurați în chimiostatice la scară mică la culturile cu lot alimentat în bioreactori de 1-L în condiții de limitare C și P
deoarece acest studiu a urmărit în continuare evaluarea transferabilității și comparabilității parametrilor fiziologici măsurați în diferite condiții de cultivare, parametrii de cultivare obținuți din condițiile de limitare C și P determinate în culturi de chemostat au fost transferați la reactoarele de 1-l cu masă agitată care funcționează în modul lot alimentat. Conceptul acestei abordări a fost, prin urmare, de a menține condițiile cheie și parametrii constanți pentru culturile de chemostat și lot hrănit pentru a asigura comparabilitatea. Aceste condiții au cuprins (i) același raport C:P aplicat în cultivările de chemostat limitator de P, (ii) condițiile de proces identice, cum ar fi pH-ul și temperatura și (iii) aceleași rate de creștere specifice aplicate în chemostate, obținute printr-un profil de alimentare exponențial. Pentru a optimiza titrul produsului, parametrii cu randamentul maxim al produsului pe substrat din experimentele cu chemostat (D = 0.04 h−1) sub C – și p-limitare au fost alese pentru transferul la sistemul Fed-lot. Datorită restricțiilor tehnice din cadrul configurației, s-au efectuat cultivări pe loturi hrănite la o rată de creștere de 0,05 h−1, Care este ușor mai mare comparativ cu rata de diluare stabilită de 0,04 h−1 la cultivările cu chimiostat. Cultivarea loturilor hrănite a constat într-o fază inițială a lotului pentru a genera biomasă urmată de o fază de hrănire exponențială, limitată de nutrienți, pentru a controla rata de creștere. Numai faza de hrănire a fost considerată relevantă pentru evaluarea transferabilității parametrilor obținuți din sistemul de cultivare continuă, deoarece numai în această fază concentrația substratului controla și astfel limita creșterea microbiană. Profilele de cultivare a loturilor hrănite ale S. cerevisiae ST938 care aplică condițiile de limitare a C și P sunt prezentate în Fig. 3, iar parametrii de cultivare corespunzători cu abaterea standard respectivă sunt rezumați în tabelul 3.
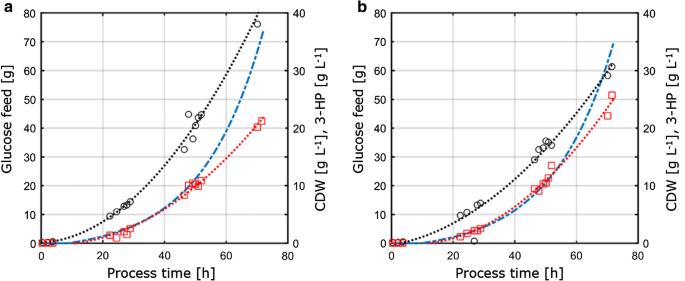
cultivare aerobă în 1-l fermentatoare de S. cerevisiae ST938 folosind o rampă de alimentare exponențială la D = 0,05 h-1 cu substratul limitativ a carbon sau B fosfor. Cercurile negre se referă la titrul de biomasă, pătratele roșii la titrul de 3 CP și linia punctată albastră la cantitatea absolută de glucoză alimentată la reactoare
producția de biomasă observată în culturile loturilor hrănite a fost de 77,9 și 67,7 g mol-1 pentru limitarea C și, respectiv, P. Randamentul biomasei pentru cultivările limitate în C a fost comparabil între operațiile cu chemostat și cu lotul hrănit, în timp ce pentru limitarea P S-a observat o ușoară scădere a randamentului de biomasă în timpul funcționării lotului hrănit (tabelele 2, 3), care se încadrează în abaterile standard observate pentru ambele randamente de biomasă. Randamentul de carbon pe substrat pentru 3 CP a fost de 15,9% pentru limitarea C, ceea ce este aproape identic în comparație cu valoarea calculată în sistemul chemostat (Fig. 4a). Randamentele de 3 CP determinate în acest studiu sunt în continuare în strânsă concordanță cu un randament de carbon pe substrat de 14% obținut în studiile anterioare cu lot alimentat cu C limitat la pH 5,0 cu o tulpină de S. cerevisiae proiectată pentru a utiliza calea de alanină-alinină și de 13% cu un S. cerevisiae utilizând calea dependentă de malonil-CoA reductază . În studiile cu Escherichia coli s-au determinat randamente mai mari de carbon de 3 CP pe substrat pe calea alanină-al-xqua, care au indicat o valoare de 42% în culturile pe loturi hrănite pe glucoză .

compararea parametrilor de cultivare sub diferite limitări determinate în chimiostatice la scară mică și reactoare bench-top 1-L în modul lot alimentat. un randament de carbon de 3 CP (%C-mol) și B randament de 3 CP pe biomasă (g gCDW-1). Erorile corespund abaterilor standard derivate din cultivările triplicate
pentru condițiile de limitare a P, cu toate acestea, studiul nostru a evidențiat o creștere considerabilă a randamentului de carbon de 3 CP de 25,6% (Fig. 4a). Randamentele observate de 3 CP pe biomasă au fost de 0,38 și 0,65 g gCDW – 1 pentru condițiile de limitare a C și, respectiv, P. Pentru limitarea C aceasta a confirmat valorile observate în setul de chemostat (Fig. 4b). Datorită creșterii randamentului de 3 CP pe substrat în condiții de limitare a P și scăderii ușoare a randamentului de biomasă pe substrat în același timp, randamentul de 3 CP pe biomasă a fost semnificativ crescut comparativ cu experimentul cu chemostat. Spre deosebire de cultivările efectuate în chimiostatice, nu a fost detectată o acumulare semnificativă de etanol sau glicerol în cultivările cu lot hrănit. Un bilanț închis al carbonului pentru condițiile de limitare a C și P a indicat faptul că nu s-au format cantități relevante de alte (sub)produse (Tabelul 3). Această diferență în spectrul subprodus ar putea explica creșterea randamentului de 3 CP pe glucoză.
în comparație cu culturile efectuate în chimiostatice, ratele specifice de absorbție a glucozei determinate în culturile loturilor hrănite prezintă valori considerabil mai mari de 0,75 și 0,77 mmol gCDW-1 h−1 pentru condițiile de limitare a C și, respectiv, P. După cum s−a menționat mai sus, punctul de referință pentru factorul exponențial al profilului furajului a fost stabilit la 0,05 h−1 și a variat până la 0,059 h-1, rezultând o rată de creștere specifică cu 30-45% mai mare în cultivările loturilor hrănite comparativ cu experimentele cu chemostat cu 0.04 h – 1 (Tabelul 3), determinând creșterea ratelor specifice de absorbție a glucozei. Cu toate acestea, pentru fermentațiile limitate de C, randamentul biomasei pe glucoză a fost comparabil între chemostat și cultivarea loturilor hrănite. În mod similar, ratele specifice de producție de 3 CP au fost crescute în cultivările cu loturi hrănite, cu 0,24 mmol gCDW-1 h-1 și, respectiv, 0,38 mmol gCDW−1 h−1. Randamentele de 3 CP pe substrat au fost comparabile între chemostat și cultivarea loturilor hrănite, sugerând că randamentele sunt un parametru de cultivare robust, rezistent la perturbații induse de fluctuații mai mici în configurația de cultivare. Nu s-au detectat fosfați reziduali, precum și glucoză în probele prelevate din diferitele reactoare pentru condiții de limitare a P, confirmând că culturile sunt limitate în ceea ce privește limitarea corespunzătoare. În mod similar, pentru limitarea C nu a fost detectată glucoză reziduală în probe.
îmbunătățirile prezentate aici ale unui sistem de chemostat la scară mică, dezvoltat anterior de Klein și colab. , a cuprins, printre altele, o creștere a numărului de reactoare la 24 și o reducere a volumului de cultivare la 6,5 mL. Acest grad crescut de paralelizare face ca sistemul să fie un instrument adecvat de screening cu randament ridicat, deoarece diferite sisteme de chemostat comparabile la scară mică funcționează cu volume de lucru mai mari și cu un număr mai mic de reactoare: sistemul bioreactor continuu scuturat paralel (CosBios) utilizează șase, respectiv opt vase de cultură paralele cu un volum de cultură de 20-25 mL . Sistemul bioreactor cu rezervor agitat modificat de unică folosință (bioREACTOR, 2MAG AG) funcționează cu opt reactoare paralele la un volum de lucru de 10 mL . Sistemul mini-chemostat (MC) dezvoltat de Bergenholm și colab. cuprinde 16 reactoare paralele și necesită un volum de lucru de 40 mL. Prin urmare, sistemul nostru este bine aplicabil pentru screeningul simplu și rentabil al performanței microbiene în modul continuu. Cu toate acestea, ar putea fi relevant pentru extinderea în continuare a sistemului prin monitorizarea parametrilor suplimentari, cum ar fi gazele de eșapament, pentru a permite o analiză detaliată a distribuției carbonului, care are o importanță deosebită pentru caracterizările fiziologice ale tulpinilor.
deoarece studiul nostru a sugerat că limitarea N și P este favorabilă pentru formarea de 3 CP în S. cerevisiae, experimentele viitoare ar putea implica screening – ul suplimentar al ratelor de creștere cu limitarea N și P aplicată pentru a găsi producția optimă de 3 CP cu fiecare limitare respectivă. Studiul nostru a arătat în continuare transferabilitatea parametrilor fiziologici de la chimiostat la cultivarea loturilor hrănite. Acest lucru consideră că este fezabil numai dacă nu se acumulează compuși toxici sau inhibitori în timpul cultivării lotului hrănit, deoarece parametrii fiziologici s-ar schimba în timp și s-ar abate de la parametrii dobândiți în chemostate. Ca abordare generală, experimentele cu chemostat pot servi ca instrument pentru investigarea influenței unui potențial compus toxic sau inhibitor prin adăugarea substanței în furajul propriu-zis. Deoarece toți ceilalți parametri sunt constanți, influența compusului și concentrația acestuia pot fi evaluate și evaluate direct. În studiul nostru, nu a fost detectată nicio formare de produs secundar în cultivările loturilor hrănite și a fost indus un răspuns la stres probabil similar datorită acizilor slabi, ceea ce a permis condițiilor fiziologice din chemostatele la scară mică să semene cu cele din Condițiile lotului hrănit.
în rezumat, acest studiu a arătat că conceptul de condiții de limitare a C și P pentru producția de 3 CP a fost investigat într – un nou sistem paralelizat de cultivare a chimiostatului și ar putea fi transferat cu succes la bioreactoarele de 1-L care funcționează în modul de lot alimentat. Prin urmare, parametrii fiziologici dobândiți în chemostate pot fi utilizați pentru proiectarea și evaluarea performanței cultivărilor loturilor hrănite folosind parametri bazați pe randament pentru configurarea procesului.
