electronegativitatea și polaritatea legăturii
deși am definit legătura covalentă ca partajare a electronilor, electronii dintr-o legătură covalentă nu sunt întotdeauna împărțiți în mod egal de cei doi atomi legați. Cu excepția cazului în care legătura conectează doi atomi ai aceluiași element, va exista întotdeauna un atom care atrage electronii din legătură mai puternic decât celălalt atom, așa cum se arată în figura 4.3 „legături covalente polare versus nepolare”. Atunci când apare un astfel de dezechilibru, există o acumulare rezultată a unei sarcini negative (numită sarcină negativă parțială și desemnată ca fiind de pe o parte a obligațiunii−) și a unei sarcini pozitive (desemnată ca fiind de pe cealaltă parte a obligațiunii-de pe cealaltă parte a obligațiunii. O legătură covalentă care are o partajare inegală a electronilor, ca în partea (b) din Figura 4.3 „legături covalente polare versus nepolare”, se numește a Legătură covalentă covalentă polarăo legătură covalentă cu o distribuție neechilibrată a electronilor pe legătură.. O legătură covalentă care are o împărțire egală a electronilor (partea (A) din Figura 4.3 „legături covalente polare versus nepolare”) se numește legătură covalentă nepolarăo legătură covalentă cu o distribuție echilibrată a electronilor pe legătură..
figura 4.3 legături covalente polare versus nepolare
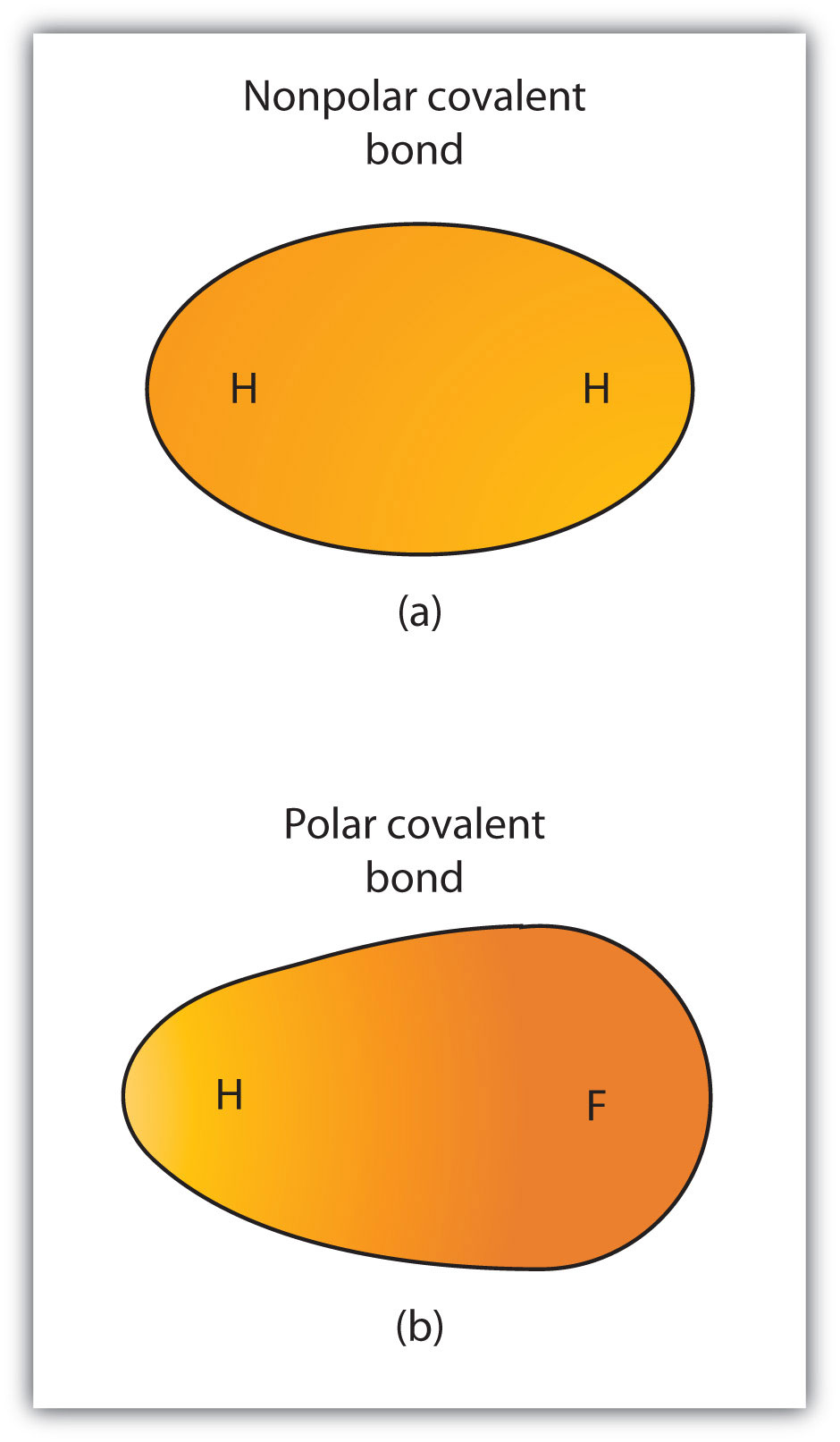
(a) electronii din legătura covalentă sunt împărțiți în mod egal de ambii atomi de hidrogen. Aceasta este o legătură covalentă nepolară. (b) atomul de fluor atrage electronii din legătură mai mult decât atomul de hidrogen, ducând la un dezechilibru în distribuția electronilor. Aceasta este o legătură covalentă polară.
orice legătură covalentă între atomii diferitelor elemente este o legătură polară, dar gradul de polaritate variază foarte mult. Unele legături între diferite elemente sunt doar minim polare, în timp ce altele sunt puternic polare. Legăturile ionice pot fi considerate ultima în polaritate, electronii fiind transferați mai degrabă decât împărțiți. Pentru a judeca polaritatea relativă a unei legături covalente, chimiștii folosesc electronegativitateo măsură relativă a cât de puternic un atom atrage electroni atunci când formează o legătură covalentă., care este o măsură relativă a cât de puternic atrage un atom electroni atunci când formează o legătură covalentă. Există diferite scale numerice pentru evaluarea electronegativității. Figura 4.4″ electronegativitățile diferitelor elemente ” arată una dintre cele mai populare—scara Pauling. Polaritatea unei legături covalente poate fi judecată prin determinarea diferenței de electronegativități a celor doi atomi care fac legătura. Cu cât este mai mare diferența de electronegativități, cu atât este mai mare dezechilibrul partajării electronilor în legătură. Deși nu există reguli dure și rapide, regula generală este dacă diferența de electronegativități este mai mică de aproximativ 0,4, legătura este considerată nepolară; dacă diferența este mai mare de 0,4, legătura este considerată polară. Dacă diferența de electronegativități este suficient de mare (în general mai mare de aproximativ 1,8), compusul rezultat este considerat ionic mai degrabă decât covalent. O diferență de electronegativitate de zero, desigur, indică o legătură covalentă nepolară.
Figura 4.4 electronegativități ale diferitelor elemente
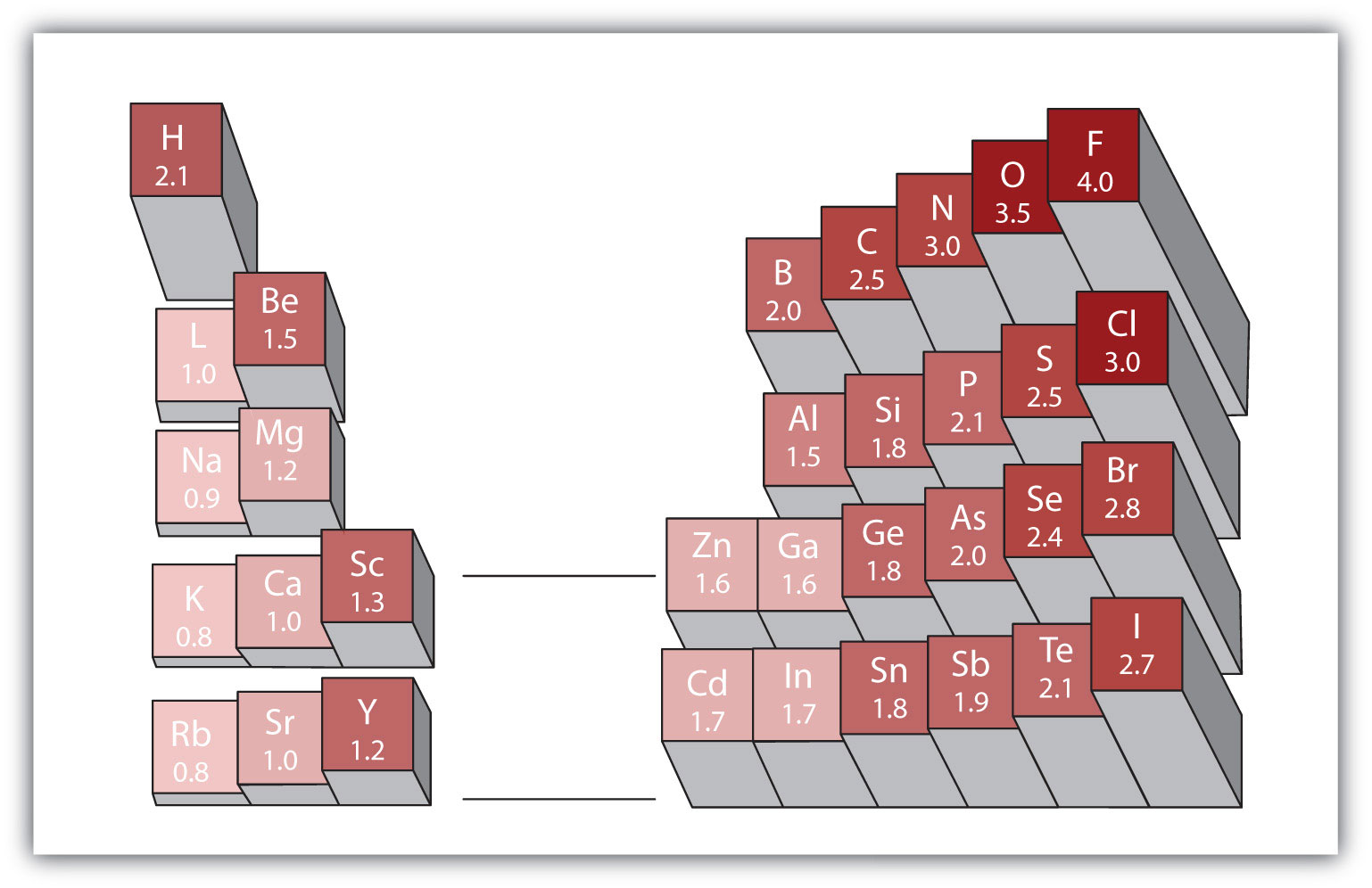
o scară populară pentru electronegativități are valoarea pentru atomii de fluor setată la 4,0, cea mai mare valoare.
privind mai aproape: Linus Pauling
probabil cel mai influent chimist al secolului 20, Linus Pauling (1901-94) este singura persoană care a câștigat două Premii Nobel individuale (adică nepartajate). În anii 1930, Pauling a folosit noi teorii matematice pentru a enunța unele principii fundamentale ale legăturii chimice. Cartea sa din 1939 natura legăturii chimice este una dintre cele mai semnificative cărți publicate vreodată în chimie.până în 1935, interesul lui Pauling s-a îndreptat către moleculele biologice și a primit Premiul Nobel pentru Chimie din 1954 pentru munca sa asupra structurii proteinelor. (El a fost foarte aproape de a descoperi structura dublu helix a ADN-ului când James Watson și James Crick au anunțat propria lor descoperire a structurii sale în 1953. Ulterior a primit Premiul Nobel pentru Pace din 1962 pentru eforturile sale de a interzice testarea armelor nucleare.în ultimii săi ani, Pauling a devenit convins că dozele mari de vitamina C ar preveni bolile, inclusiv răceala obișnuită. Majoritatea cercetărilor clinice nu au reușit să arate o legătură, dar Pauling a continuat să ia doze mari zilnic. A murit în 1994, după ce a petrecut o viață întreagă stabilind o moștenire științifică pe care puțini o vor egala vreodată.

Linus Pauling a fost unul dintre cei mai influenți chimiști ai secolului 20.
exemplul 6
descrieți diferența de electronegativitate dintre fiecare pereche de atomi și polaritatea rezultată (sau tipul de legătură).
- C și H
- H și H
- Na și Cl
- o și H
soluție
- carbonul are o electronegativitate de 2,5, în timp ce valoarea pentru hidrogen este de 2,1. Diferența este de 0,3, ceea ce este destul de mic. Prin urmare, legătura C–H este considerată nepolară.
- ambii atomi de hidrogen au aceeași valoare de electronegativitate—2.1. Diferența este zero, deci legătura este nepolară.electronegativitatea sodiului este de 0,9, în timp ce cea a clorului este de 3,0. Diferența este de 2,1, care este destul de mare, astfel încât sodiul și clorul formează un compus ionic.
- cu 2,1 pentru hidrogen și 3,5 pentru oxigen, diferența de electronegativitate este de 1,4. Ne–am aștepta la o legătură foarte polară, dar nu atât de polară încât legătura O-H este considerată Ionică.
exercițiu de construire a abilităților
-
C și O
-
K și Br
-
N și N
-
Cs și f
descrieți diferența de electronegativitate dintre fiecare pereche de atomi și polaritatea rezultată (sau tipul de legătură).
când legăturile unei molecule sunt polar, molecula în ansamblu poate afișa o distribuție inegală a sarcinii, în funcție de modul în care sunt orientate legăturile individuale. De exemplu, orientarea celor două legături O–H într-o moleculă de apă (figura 4.5 „proprietăți fizice și polaritate”) este îndoită: un capăt al moleculei are o sarcină pozitivă parțială, iar celălalt capăt are o sarcină negativă parțială. Pe scurt, molecula în sine este polară. Polaritatea apei are un impact enorm asupra proprietăților sale fizice și chimice. (De exemplu, punctul de fierbere al apei este ridicat pentru o moleculă atât de mică și se datorează faptului că moleculele polare se atrag puternic.) În schimb, în timp ce cele două legături C=O din dioxidul de carbon sunt polare, ele se află direct una față de cealaltă și astfel își anulează reciproc efectele. Astfel, moleculele de dioxid de carbon sunt nepolare în general. Această lipsă de polaritate influențează unele dintre proprietățile dioxidului de carbon. (De exemplu, dioxidul de carbon devine un gaz la -77 centimetric C, cu aproape 200 de centimetric mai mic decât temperatura la care fierbe apa.)
figura 4.5 proprietățile fizice și polaritatea

proprietățile fizice ale apei și dioxidului de carbon sunt afectate de polaritățile lor.
exerciții de revizuire a conceptului
-
care este numele distanței dintre doi atomi într-o legătură covalentă?
-
ce indică electronegativitatea unui atom?
-
ce tip de legătură se formează între doi atomi dacă diferența de electronegativități este mică? Mediu? Mare?
răspunsuri
-
lungimea legăturii
-
electronegativitatea este o măsură calitativă a cât de mult un atom atrage electroni într-o legătură covalentă.
-
nepolar; polar; ionic
legături covalente între diferiți atomi au lungimi diferite de legătură.
exerciții
-
care este mai lung—o legătură C–H sau o legătură C–O? (A se vedea tabelul 4.2 „lungimi aproximative ale unor legături simple”.)
-
care este mai scurtă—o legătură N–H sau o legătură C–H? (A se vedea tabelul 4.2 „lungimi aproximative ale unor legături simple”.)
-
un nanometru este de 10-9 m. folosind datele din tabelul 4.2 „lungimi aproximative de legătură ale unor legături simple” și Tabelul 4.3 „Compararea lungimilor legăturii pentru legături simple și Multiple”, determinați lungimea fiecărei legături în nanometri.
- o legătură C–o
- o legătură C=O
- o legătură H–N
- o legătură C-N
-
un angstrom (XV) este definit ca 10-10 m. folosind tabelul 4.2 „lungimi aproximative ale unor legături simple” și tabelul 4.3 „Compararea lungimilor legăturilor pentru legături simple și Multiple”, determinați lungimea fiecărei legături în angstromi.
- o legătură C–C
- o legătură C=C
- o legătură n–o
- o legătură H-O
-
consultați Exercițiul 3. De ce este util unitatea nanometrică ca unitate pentru exprimarea lungimilor legăturii?
-
consultați Exercițiul 4. De ce este utilă unitatea angstrom ca unitate pentru exprimarea lungimilor legăturii?
-
folosind figura 4.4 „electronegativitățile diferitelor elemente”, determinați ce atom din fiecare pereche are electronegativitatea mai mare.
- H sau C
- O sau Br
- Na sau RB
- I sau Cl
-
folosind figura 4.4 „electronegativitățile diferitelor elemente”, determinați care atom din fiecare pereche are electronegativitatea inferioară.
- Mg sau o
- S sau F
- Al sau Ga
- O sau I
-
electronii vor fi împărțiți în mod egal sau inegal între fiecare legătură covalentă? Dacă inegal, la care atom sunt atrași electronii mai puternic?
- o legătură C–o
- o legătură F–F
- o legătură S–N
- o legătură I–Cl
-
electronii vor fi împărțiți în mod egal sau inegal între fiecare legătură covalentă? Dacă inegal, la care atom sunt atrași electronii mai puternic?
- o legătură C–C
- o legătură S–Cl
- o legătură O–H
- o legătură H–H
răspunde
-
o legătură C–O este mai lungă.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
lungimile reale ale legăturilor sunt foarte mici, astfel încât unitatea nanometrică face expresia lungimii mai ușor de înțeles.
-
- C
- o
- Na
- Cl
- inegal spre O
- egal
- inegal spre N
- inegal spre Cl
