obiective de învățare
- scrieți formula chimică pentru un compus ionic simplu.
- recunoaște ionii poliatomici în formulele chimice.
am întâlnit deja câteva formule chimice pentru compuși ionici simpli. O formulă chimică este o listă concisă a elementelor dintr-un compus și a raporturilor acestor elemente. Pentru a înțelege mai bine ce înseamnă o formulă chimică, trebuie să luăm în considerare modul în care un compus ionic este construit din ionii săi.
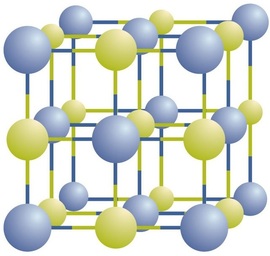
compușii ionici există ca ioni pozitivi și negativi alternanți în matrice tridimensionale regulate numite cristale (figura \(\PageIndex{1}\)). După cum puteți vedea, nu există „particule” individuale \(\ce{NaCl}\) în matrice; în schimb, există o rețea continuă de ioni alternanți de sodiu și clorură. Cu toate acestea, putem folosi raportul dintre ionii de sodiu și ionii de clorură, exprimat în cele mai mici numere întregi posibile, ca modalitate de descriere a compusului. În cazul clorurii de sodiu, raportul dintre ionii de sodiu și ionii de clorură, exprimat în cel mai mic număr întreg, este 1:1, deci folosim \(\ce{NaCl}\) (un simbol \(\ce{Na}\) și un simbol \(\ce{Cl}\)) pentru a reprezenta compusul. Astfel, \(\ce{NaCl}\) este formula chimică pentru clorura de sodiu, care este un mod concis de a descrie numărul relativ de ioni diferiți din compus. O probă macroscopică este compusă din miriade de perechi de NaCl; fiecare pereche individuală numită unitate de formulă. Deși este convenabil să credem că cristalele \(\ce{NaCl}\) sunt compuse din unități individuale \(\ce{NaCl}\), figura \(\PageIndex{1}\) arată că niciun ion unic nu este asociat exclusiv cu niciun alt ion unic. Fiecare ion este înconjurat de ioni de sarcină opusă.
formula pentru un compus ionic urmează mai multe convenții. În primul rând, cationul este scris înaintea anionului. Deoarece majoritatea metalelor formează cationi și majoritatea nemetalelor formează anioni, formulele listează mai întâi metalul și apoi nemetalul. În al doilea rând, taxele nu sunt scrise într-o formulă. Amintiți-vă că într-un compus ionic, speciile componente sunt ioni, nu atomi neutri, chiar dacă formula nu conține sarcini. În cele din urmă, formula adecvată pentru un compus ionic are întotdeauna o sarcină netă zero, ceea ce înseamnă că sarcina pozitivă totală trebuie să fie egală cu sarcina negativă totală. Pentru a determina formula corectă a oricărei combinații de ioni, determinați câte din fiecare ion este necesar pentru a echilibra sarcinile totale pozitive și negative din compus.
această regulă se bazează în cele din urmă pe faptul că materia este, în general, neutră din punct de vedere electric.
prin convenție, presupunem că există un singur atom dacă un indice nu este prezent. Nu folosim 1 ca indice.
dacă ne uităm la compusul ionic format din ioni de litiu și ioni de bromură, vedem că ionul de litiu are o sarcină 1+, iar ionul de bromură are o sarcină 1. Doar un ion din fiecare este necesar pentru a echilibra aceste sarcini. Formula pentru bromura de litiu este \(\ce{LiBr}\).
când un compus ionic este format din magneziu și oxigen, ionul de magneziu are o sarcină 2+, iar atomul de oxigen are o sarcină 2. Deși ambii ioni au sarcini mai mari decât ionii din bromura de litiu, ei se echilibrează reciproc într-un raport unu-la-unu. Prin urmare, formula adecvată pentru acest compus ionic este \(\ce{mgo}\).
acum luați în considerare compusul ionic format din magneziu și clor. Un ion de magneziu are o sarcină de 2+, în timp ce un ion de clor are o sarcină de 1:
\
combinarea unui ion din fiecare nu echilibrează complet sarcinile pozitive și negative. Cel mai simplu mod de a echilibra aceste sarcini este să presupunem prezența a doi ioni de clorură pentru fiecare ion de magneziu:
\
acum sarcinile pozitive și negative sunt echilibrate. Am putea scrie formula chimică pentru acest compus ionic ca \(\ce{mgclcl}\), dar convenția este de a folosi un indice numeric atunci când există mai mult de un ion de un anumit tip—\(\ce{MgCl2}\). Această formulă chimică spune că există un ion de magneziu și doi ioni de clorură în această formulă. (Nu citiți partea „Cl2” a formulei ca o moleculă a clorului elementar diatomic. Clorul nu există ca element diatomic în acest compus. Mai degrabă, există ca doi ioni de clorură individuali.) Prin convenție, cel mai mic raport al numărului întreg este utilizat în formulele compușilor ionici. Formula \(\ce{Mg2Cl4}\) are sarcini echilibrate cu ionii într-un raport 1:2, dar nu este cel mai mic raport de număr întreg.
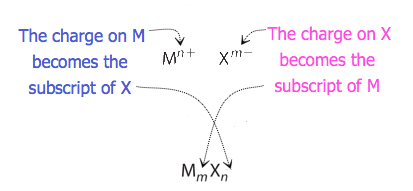
pentru compușii în care raportul dintre ioni nu este la fel de evident, indicii din formulă pot fi obținuți prin încrucișarea sarcinilor: utilizați valoarea absolută a sarcinii pe un ion ca indicele pentru celălalt ion. Această metodă este prezentată schematic în figura 3.3.2.
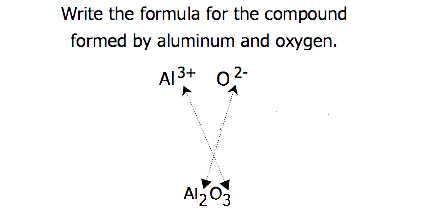
la trecerea taxelor, uneori este necesar să se reducă indicele la cel mai simplu raport pentru a scrie formula empirică. Luați în considerare, de exemplu, compusul format din Pb4+ și O2−. Folosind valorile absolute ale sarcinilor pe ioni ca indici dă formula Pb2O4. Acest lucru simplifică la formula empirică corectă PbO2. Formula empirică are un ion Pb4+ și doi ioni O2−.
Example \(\PageIndex{1}\)
scrieți formula chimică pentru un compus ionic compus din fiecare pereche de ioni.
- ionul de sodiu și ionul de sulf
- ionul de aluminiu și ionul de fluor
- ionul de fier 3+ și ionul de oxigen
soluție
- pentru a obține un octet de coajă de valență, sodiul formează un ion cu o sarcină 1+, în timp ce ionul de sulf are o încărcătură de 2. Doi ioni de sodiu 1 + sunt necesari pentru a echilibra sarcina 2 pe ionul de sulf. În loc să scriem formula ca \(\ce{NaNaS}\), o scurtăm prin convenție la \(\ce{Na2S}\).
- ionul de aluminiu are o sarcină 3+, în timp ce ionul de fluor format din fluor are o sarcină 1. Trei ioni de fluor 1 sunt necesari pentru a echilibra sarcina 3+ pe ionul de aluminiu. Această combinație este scrisă ca \(\ce{AlF3}\).
- fierul poate forma doi ioni posibili, dar ionul cu o încărcare de 3+ este specificat aici. Atomul de oxigen are o sarcină de 2 ca ion. Pentru a echilibra sarcinile pozitive și negative, ne uităm la cel mai puțin comun multiplu—6: doi ioni de fier 3+ vor da 6+, în timp ce trei ioni de oxigen 2 vor da 6−, echilibrând astfel sarcinile generale pozitive și negative. Astfel, formula pentru acest compus ionic este \(\ce{Fe2O3}\). Alternativ, utilizați metoda taxelor de trecere prezentată în figura 3.3.2.
exercițiu \(\PageIndex{1}\)
scrieți formula chimică pentru un compus ionic compus din fiecare pereche de ioni.
- ionul de calciu și ionul de oxigen
- ionul de cupru 2+ și ionul de sulf
- ionul de cupru 1+ și ionul de sulf
Răspuns a:
Cao
răspuns b:
CuS
răspuns c:
Cu2S
ioni poliatomici
unii ioni constau din grupuri de atomi legați covalent împreună și au o sarcină electrică totală. Deoarece acești ioni conțin mai mult de un atom, ei sunt numiți ioni poliatomici. Structurile Lewis, denumirile și formulele unor ioni poliatomici se găsesc în tabelul 3.3.1.
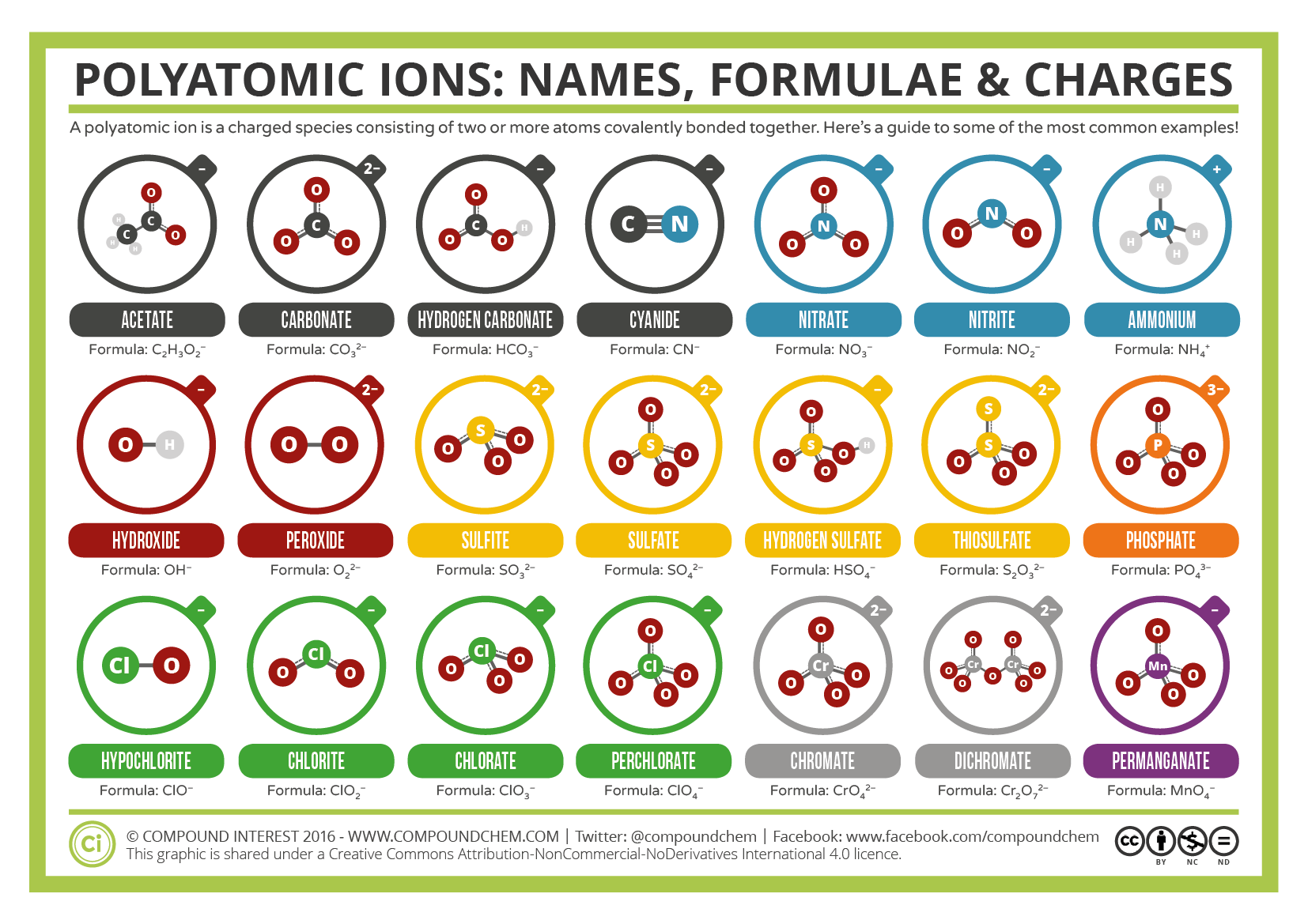
Table \(\PageIndex{1}\): Unii ioni poliatomici
ionii poliatomici au formule definite, nume și sarcini care nu pot fi modificate în niciun fel. Tabelul \(\PageIndex{2}\) enumeră numele ionilor și formulele ionice ale celor mai comuni ioni poliatomici. De exemplu, \(\ce{NO3 ^ { – }}\) este ionul nitrat; are un atom de azot și trei atomi de oxigen și o sarcină totală de 1. Figura \(\PageIndex{2}\) enumeră cei mai comuni ioni poliatomici.
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Ionii poliatomici rămași sunt încărcați negativ și, prin urmare, sunt clasificați ca anioni. Cu toate acestea, doar două dintre acestea, ionul hidroxid și ionul cianură, sunt denumite folosind sufixul „-ide” care indică de obicei particulele încărcate negativ. Anionii poliatomici rămași, care conțin oxigen, în combinație cu un alt nemetal, există ca parte a unei serii în care numărul de oxigeni din unitatea poliatomică poate varia. Așa cum s-a subliniat în mod repetat în mai multe secțiuni ale acestui text, nu ar trebui să existe două formule chimice care să aibă o Denumire chimică comună. Un singur sufix,”- ide”, este insuficient pentru a distinge numele anionilor într-o serie poliatomică înrudită. Prin urmare, sufixele”- ate „și” – ite ” sunt folosite, pentru a indica faptul că ionii poliatomici corespunzători fac parte dintr-o serie. În plus, aceste sufixe indică, de asemenea, numărul relativ de oxigeni care sunt conținute în ionii poliatomici. Rețineți că toți ionii poliatomici ale căror nume se termină în „-ate” conțin încă un oxigen decât acei anioni poliatomici ale căror nume se termină în „-ite.”Din păcate, la fel ca sistemul comun de denumire a metalelor de tranziție, aceste sufixe indică doar numărul relativ de oxigeni care sunt conținute în ionii poliatomici. De exemplu, ionul nitrat, care este simbolizat ca NO3−1, are încă un oxigen decât ionul nitrit, care este simbolizat ca NO2−1. Cu toate acestea, ionul sulfat este simbolizat ca SO4−2. În timp ce atât ionul nitrat, cât și ionul sulfat au un sufix „-ate”, primul conține trei oxigeni, dar acesta din urmă conține patru. În plus, atât ionul nitrat, cât și ionul sulfit conțin trei oxigeni, dar acești ioni poliatomici nu au un sufix comun. Din păcate, natura relativă a acestor sufixe impune ca formula Ionică/combinațiile de nume de ioni ale ionilor poliatomici să fie pur și simplu memorate.
regula pentru construirea formulelor pentru compușii ionici care conțin ioni poliatomici este aceeași ca și pentru formulele care conțin ioni monatomici (cu un singur atom): sarcinile pozitive și negative trebuie să se echilibreze. Dacă este necesar mai mult de unul dintr-un anumit ion poliatomic pentru a echilibra sarcina, întreaga formulă pentru ionul poliatomic trebuie închisă între paranteze, iar indicele numeric este plasat în afara parantezelor. Aceasta este pentru a arăta că indicele se aplică întregului ion poliatomic. Două exemple sunt prezentate mai jos:

Example \(\PageIndex{2}\)
scrieți formula chimică pentru un compus ionic compus din fiecare pereche de ioni.
- ionul de potasiu și ionul sulfat
- ionul de calciu și ionul nitrat
soluție
- ionii de potasiu au o sarcină de 1+, în timp ce ionii de sulfat au o sarcină de 2−. Vom avea nevoie de doi ioni de potasiu pentru a echilibra sarcina pe ionul sulfat, deci formula chimică adecvată este \(\ce{K_2SO_4}\).
- ionii de calciu au o sarcină de 2+, în timp ce ionii de nitrați au o sarcină de 1−. Vom avea nevoie de doi ioni de nitrați pentru a echilibra sarcina pe fiecare ion de calciu. Formula pentru nitrat trebuie să fie inclusă între paranteze. Astfel, scriem \(\ce{ca (NO3)2}\) ca formulă pentru acest compus ionic.
exercițiu \(\PageIndex{2}\)
scrieți formula chimică pentru un compus ionic compus din fiecare pereche de ioni.
- ionul de magneziu și ionul carbonat
- ionul de aluminiu și ionul acetat
Răspuns A:
Mg2+ și CO32- = MgCO3
răspuns b:
Al3+ și C2H3O2- = Al(C2H3O2)3
recunoașterea compușilor ionici
există două moduri de a recunoaște compușii ionici. În primul rând, compușii dintre elementele metalice și nemetalice sunt de obicei ionici. De exemplu, CaBr2 conține un element metalic (calciu, un metal din grupa 2a) și un element nemetalic (brom, un metal din grupa 7A). Prin urmare, este cel mai probabil un compus ionic. (De fapt, este Ionică.) În schimb, compusul NO2 conține două elemente care sunt atât nemetale (azot, din grupa 5A, și oxigen, din grupa 6A). Nu este un compus ionic; aparține categoriei compușilor covalenți discutați în altă parte. De asemenea, rețineți că această combinație de azot și oxigen nu are sarcină electrică specificată, deci nu este ionul nitrit.
În al doilea rând, dacă recunoașteți formula unui ion poliatomic într-un compus, compusul este ionic. De exemplu, dacă vedeți formula \(\ce{Ba (NO3)2}\), puteți recunoaște partea „NO3” ca Ion nitrat, \(\rm{NO_3^−}\). (Amintiți-vă că Convenția pentru scrierea formulelor pentru compușii ionici nu trebuie să includă sarcina Ionică.) Acesta este un indiciu că cealaltă parte a formulei, \(\ce{Ba}\), este de fapt ionul \(\ce{Ba^{2+}}\), cu sarcina 2+ echilibrând sarcina totală 2 din cei doi ioni de nitrați. Astfel, acest compus este, de asemenea, ionic.
Example \(\PageIndex{3}\)
identificați fiecare compus ca ionic sau nu ionic.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4CL}\)
- \(\ce{OF2}\)
soluție
- sodiul este un metal, iar oxigenul este un nemetal; prin urmare, \(\ce{Na2O}\) este de așteptat să fie ionic.
- atât fosforul, cât și clorul sunt nemetale. Prin urmare, \(\ce{PCl3}\) nu este ionic.
- \(\ce{NH4}\) în formula reprezintă ionul de amoniu, \(\ce{NH4^ {+}}\), ceea ce indică faptul că acest compus este ionic.
- atât oxigenul, cât și fluorul sunt nemetale. Prin urmare, \(\ce{OF2}\) nu este ionic.
exercițiu \(\PageIndex{3}\)
identificați fiecare compus ca ionic sau nu ionic.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce {(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Răspuns a:
nu ionic
răspuns b:
ionic
răspuns c:
ionic
răspuns d:
nu ionic
privind mai aproape: sângele și apa de mare
știința a recunoscut de mult că sângele și apa de mare au compoziții similare. La urma urmei, ambele lichide au compuși ionici dizolvați în ele. Asemănarea poate fi mai mult decât o simplă coincidență; mulți oameni de știință cred că primele forme de viață de pe Pământ au apărut în oceane. O privire mai atentă, totuși, arată că sângele și apa de mare sunt destul de diferite. O soluție de clorură de sodiu 0,9% aproximează concentrația de sare Găsită în sânge. În schimb, apa de mare este în principal o soluție de clorură de sodiu 3%, de peste trei ori concentrația în sânge. Iată o comparație a cantităților de ioni din sânge și apa de mare:
| Ion | la sută în apa de mare | procent în sânge |
|---|---|---|
| na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Această diferență este semnificativă deoarece ionul carbonat acid și unii ioni înrudiți au un rol crucial în controlul proprietăților acido-bazice ale sângelui. Cantitatea de ioni de hidrogen fosfat – \(\ce{HPO4 ^ {2 -}}\) și \(\ce{H2PO4^{−}}\)—în apa de mare este foarte scăzută, dar sunt prezenți în cantități mai mari în sânge, unde afectează și proprietățile acido-bazice. O altă diferență notabilă este că sângele nu are cantități semnificative de Ion sulfat (\(\ce{SO4^{2−}}\)), dar acest ion este prezent în apa de mare.
soluții cheie
- formulele chimice adecvate pentru compușii ionici echilibrează sarcina pozitivă totală cu sarcina negativă totală.
- există și grupuri de atomi cu o sarcină globală, numite ioni poliatomici.
exerciții
-
ce informații sunt conținute în formula unui compus ionic?
-
De ce formulele chimice pentru unii compuși ionici conțin indici, în timp ce altele nu?
3. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Mg2+ și i−
- Na+ și O2−
4. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Na+ și Br−
- Mg2+ și Br−
- Mg2+ și S2−
5. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- K+ și Cl−
- Mg2+ și Cl−
- Mg2+ și Se2−
6. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Na+ și N3−
- Mg2+ și N3−
- Al3+ și S2−
7. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Li+ și N3−
- Mg2+ și P3−
- Li+ și P3−
8. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Fe3+ și Br−
- Fe2+ și Br−
- Au3+ și S2−
- Au+ și s2−
9. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Cr3+ și O2−
- Cr2+ și O2−
- Pb2+ și Cl−
- Pb4+ și Cl−
10. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- Cr3+ și NO3−
- Fe2+ și PO43−
- Ca2+ și CrO42−
- Al3+ și OH−
11. Scrieți formula chimică pentru compusul ionic format din fiecare pereche de ioni.
- NH4+ și NO3−
- H+ și Cr2O72−
- Cu+ și CO32−
- Na+ și HCO3−
12. Pentru fiecare pereche de elemente, determinați sarcina pentru ionii lor și scrieți formula corespunzătoare pentru compusul ionic rezultat între ele.
- Ba și S
- Cs și I
13. Pentru fiecare pereche de elemente, determinați sarcina pentru ionii lor și scrieți formula corespunzătoare pentru compusul ionic rezultat între ele.
- K și S
- Sc și Br
14. Ce compuși ai prezice că sunt ionici?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Ce compuși ai prezice că sunt ionici?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
răspunsuri
1. raportul fiecărui tip de ion din compus
2. Uneori este nevoie de mai mult de un ion pentru a echilibra sarcina pe celălalt ion într-un compus ionic.
- MgI2
- Na2O
- NaBr
- MgBr2
- MGS
- KCL
- MgCl2
- mgse
- na3n
- Mg3n2
- AL2S3
- li3n
- mg3p2
- li3p
- febr3
- Febr2
- Au2s3
- au2s
- Cr2O3
- Cro
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- BA2+, s2−, bas
- CS+, i−, CSI
- k+, S2−, K2S
- SC3+, br−, scbr3
- ionică
- ionică
- Ionică
- ionică
- ionică
- ionică
- Ionică
- Ionică
- ionică
- ionică
- ionică
- nu ionic
- div >
- ionic
nu ionic nu ionic - ionic
nu ionic nu ionic
- ionic
ionic
