13.5 D: biotina este o coenzimă purtătoare de CO2
reamintim din secțiunea 6.5 B că multe enzime depind de asistența coenzimelor, care sunt molecule organice mici (relativ la proteine) care se leagă-covalent sau non – covalent-în situsul activ al unei enzime și ajutați – l să-și catalizeze reacția. S-adenosilmetionina (SAM, secțiunea 9.1 a) și ATP (secțiunea 10.2) sunt două exemple pe care le-am întâlnit până acum și vom vedea mai multe în capitolele următoare. Deși Rubisco (descris în partea B a acestei secțiuni) este o excepție, majoritatea enzimelor care catalizează reacțiile de carboxilare depind de o coenzimă numită biotină, care servește ca purtător temporar al dioxidului de carbon.
Piruvat carboxilaza, enzima care catalizează prima etapă a căii gluconeogensis, este un bun exemplu de reacție de carboxilare dependentă de biotină. Observați că CO2 din această reacție este derivat din bicarbonat, spre deosebire de reacția Rubisco în care CO2 este ‘fixat’ direct din atmosferă.

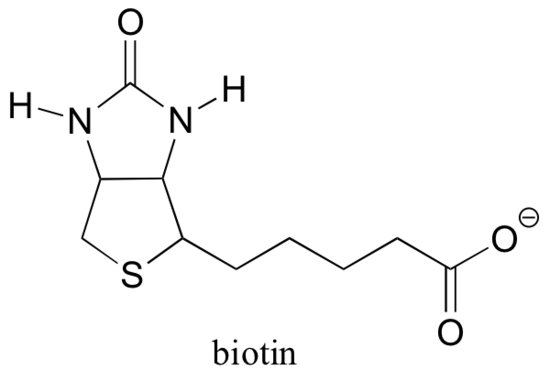
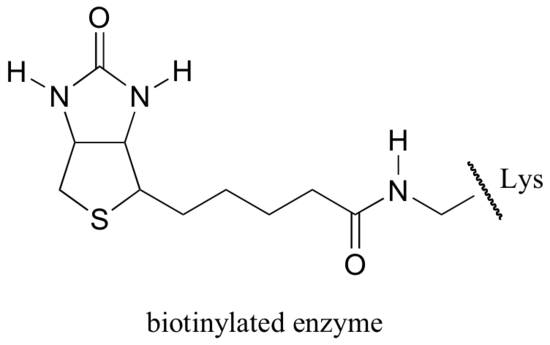
biotina este atașată covalent la enzimă printr-o legătură amidică cu o lizină cu situs activ.
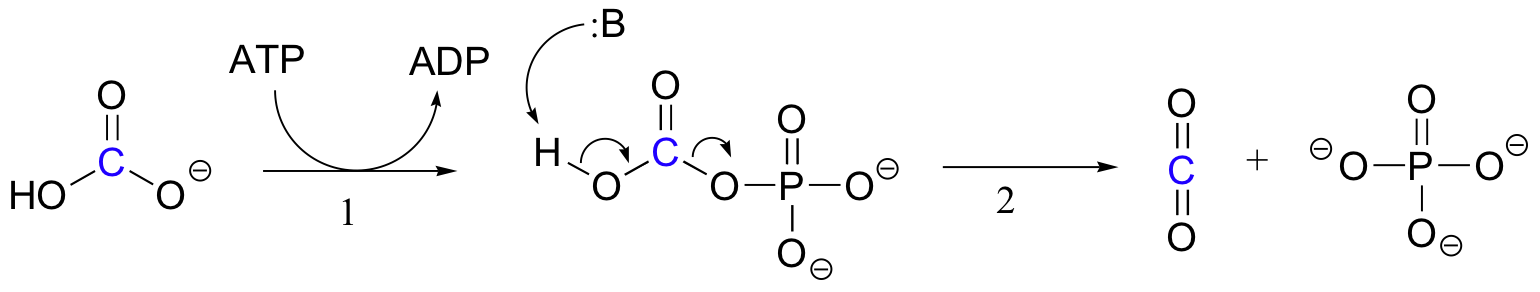
mecanismul exact prin care acționează reacțiile de carboxilare dependente de biotină nu este încă pe deplin înțeles, cu toate acestea, următoarea este o imagine probabilă. În primul rând, ionul bicarbonat este fosforilat de ATP (pasul 1, vezi secțiunea 10.2) și astfel este activat pentru decarboxilare, care generează CO2 liber (pasul 2).
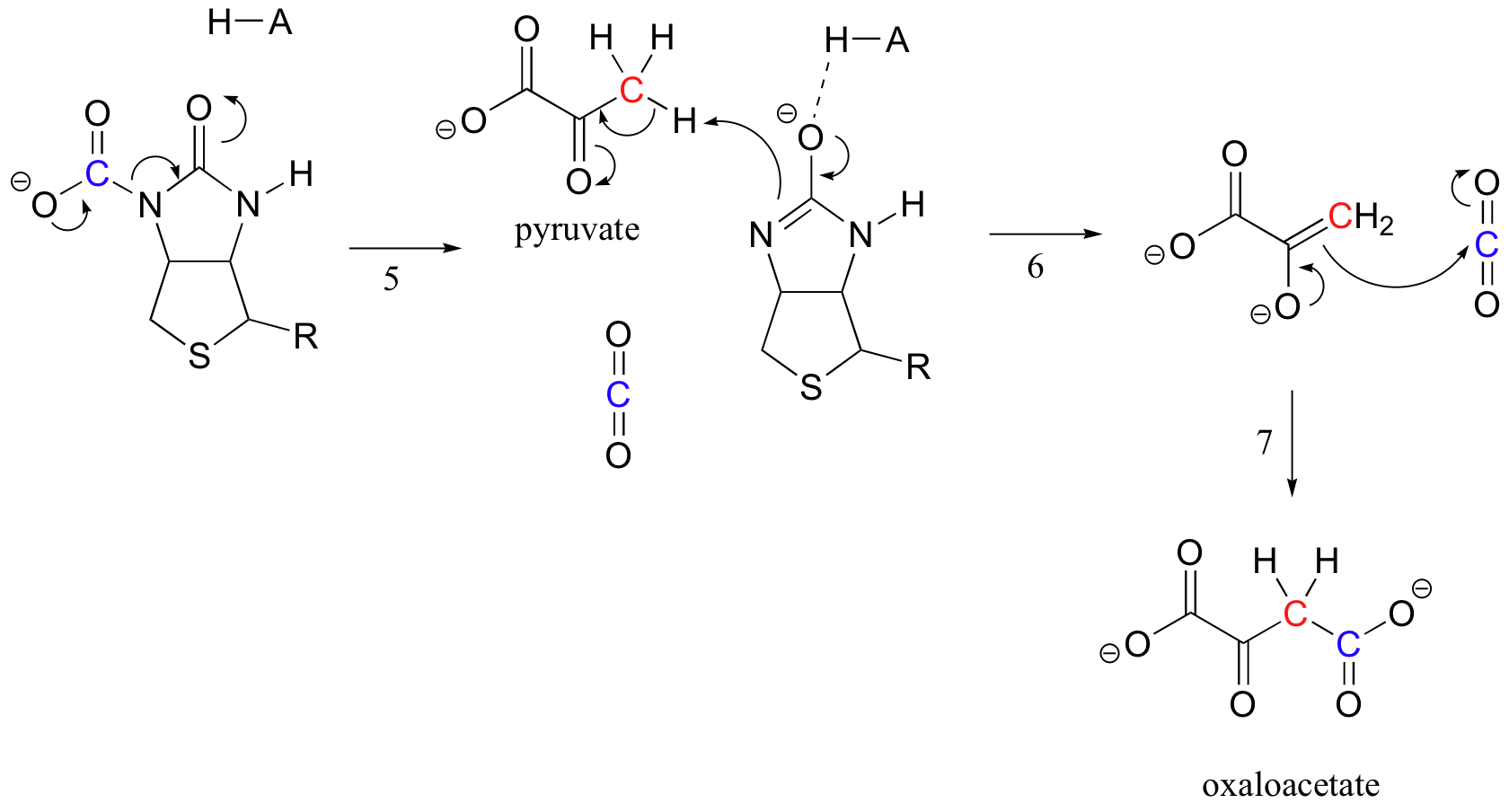
sarcina biotinei este de a menține molecula de dioxid de carbon până când piruvatul intră în situsul activ. Carboxilarea biotinei implică deprotonarea azotului amidic pentru a forma un intermediar asemănător enolatului (Pasul 3-amidele au un pKa de aproximativ 17, iar acest lucru este redus de prezența unui situs activ acid lângă oxigen). Această etapă este urmată de atacul azotului nucleofil asupra dioxidului de carbon pentru a forma enzima carboxibiotinilată (etapa 4).
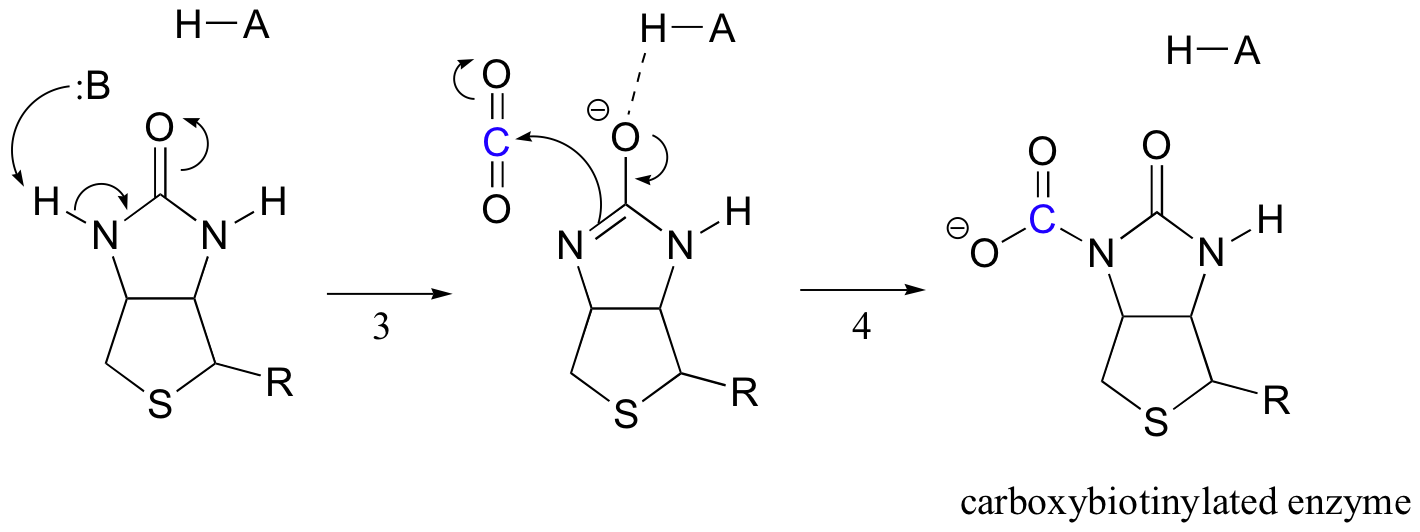
când o moleculă de piruvat se leagă, rearanjarea arhitecturii sitului activ face ca pasul anterior să meargă invers (pasul 5), eliberând CO2 și generând o bază de biotină pentru a deprotona alfa-carbonul piruvat astfel încât să se poată condensa, într-un mod asemănător aldolului, cu CO2 pentru a forma oxaloacetat (pașii 6-7).
dacă ați studiat unele biochimie, este posibil să fi auzit despre biotină într-un context oarecum diferit de ceea ce este discutat în această secțiune. O proteină numită avidină, găsită din abundență în albusul de ou, se leagă non-covalent și extrem de strâns de biotină (de fapt, avidina-biotina este cea mai strânsă pereche de legare a proteinei-ligand cunoscută științei). Biochimii folosesc adesea această proprietate legând covalent o biomoleculă de interes cu biotina. Speciile biotinilate pot fi apoi izolate cu ușurință dintr-un amestec complex prin rularea amestecului printr-o coloană de afinitate acoperită cu avidină.
