există o serie de moduri în care o celulă se poate deplasa dintr-un punct în spațiu în altul. Într-un mediu lichid, această metodă poate fi un fel de înot, folosind mișcarea ciliară sau flagelară pentru a propulsa celula. Pe suprafețe solide, aceste mecanisme în mod clar nu vor funcționa eficient, iar celula suferă un proces de crawling. În această secțiune, începem cu o discuție despre mișcarea ciliară/flagelară și apoi luăm în considerare cerințele mai complicate ale târârii celulare.
cilii și flagelii, care diferă mai degrabă în lungime decât în construcție, sunt organite pe bază de microtubuli care se mișcă cu o mișcare înainte și înapoi. Acest lucru se traduce prin „canotaj” prin cilia relativ scurtă, dar în flagelul mai lung, flexibilitatea structurii face ca mișcarea înainte și înapoi să fie propagată ca un val, astfel încât mișcarea flagelară este mai ondulantă sau mai asemănătoare (luați în considerare ce se întâmplă în timp ce dați rapid un furtun de grădină dintr-o parte în alta în comparație cu o bucată scurtă din același furtun). Miezul oricărei structuri se numește axonem, care este compus din 9 dublete de microtubuli conectate între ele prin proteine motorii dineinice ciliare și care înconjoară un miez central de doi microtubuli separați.
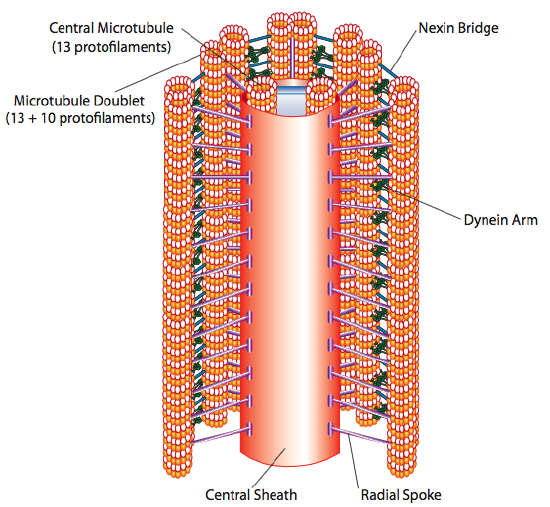
aceasta este cunoscută sub numele de formarea „9+2”, deși cele nouă dublete nu sunt aceleași cu cele două microtubuli centrali. Tubul A este un 13-protofilamente complete, dar tubul B fuzionat cu acesta conține doar 10 protofilamente. Fiecare dintre microtubuli centrale este un plin 13 protofilamente. Axonemul 9 + 2 extinde lungimea ciliului sau a flagelului de la vârf până ajunge la bază și se conectează la corpul celular printr-un corp bazal, care este compus din 9 tripleți de microtubuli aranjați într-un butoi scurt, la fel ca centriolii din care sunt derivați.
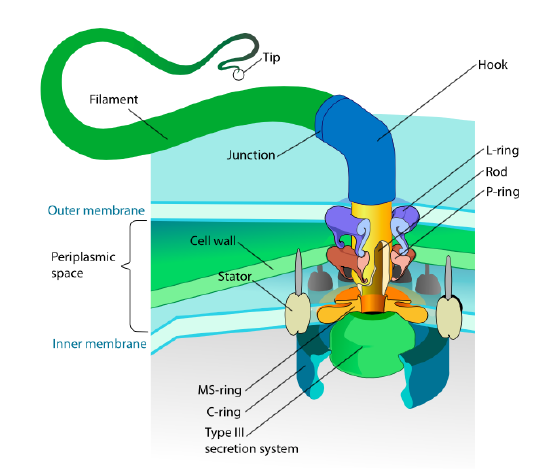
această secțiune se referă numai la eucariote. Unele procariote au, de asemenea, anexe mobile numite flageluri, dar sunt complet diferite atât în structură, cât și în mecanism. Flagelii înșiși sunt polimeri elicoidali lungi ai flagelinei proteice, iar baza fibrelor flagelinei este conectată la o proteină motorie rotativă, nu la un motor translațional. Acest motor (figura \(\PageIndex{18}\)) utilizează ionul (H+ sau Na+ în funcție de specie) pe un gradient electrochimic pentru a furniza energie pentru a roti până la 100000 de rotații pe minut. Se crede că rotația este condusă de modificări conformaționale în inelul statorului, amplasat în membrana celulară.
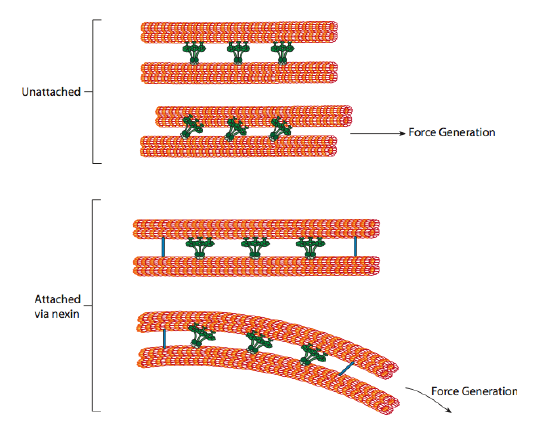
dineinele ciliare asigură capacitatea motorului, dar există și alte două proteine de legătură în axonem. Există nexine care unesc tubul A al unui dublet cu tubul B al dubletului său adiacent, conectând astfel inelul exterior. Și, există spițe radiale care se extind de la tubul A al fiecărui dublet la perechea centrală de microtubuli din miezul axonemului. Niciuna dintre acestea nu are activitate motorie. Cu toate acestea, ele sunt cruciale pentru mișcarea cilia și flagella, deoarece ajută la transformarea unei mișcări de alunecare într-o mișcare de îndoire. Când dinina ciliară (foarte asemănătoare cu dineinele citoplasmatice, dar are trei capete în loc de două) este angajată, se leagă un microtubul A pe o parte, un microtubul B de dubletul adiacent și se mișcă unul în raport cu celălalt. O linie a acestor dinastii care se mișcă concertat ar aluneca astfel un dublet în raport cu celălalt, dacă (și este un mare „dacă”) cele două dublete ar avea libertate completă de mișcare. Cu toate acestea, deoarece dubletele sunt interconectate de proteinele nexin, ceea ce se întâmplă pe măsură ce un dublet încearcă să alunece este că îndoaie structura conectată în schimb (figura \(\PageIndex{17}\)). Această îndoire reprezintă mișcarea de canotaj a cililor, care sunt relativ scurte, precum și mișcarea de biciuire a flagelului lung, care propagă mișcarea de îndoire în jos a axonemului.
deși ne gândim la mișcarea ciliară și flagelară ca metode de propulsie a unei celule, cum ar fi înotul flagelar al spermei către un ovul, există, de asemenea, o serie de locuri importante în care celula este staționară, iar cilii sunt folosiți pentru a muta fluidul pe lângă celulă. De fapt, există celule cu cilia în majoritatea organelor majore ale corpului. Au fost raportate mai multe dischinezii ciliare, dintre care cea mai proeminentă dischinezie ciliară primară (PCD), care include sindromul Kartagener (KS), se datorează mutației genei DNAI1, care codifică o subunitate (lanț intermediar 1) de dineină axonemală (ciliară). PCD se caracterizează prin detresă respiratorie datorată infecției recurente, iar diagnosticul de KS se face dacă există și situs inversus, o afecțiune în care asimetria normală stânga-dreapta a corpului (de exemplu, stomacul din stânga, ficatul din dreapta) este inversat. Primul simptom se datorează inactivității numeroaselor cilia ale celulelor epiteliale din plămâni. Funcția lor normală este de a menține mucusul în calea respiratorie în mod constant în mișcare. În mod normal, mucusul ajută la menținerea plămânilor umedi pentru a facilita funcția, dar dacă mucusul devine staționar, acesta devine un teren de reproducere pentru bacterii, precum și un iritant și un obstacol în calea schimbului adecvat de gaze.
Situs inversus este o malformație interesantă, deoarece apare în dezvoltarea embrionară și afectează doar 50% dintre pacienții cu PCD, deoarece funcția ciliară afectată determină randomizarea asimetriei stânga-dreapta, nu inversarea. În termeni foarte simpli, în timpul dezvoltării embrionare timpurii, asimetria stânga-dreapta se datorează parțial mișcării semnalelor moleculare într-un ow spre stânga prin nodul embrionar. Acest flux este cauzat de bătaia coordonată a cilia, astfel încât atunci când acestea nu funcționează, fluxul este întrerupt și are loc randomizarea.
alte simptome ale pacienților cu PCD subliniază, de asemenea, activitatea cilia și flagelul în organism. Infertilitatea masculină este frecventă datorită spermei imotile. Infertilitatea feminină, deși mai puțin frecventă, poate apărea, de asemenea, din cauza disfuncției cilia oviductului și a tubului uterin care deplasează în mod normal oul de-a lungul ovarului în uter. Interesant este că există, de asemenea, o asociere scăzută a hidrocefaliei internus (supraîncărcarea ventriculelor creierului cu lichidul cefalorahidian, determinând mărirea lor care comprimă țesutul cerebral din jurul lor) cu PCD. Acest lucru se datorează probabil disfuncției cilia în celulele ependimale care căptușesc ventriculele și care ajută la circulația CSF, dar se pare că nu sunt complet necesare. Deoarece fluxul în vrac al LCR este considerat a fi condus în primul rând de sistol/ diastol schimbarea tensiunii arteriale în creier, unii presupun că cilia poate fi implicată în principal în ow prin unele dintre canalele mai strânse din creier.
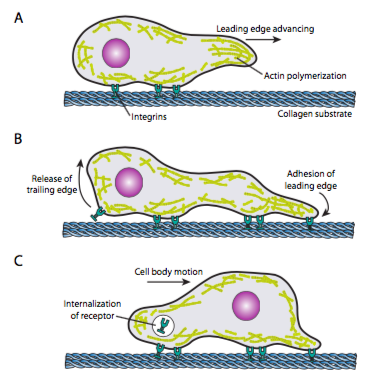
crawling de celule (figura \(\PageIndex{19}\)) necesită rearanjarea coordonată a rețelei de microfilament de margine de vârf, extinzându-se (atât prin polimerizare, cât și prin filamente glisante) și apoi formând aderențe la noul punct cel mai înainte. Aceasta poate lua forma filopodiei sau lamellipodiei și adesea ambele simultan. Filopodia sunt proiecții lungi și foarte subțiri, cu fascicule de miez de microfilamente paralele și concentrații mari de receptori de suprafață celulară. Scopul lor este în primul rând să simtă mediul. Lamellipodia se extinde adesea între două lopodii și este mai mult o zburlă largă decât un deget. Pe plan intern, actina se formează mai mult în ochiuri decât în mănunchiuri, iar marginea mai largă permite realizarea mai multor aderențe la substrat. Rețeaua de microfilamente se rearanjează din nou, de data aceasta deschizând un spațiu în citoplasmă care acționează ca un canal pentru mișcarea microtubulilor spre partea din față a celulei. Acest lucru pune în aplicare rețeaua de transport pentru a ajuta la deplasarea materialului vrac intracelular înainte. Pe măsură ce se întâmplă acest lucru, vechile aderențe de pe capătul cozii celulei sunt eliberate. Această eliberare se poate întâmpla prin două mecanisme primare: endocitoza receptorului sau dezactivarea receptorului prin semnalizare/schimbare conformațională. Desigur, această simplificare excesivă contrazice complexitatea coordonării și controlului tuturor acestor acțiuni pentru a realiza mișcarea direcționată a unei celule.
Un model de generare a forței microfilamentelor, Modelul Elastic Brownian cu clichet (Mogilner și Oster, 1996), propune ca, datorită mișcării browniene a membranei celulare rezultată din fluctuația termică continuă, filamentele de actină care împing spre marginile membranei sunt flexate în grade diferite. Dacă flexul este suficient de mare, un nou monomer de actină se poate încadra între membrană și vârful filamentului, iar atunci când filamentul acum mai lung se flexează înapoi, poate exercita o apăsare mai mare asupra membranei. Evident, un singur filament nu generează multă forță, dar extinderea coordonată a multor filamente poate împinge membrana înainte.
odată ce o celulă primește un semnal pentru a se deplasa, răspunsul citoscheletal inițial este de a polimeriza actina, construind mai multe microfilamente pentru a le încorpora în marginea anterioară. În funcție de semnal (atractiv sau respingător), polimerizarea poate apărea pe aceeași parte sau opusă a celulei din punctul de activare a receptorului de semnal. În mod semnificativ, polimerizarea noii F-actine poate genera suficientă forță pentru a muta membrana înainte, chiar și fără implicarea motoarelor cu miozină! Modelele de generare a forței sunt dezbătute, dar în general încep cu încorporarea de noi g-actină într-un filament la vârful său; adică la interfața filament-membrană. Chiar dacă acest lucru ar putea fi suficient din punct de vedere tehnic, într-o celulă vie, sunt implicate miozine și ajută la împingerea și aranjarea filamentelor direcțional pentru a configura noua margine de conducere. În plus, unele filamente și rețele trebuie întrerupte rapid și se fac noi conexiuni, atât între filamente, cât și între filamente și alte proteine, cum ar fi moleculele de adeziune sau microtubuli.
cum este controlată polimerizarea și rearanjarea actinei? Receptorii care semnalează locomoția celulară pot iniția căi oarecum diferite, dar mulți împărtășesc unele puncte comune în activarea unuia sau mai multor membri ai familiei Ras de Gtpaze mici. Aceste molecule de semnalizare, cum ar fi Rac, Rho și cdc42 pot fi activate de receptori tirozin kinaze (vezi căile de activare RTK-Ras, cap. 14). Fiecare dintre acestea are un rol ușor diferit în motilitatea celulară: activarea cdc42 duce la formarea filopodiei, Rac activează o cale care include Arp2/3 și cofilină la formarea lamellipodiei, iar Rho activează miozina II pentru a controla aderența focală și formarea fibrelor de stres. Un alt tip de cascadă a receptorilor, cascada de semnalizare a proteinei G (de asemenea Capitolul 14), poate duce la activarea PLC și scindarea ulterioară a PIP2 și creșterea ca citosolic2+. Aceste modificări, după cum sa menționat mai devreme, pot activa, de asemenea, miozina II, precum și enzimele de remodelare gelsolin, cofilin și profilin. Aceasta descompune structurile actinice existente pentru a face celula mai fluidă, contribuind în același timp cu mai multă g-actină pentru a forma noul citoschelet de margine.
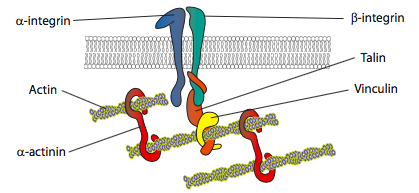
experimentele in vitro arată că, pe măsură ce membrana împinge înainte, se fac noi contacte adezive prin molecule de adeziune sau receptori care leagă substratul (adesea diapozitivele sau vasele de cultură celulară sunt acoperite cu colagen, filaminină sau alte proteine din matricea extracelulară). Contactele recrutează apoi elemente citoscheletice pentru o stabilitate mai mare pentru a forma o adeziune focală (figura \(\PageIndex{20}\)). Cu toate acestea, formarea aderențelor focale pare a fi un artefact al culturii celulare și nu este clar dacă tipurile de aderențe care formează in vivo recrutează aceleași tipuri de componente citoscheletice.
al treilea pas către locomoția celulară este mișcarea în vrac a conținutului celular înainte. Mecanismele pentru această fază sunt neclare, dar există unele dovezi că folosind legături între citoscheletul actinei la marginea anterioară și părțile din față ale citoscheletului microtubulilor, microtubulii sunt rearanjați pentru a forma o cale de transport eficientă pentru mișcarea în vrac. Un alt aspect al acestui lucru poate fi un efect de” corralling ” al rețelelor de actină, care deschid direct spațiu spre marginea anterioară. Microtubulii intră apoi în acel spațiu mai ușor decât să lucreze printr-o plasă de actină strânsă, forțând fluxul în direcția corectă.o mare parte din munca asupra interacțiunilor microtubule-actină în motilitatea celulară a fost făcută prin cercetarea conului de creștere neuronală, care este uneori menționată ca o celulă în lesă, deoarece acționează aproape independent ca o celulă târâtoare, căutând calea potrivită pentru a-și conduce axonul din corpul celular la conexiunea sinaptică adecvată (A. W. Schaefer și colab., Dev. Celula 15: 146-62, 2008).
în cele din urmă, celula trebuie să-și anuleze vechile aderențe pe marginea finală. Acest lucru se poate întâmpla în mai multe moduri diferite. In vitro, s-a observat că celulele târâtoare se desprind de substrat, lăsând în urmă bucăți mici de membrană și proteine de adeziune asociate în acest proces. Se presupune că forța generată provine din fibrele de stres actină-miozină care conduc din aderențele focale mai înainte. Cu toate acestea, există mecanisme mai puțin distructive disponibile celulelor. În unele cazuri, adezivitatea receptorului celular pentru substratul extracelular poate fi reglată intern, poate prin fosforilarea sau defosforilarea unui receptor. O altă posibilitate este endocitoza receptorului, luându-l de pe suprafața celulei. S-ar putea recicla pur și simplu până la marginea anterioară acolo unde este nevoie (adică transcitoză) sau, dacă nu mai este necesară sau deteriorată, poate fi descompusă într-un lizozom.
