o uso de terminologia consistente dentro e entre os estudos é fundamental para permitir um processo de ensaio eficiente. Padrões de CDISC como CDASH, SDTM, SEND e ADaM padronizam as estruturas para usar ao coletar e enviar dados, mas e os próprios valores de dados?
Este post dá uma visão geral da terminologia controlada padronizada do CDISC e como ele deve ser usado para coletar e enviar dados de uma forma que acelera os ensaios e permite a análise cruzada de estudos.
Se estiver interessado em ler mais sobre os padrões do CDISC, pode ler os nossos blogs o que quiser saber sobre o SDTM e a introdução aos padrões do CDISC.
CDI parceiro com NCI para definir terminologia padronizada
CDI tem parceria com o Instituto Nacional do câncer (NCI) para ajudar a trazer consistência à terminologia em ensaios clínicos. Através desta colaboração, um conjunto padrão de terminologia foi definido e é atualizado trimestralmente, trazendo consistência semântica entre os estudos. Utilizando esta terminologia, a mesma informação será representada da mesma forma em todos os estudos.
tomemos um exemplo simples-sexo:
- Deve o homem ser representado por “Masculino”, “Masculino”, “M”ou ” 1″?como deve alguém que é intersexual ser gravado?
em dias passados, esta informação pode ter sido recolhida de diferentes formas para cada estudo. O padrão de terminologia NCI do CDISC agora define que as únicas opções permitidas São “F”, “M”, “U” e “indiferenciada”, e que uma pessoa que é intersexual deve ser registrada como “indiferenciada”. Você pode ver como este exemplo muito simples já torna muito mais fácil de entender os dados subjacentes e facilmente segmentar para diferentes populações através de estudos.
![]() Nota
Nota
FDA padrões de dados catálogo agora obriga que o padronizado NCI a terminologia utilizada para todos os novos estudos. Isso torna a vida de um revisor muito mais fácil, pois eles sabem como interpretar os dados.

How is CDISC NCI Terminology defined?
a tabela abaixo mostra como a terminologia sexual padrão é definida.
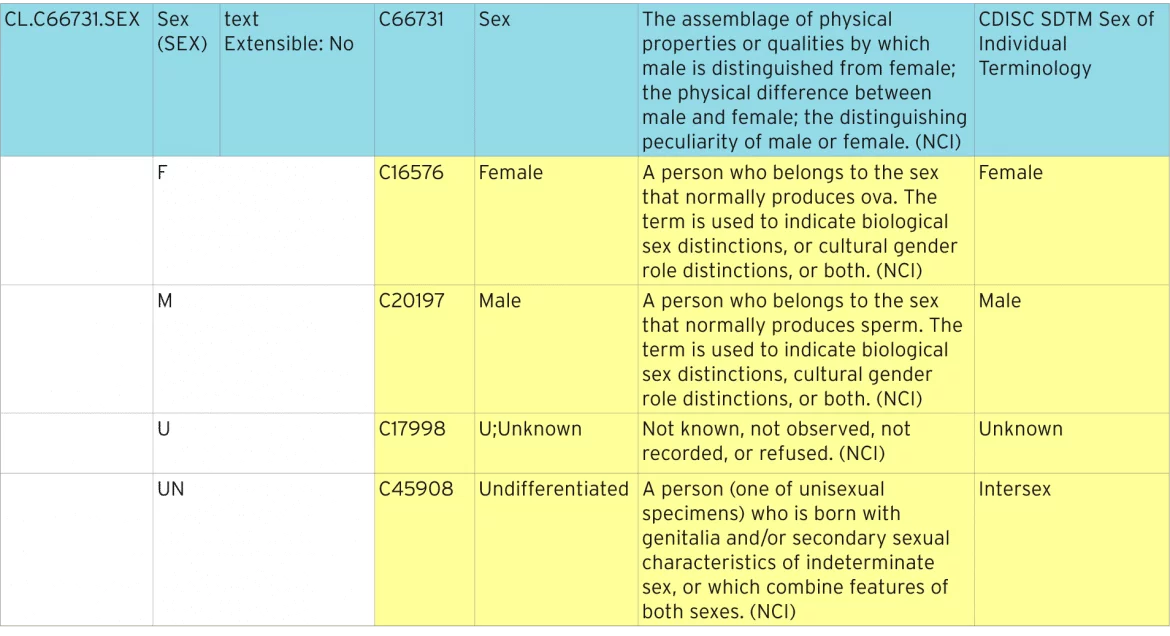
Identificação padronizado de terminologias
a linha azul representa A lista de códigos que contém todos os códigos individuais. A lista de códigos tem um “código C” padrão de “C66731”. Cada um dos códigos individuais tem o seu próprio código C, por exemplo, “C16576”. Estes códigos C são usados em ODM e definem Metadados XML para identificar listas de códigos como sendo terminologia padrão NCI.
extensibilidade
este codelist é definido como sendo não-extensível, o que significa que, onde quer que o codelist é utilizado, não deve conter quaisquer termos não listados aqui. Listas de códigos que são extensíveis podem ter termos adicionais adicionados. Estes termos adicionais devem ser descritos em Define-XML como sendo Termos estendidos e não podem ser duplicados ou sinônimos de termos existentes.
valor de Submissão, sinónimos e termo preferido
o valor de submissão é o que deve ser submetido a um regulador. O valor realmente exibido em um formulário pode ser diferente, e talvez um dos sinônimos ou o termo preferido.
Disponível em muitas cores
as normas de terminologia NCI estão disponíveis em uma série de formatos para atender diferentes necessidades, incluindo Excel, ODM, HTML e RDF. O exemplo acima é retirado da versão Excel.
agrupados em subconjuntos para CDASH, SDTM, ADaM e mais
por conveniência, a terminologia NCI é agrupada em um número de subconjuntos.
- SDTM terminologia contém termos para uso em um SDTM de apresentação baseada
- CDASH terminologia contém termos para uso em CDASH baseado em coleta de dados
- Adão terminologia contém termos para uso em Adão conjuntos de dados
- ENVIAR terminologia contém termos para uso em ENVIAR uma apresentação baseada
- Protocolo terminologia contém termos para utilização com o Protocolo de Modelo de Representação (PRM) e Registro de Ensaio Clínico XML (CTR-XML)
Usando CDISC NCI Terminologia em um estudo
Quando a definição de apresentação de metadados em Definir-XML, listas de código são usadas para definir listas fixo de valores para certas variáveis. De acordo com o atual regulamento da FDA, essas listas de códigos devem estar em conformidade com a terminologia NCI padrão do CDISC, onde essa terminologia existe. Eles são vinculados a terminologia padronizada pela adição de Aliases para o C-códigos, por exemplo:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
Quando a definição de recolha de dados de metadados no ODM não há nenhuma exigência para o uso padronizado de terminologias, no entanto, isso irá remover a necessidade de mapa de termos a partir de seus dados coletados para os dados submetidos. Isso simplifica muito seu processo de estudo final-a-final e aumenta a consistência entre os estudos.
A Gestão de atualizações
a gestão de atualizações terminológicas pode ser uma quantidade significativa de trabalho, particularmente com as normas sendo atualizadas tão regularmente. Como você sabe que estudos ou padrões organizacionais podem ser afetados pela nova terminologia? Como você então faz as atualizações necessárias de uma forma eficiente e confiável?
A maneira mais fácil de gerenciar isso é usando um repositório de metadados ciente do CDISC que lhe permite definir padrões organizacionais construídos sobre a terminologia padronizada, e construir seus estudos a partir desses padrões. Como o repositório compreende as relações entre todos os padrões e seus estudos, ele pode simplificar o processo de atualização para novas versões dos padrões de terminologia NCI do CDISC.
