Introdução do inibidor do ciclo celular
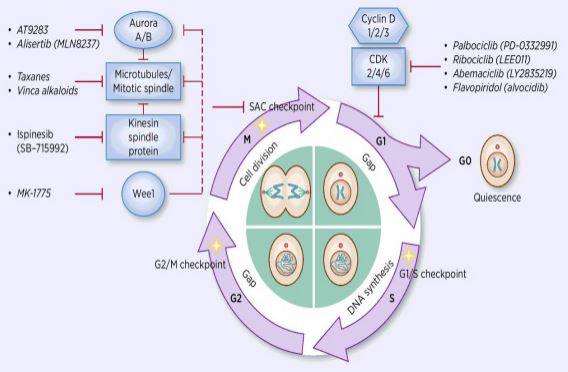
O processo de ciclo celular regulamento é a ativação ou inativação de diversas autoridades fatores sob a vigilância de pontos de verificação, iniciando assim o processo de célula de replicação do DNA e a divisão em duas células filhas. Entre muitos reguladores do ciclo celular, a cinase dependente da ciclina (CDK) está no núcleo, e é um sistema de rede que regula o ciclo celular com inibidores da cinase dependentes da ciclina (CKIs). CDKs são uma classe de serina/treonina cinases, e, atualmente, 13 espécies são encontradas, incluindo CDK1~13, que desempenham um papel no ciclo celular regulamento de CDKs e transcrição regulamento de CDKs. A regulação do ciclo celular é, de fato, a regulação dos pontos de controle, sendo os pontos de regulação G1/S os mais importantes. Quando o ciclo celular é estimulado por sinais externos, tais como fatores de crescimento, a subunidade catalítica CDK4/CDK6 liga-se ao Ciclind subunidade regulatória, e os resíduos de CDKs são ativados pela fosforilação/desphorilação. Após a ativação dos CDKs, a proteína Rb é fosforilada. O gene rb, também conhecido como Gene retinoblastoma, é o primeiro Gene clonado supressor tumoral, e sua capacidade de formar um complexo com fatores de transcrição (como E2F) após a fosforilação da proteína é perdida. E2F desempenha um papel importante no ciclo celular regulamento e induz a expressão de CyclinE e CDK2 e forma um CyclinE/CDK2 complexo, o que fosforila Rb proteína e totalmente lançamentos E2F. Posteriormente, E2F entra no núcleo para ativar uma série de célula ciclos em S fase. No final da fase de replicação do DNA durante a fase S, CDK2 é ativado por cyclinE, que inativa fator de transcrição E2F no tempo, evitando a apoptose, causada pela persistência ativado E2F. Estatísticas de pesquisa mostram que mais de 90% dos cânceres humanos têm mutações em genes relacionados no CDK, Cyclin, CKI, e Rb vias, com CDK e sua respectiva regulamentação subunidade Cyclin são os mais freqüentemente disfuncional. Além disso, as flutuações no ciclo celular promovem a resistência à quimioterapia e reduzem os efeitos da quimioterapia. Portanto, a regulação da atividade CDK/Cyclin, que restaura o ciclo celular normal, é uma das estratégias para o tratamento de tumores.os inibidores do ciclo celular são agora utilizados clinicamente os investigadores do fármaco têm-se concentrado em encontrar diferentes tipos de inibidores da CDK e da Cyclin como medicamentos de ponta contra o cancro. Atualmente, os inibidores CDK são divididos principalmente em endógeno e exógeno. A maior classe de pequenos inibidores endógenos da molécula são as proteínas de baixo peso molecular, que são classificadas em duas grandes categorias de acordo com as diferenças nas funções estruturais, e uma classe é chamada de família específica dupla INK4, incluindo p15, p16, p18, p19, que inibe a família proteica. A proteína inibitória dependente da cinase associada à Ciclindose liga-se ao CDK4 livre correspondente, bloqueando assim a ligação do CDK4 ao ciclind correspondente para formar um complexo de dímero catalítico. A outra classe é chamada de família Kip, incluindo P21, P27, P57. Esta família de proteínas pode formar um trímero com um complexo dimérico composto de cyclin e/CDK2 e cyclinA/CDK1, bloqueando o centro cataliticamente ativo do dímero. A inibição destes inibidores endógenos, quando combinados com o complexo cinase, regula especificamente a sua actividade, regulando precisamente a transformação da célula da fase G1 para a fase S. Estudos têm mostrado que a ocorrência e o desenvolvimento de vários tumores estão associados com a diminuição da expressão de CDKs/cyclins ou diminuição da expressão de inibidores endógenos, tais como a eliminação de P16, que tem relação com o desenvolvimento do melanoma, o câncer de pulmão, câncer de mama e câncer colorretal. A deleção da proteína P27 é comum no câncer de mama, câncer de próstata, câncer de cólon e câncer gastrointestinal. Assim, a eliminação do inibidor endógeno de CDKs ou mutação genética é uma referência importante para o diagnóstico do tumor. Os pequenos inibidores endógenos da molécula são também uma classe de importantes RNAs não codificantes descobertos nos últimos anos. As regiões do sítio-alvo ligam-se umas às outras para degradar rápida e eficientemente o ARNm ou inibir a tradução da proteína, controlando a proteína a um nível inferior ou óptimo e exigindo actividades de vida. Mais de 10 microRNAs foram descobertas envolvidas na regulação do ciclo celular. Entre eles, o cdk4 alvo miR1-2 e miR3-4, respectivamente, e o ciclo celular é preso na fase G1, que inibe a proliferação de células tumorais; o miR-22 tem como alvo as células CDK6. O ciclo está estagnado na fase G1, que induz a senescência nas células do câncer de mama. Em diferentes processos biológicos, estas miRNAs regulam a progressão do ciclo celular visando E2F, CDK, Cyclin, P21, P27, DNA polimerase Alfa, etc. promover ou bloquear os reguladores-chave do ciclo celular. Os inibidores exógenos incluem ácidos nucleicos antissensos, anticorpos, pequena interferência no ARN (siRNA) e compostos moleculares pequenos. Compostos moleculares pequenos são a classe mais importante de inibidores CDK exógenos. Nos últimos anos, como a compreensão da estrutura cristalina permite que as pessoas realizem estudos de simulação molecular, foram feitos avanços na concepção e desenvolvimento de estudos altamente eficientes e seletivos sobre inibidores químicos de CDKs. Pode dizer-se que esses compostos têm novos membros todos os dias. No presente, a pequena molécula de inibidores de CDK podem ser divididos em 13 categorias, Roscovitine e Olomouc, Pyrimidines (PD-033299), Flavonóides (Flavopiridols), Thiazoles (SNS03), antraceno e seus derivados (SU951), piperidone (Paullones), imidazopyridine, pyrazolopyridine (AZ703), pyrazines ( AT751), butirolactona-1 (butirolactona-1), scorpionine (UCN-01) e de outras duas espécies. Treze pequenos inibidores moleculares entraram em ensaios clínicos. Eles são todos produtos químicos de moléculas pequenas de heterociclos planares que competem com ATP para a ligação ao local de ligação ATP de CDK kinase. Experiências In vivo mostraram que CYC202 tem boa resistência a drogas e boa atividade fisiológica oral e tem efeitos inibitórios óbvios sobre tumores sólidos em ratos nus inoculados por câncer de cólon humano e células cancerosas uterinas. Em estudos de fase Ib, 10 pacientes com câncer de ovário estavam tomando CYC por mais de 20 meses, sem aumento de tumores ou efeitos colaterais graves relacionados ao tratamento, entre os quais o tumor de um paciente diminuiu em mais de 30%, e alguns pacientes que foram tratados por mais de um ano têm uma condição estável. Os estudos clínicos de fase II revelaram que o CYC202, por si só, tem um efeito ligeiramente inferior e é eficaz em combinação com outros medicamentos quimioterapêuticos. Estão também em curso ensaios clínicos de fase IIb do CYC202 em associação com a capecitabina para o tratamento do cancro da mama, combinados com 2,2-difluorodeoxicitidina ou cisplatina para o tratamento do cancro do pulmão e do carcinoma nasofaríngeo. O desenvolvimento e a aplicação de tecnologia de interferência de RNA de moléculas de pequena molécula possibilitaram o estudo da expressão genética de moléculas alvo de intervenção específica, e muitos cientistas começaram a intervir na síntese de CDK/Cyclin a nível genético. Limaet al. transfected CyclinE-targeting siRNA into Hep3B, HepG2, SNU449 (CyclinE overexpression) and HuH7 (CyclinE overexpressed) and found that CyclinE expression was reduced by 90% in cells. A síntese de DNA é significativamente reduzida, e as células passam por apoptose. Galimberti et al. siRNA transfected targeting CyclinE, CDK2, and CDK1 into mouse lung cancer cells HOP-62, H-522 and H-23, respectively, and found that CyclinE/CDK2 can induce apoptosis and inhibit the proliferation of lung cancer cells. A diminuição da expressão do CDK1 causada pela interferência do siRNA do CDK1 apenas causa a paragem da fase celular e atrasa a proliferação celular; enquanto a co-interferência do siRNA do CDK1 e do CDK2 leva a uma diminuição simultânea da expressão do CDK1 e do CDK2, causando resistência nas fases do ciclo celular S e G2/M. A estagnação também induziu apoptose das células. Cao Yinfang e outros bem sucedidos de transfeccao de CDK2/CyclinE siRNA recombinante, vetor de expressão em células HepG2 mostrou que CDK2 e CyclinE expressão de mRNA diminuiu significativamente, ciclo celular foi preso na fase S, G1 fase células aumentou significativamente, de caspase-3 atividade avançado, células HepG2 foram submetidos a apoptose, e o ciclo celular alterações foram consistentes com a diminuição da proliferação de HepG2 cellsin vitro após transfection.com o aprofundamento da compreensão do importante papel da regulação do ciclo celular na formação de tumores e apoptose, a regulação do ciclo celular foi mais estudada na resistência à quimioterapia tumoral. Cinases dependentes de ciclinas (Cdks), que desempenham um papel na condução do motor celular durante o ciclo celular, são alvos ideais para a terapia tumoral. A maioria das células cancerígenas tem activação, sobreexpressão do gene do ciclo de divisão celular (cdk) e defeitos na função CDKIs. O inibidor CDK exerce uma acção de interrupção que inibe o ciclo celular. Nos últimos anos, os CDKIs tornaram-se um dos principais destaques da terapia do cancro, que inibe a actividade dos CDKs no ciclo celular. Uma série de estudos clínicos também demonstraram que uma única aplicação pode ter efeitos moderados. No entanto, em combinação com as drogas quimioterápicas citotóxicas tradicionais, a CDKIs pode melhorar significativamente o efeito anti-tumor das drogas quimioterápicas tradicionais. Portanto, a pesquisa sobre os efeitos anticancerígenos dos medicamentos CDKIs e outros medicamentos quimioterapêuticos tornou-se um ponto quente no tratamento atual da resistência tumoral.
Reference
- Bendris N, Lemmers B, Blanchard J M. Cell cycle, cytosqueleton dynamics and beyond: the many functions of cyclins and CDK inhibitors. Ciclo Celular. 2015, 14(12):1786-1798.Pitts T m, Davis S L, Eckhardt S G, et al. Visando cinases nucleares no cancro: desenvolvimento de inibidores da cinase do ciclo celular. Farmacologia & terapêutica. 2014, 142(2):258-269.Stone A, Sutherland R L, Musgrove e A. inibidores do ciclo celular cinases: recent advances and future prospects as cancer therapeutics. Crit Rev Oncog. 2012, 17(2):175-198.Xu W, Mcarthur G. regulação do ciclo celular e Melanoma. Relatórios Actuais De Oncologia. 2016, 18(6):34.Malumbres m, Barbacid M. Cell cycle, CDKs and cancer: a changing paradigm. A Natureza Analisa O Cancro. 2009, 9(3):153-166.
