Breve descrição de dois tipos de morte celular programada: apoptose e autofagia
a Apoptose, ou tipo I, morte celular programada, é o mais amplamente estudado as formas de morte celular. Suas características morfológicas podem ser identificadas sob microscopia de luz, e incluem célula de encolhimento, a compactação da cromatina, blebbing da membrana citoplasmática, e, finalmente, a formação de corpos apoptóticos (Figura 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
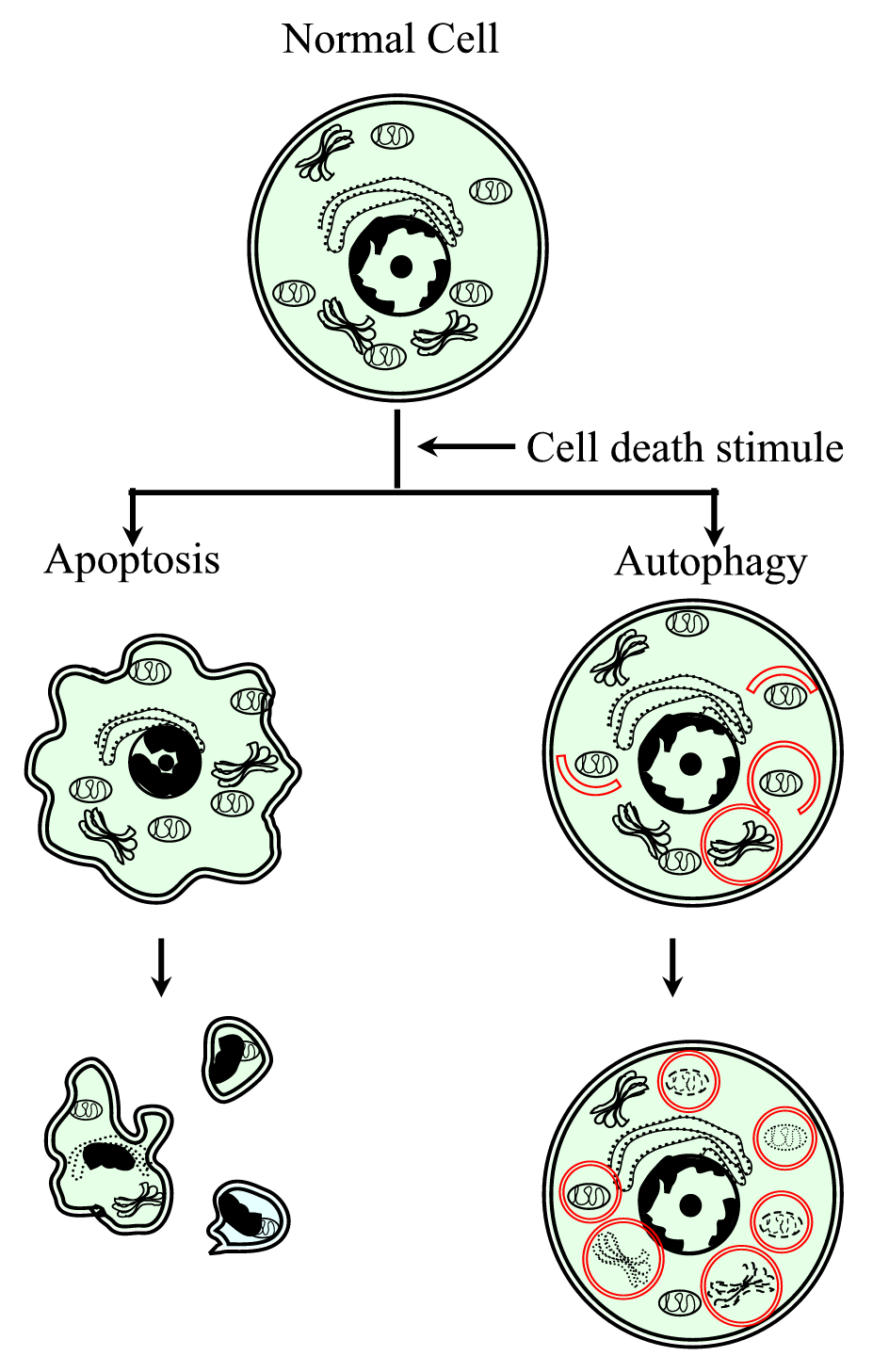
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi = “http://www.w3.org/2001/XMLSchema-instanceRepresentação esquemática do processo de morte celular programado tipo I (apoptose) e tipo II (autofagia). A apoptose é caracterizada por uma contração celular, compactação cromatina, blebs membranosos e a formação de corpos apoptóticos. A autofagia é caracterizada pela presença de um grande número de autofagossomas com conteúdo citoplasmático. Ambos os tipos de morte celular não geram uma resposta inflamatória, uma vez que a membrana citoplásmica é conservada até que os detritos celulares sejam eliminados por vizinhança ou por especialistas.
Caspases são proteases específicas do cisteinil-aspartato que são sintetizadas numa forma inactiva como zimogénios chamados pro-caspases (Figura 2). É esta forma inactiva que permite a execução controlada do processo de morte celular. Caspases foram identificadas pela primeira vez no nematode Ceanorhabditis elegans, mas formas homólogas estão presentes em mamíferos .
As características da apoptose, tais como a fragmentação do ADN e a cromatina compactada, resultam da actividade da caspase. Durante a apoptose, o DNA é fragmentado em tamanho nucleossomo (200 bp) . O factor responsável pela fragmentação do ADN durante a apoptose é uma DNase específica (DNase activada pela caspase-3 activada pela caspase-activa). A caspase-3 activa, por sua vez, está envolvida em alterações morfológicas das células durante a apoptose, onde cliva a cinase-1 (rocha-1) associada ao rho, de modo a activá-la, e isto, por fim, afecta o arranjo citosquelético causando a morfologia de retracção apoptótica .

Figura 2.
xmlns: xlink=”http://www.w3.org/1999/xlink ” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancePassos envolvidos no processo apoptótico são resumidos em uma forma inativa como zymogens, são constituídos por uma pro-domínio, um grande subunidade, e uma pequena subunidade. Os zymogens são activados formando tetramers.
apoptotic cell death is highly regulated by members of the B-cell lymphoma 2 (Bcl-2) family . Os membros da família Bcl-2 foram classificados como proteínas anti-apoptóticas e pro-apoptóticas de acordo com sua homologia Bcl-2 (BH) e organização do domínio (Figura 3). A presença de domínios BH1, BH2, BH3 e BH4 corresponde ao grupo que inibe a apoptose. O grupo pro-apoptótico, em contraste, é dividido em dois grupos: aqueles com domínios BH1, BH2, e BH3, e aqueles com apenas os domínios BH3 (definido como apenas BH3; ver a revisão em ). Esta família de proteínas desempenha suas funções no nível intracelular dentro da mitocôndria, um elemento chave na apoptose.

Figura 3.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancelinfoma de células B 2 (Bcl-2) proteínas familiares. A) esquema geral da estrutura das proteínas Bcl-2. B) os membros anti-apoptóticos – possuem todos os quatro domínios BH. C) os membros pro-apoptóticos que por sua vez são divididos em dois grupos: multidomain e BH3 apenas.
apoptose pode ser iniciada por duas vias bem descritas: as vias extrínsecas e intrínsecas (Figura 4). A ativação extrínseca é conduzida através da participação de ligantes da morte (tais como o Fator de necrose tumoral – TNF – superfamília, e ligantes induzidos pela apoptose TNF, ou trilha) com seus receptores de morte da superfície celular cognato (tais como receptor TNF 1, Fas, receptor de trilha 1, ou receptor de trilha 2) (revisado em ). Uma vez que o ligante reconhece e títulos, para o seu receptor, uma série de intracelulares complexos são formados para ativar o iniciador passos (como -8 e -10), que, em seguida, ativar o carrasco passos (como -3, -6 e -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. A interação ligando-receptor induz o conjunto do complexo sinalizador indutor da morte (DISC) para promover a ativação da caspase-8, que por sua vez é capaz de ativar ao executor caspase-3, -6, ou -7, conduzindo às alterações morfológicas da apoptose. A via intrínseca é dirigida pela permeabilização da membrana exterior mitocondrial, que permite a libertação de elementos pro-apoptóticos como citocromo-C. O citocromo-c induz a apoptose factor activador da protease 1 (Apaf-1) para promover a activação da caspase-9 para montar o apoptossoma. O apoptossoma é capaz de ativar para o executor caspases.
a via apoptótica intrínseca, em contraste, pode ser activada por vários estímulos, incluindo danos ao ADN, fome do factor de crescimento e stress oxidativo . Durante a exposição das células a estes estímulos, as mitocôndrias são afetadas, uma vez que vários membros da família Bcl-2 são ativados e promovem a permeabilização da membrana externa da mitocôndria (MOMP). A membrana mitocôndria externa permeada permite a libertação do citocromo c (cyt c), que está associado com a proteína Apaf-1. A União cyt C e Apaf – 1 Então se liga ao iniciador caspase-9 para formar o complexo que constitui o apoptossoma, que tem a capacidade de ativar as caspases iniciadoras que executam suas funções através da clivagem de substratos celulares específicos.
O segundo processo de morte celular, autofagia, é um processo geneticamente programado e evolutivamente conservado que produz a degradação de organelas e proteínas obsoletas. Ele é ativado por tais estímulos extracelulares como a fome de nutrientes, hipoxia, alta temperatura, e Condições intracelulares alteradas, incluindo a acumulação de organelas danificadas ou supérfluas (revisadas em ).
em organismos eucarióticos, foram descritos três tipos de autofagia: microautofagia, macroautofagia (comumente chamada simplesmente autofagia) e autofagia mediada por chaperona (Figura 5). Microautophagy envolve o engolfando de citoplasmática componentes diretamente no nível do lisossomo, por meio de um processo de invaginação, enquanto macroautophagy pressupõe a formação de dupla membrana das vesículas que contêm componentes celulares, que se fundem com o lisossomos para formar um autophagolysosome. É dentro do autofagolisossoma que os componentes intra-vesiculosos são degradados e, se possível, reciclados pela célula (revisados em ). A autofagia mediada pela chaperona, finalmente, implica a participação de chaperonas no reconhecimento das proteínas designadas para eliminação pelos lisossomas .

Figura 5.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancea representação Esquemática dos diferentes mecanismos de autofagia. Macroautofagia – autofagia-implica a formação de uma vesícula de membrana dupla, que engole o conteúdo citoplasmático que será conduzido para o lisossoma a ser degradado. A microautofagia é caracterizada pela absorção direta de componentes citoplásmicos pelo lisossomo. Este processo envolve a remodelação da membrana da organela, formando uma invaginação da membrana lisossómica. Durante a autofagia mediada por chaperona, as proteínas a serem degradadas são direcionadas para um Hsp70, que por sua vez transportam a carga-alvo para o lisossomo.
autofagia é dirigida por genes Atg(relacionados com a autofagia), que são necessários para ativar o complexo sinalizador que desencadeia a formação de autofagossomas . Atgenes foram descobertos em leveduras, mas muitos têm ortólogos em eucariotas superiores (Figura 6). A formação de autofagossomas implica a participação da proteína citoplasmática LC3 (Atg8), que sofre lipidação por fosfatidiletanolamina, e é então recrutada para a nascente membrana autofagosómica (Figura 7). A acumulação de proteína LC3 lipidada (conhecida como LC3-II) é utilizada como marcador de autofagia .

Figura 6.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. A proteína LC3 é lipidada pela fosfatidiletanolamina.
morte celular Autofágica, ou morte celular programada de tipo II, é caracterizada por uma grande absorção do citoplasma por vesículas autofágicas. Esta atividade autofágica intensa difere substancialmente da autofagia que ocorre continuamente em níveis basais. Estudos Ultra-estruturais em Drosophila revelaram a acumulação de vacúolos autofágicos na maioria dos tecidos larvares. Este tipo de morte celular programada começa com a degradação das organelas citoplasmáticas por autofagia, embora os elementos citoesqueléticos sejam conservados até os estágios finais do processo (revisado em ).
