introdução
células citotóxicas fazem parte integrante da luta contra as células infectadas pelo vírus e as células cancerígenas. Estas células matam através de três vias diferentes, a libertação de grânulos líticos, a via receptor-ligante Fas, ou a via receptor TRAIL–TRAIL. Para o propósito deste artigo, vamos nos concentrar na degranulação. Quando uma célula citotóxica encontra uma célula-alvo, adere firmemente a ela formando a sinapse imunológica. Os grânulos líticos são então polarizados em direção à Sinapse imunológica e liberados da célula citotóxica direcionada para o alvo (1). Estes grânulos contêm vários mediadores citotóxicos, tais como a perforina e as granzimas. A perforina libertada pode formar poros transitórios dentro da membrana da célula-alvo, permitindo que as granzimas entrem na célula-alvo. A entrada também é provavelmente mediada por oligómeros de perforina formando poros incompletos (arcos) (2), e também foi sugerido que as granzimas e a perforina podem ser absorvidas pelas células alvo através da via endossómica (3, 4). Os dados subjacentes a estes mecanismos propostos foram recentemente discutidos em pormenor (5). Quando as granzimas entram nas células-alvo, a via caspase é activada, resultando em apoptose (6, 7). A membrana destes grânulos citotóxicos contém glicoproteína-1 (LAMP1), também conhecida como CD107a (8), associada ao lisossoma. A parte luminal do rato CD107a é transitoriamente exposta ao lado extracelular da membrana celular após a degranulação antes de ser novamente internalizada. Portanto, a coloração CD107a indica que ocorreu um evento de degranulação (9). Enquanto o papel do CD107a ainda está sendo determinado, os estudos do siRNA contra o CD107a mostraram que é essencial para o tráfico de perforina dentro das vesículas, uma vez que a entrega de perforina para grânulos líticos é inibida na ausência do CD107a (10). Também foi demonstrado que o CD107a tem um papel na protecção das células citotóxicas da morte, ligando-se à perforina e impedindo a inserção na membrana celular (11).existem dois tipos principais de linfócitos citotóxicos, células assassinas naturais (NK) e células T CD8. Ambos os tipos de células matam através da libertação de grânulos líticos, a via do receptor Fas/ligando Fas e a via do receptor TRAIL/TRAIL, mas o estímulo necessário para ativar estes dois grupos de células é diferente. As células T reconhecem o antigénio apresentado pelas moléculas MHC classe I através do seu receptor de células T activante (TCR), enquanto as células NK reconhecem os antigénios das células alvo através de vários receptores inibitórios e activadores. Os receptores inibitórios são importantes para evitar que as células NK matem células saudáveis enquanto que os receptores activadores induzem citotoxicidade das células NK.
antes da identificação do CD107a como marcador para a degranulação nas células NK (12), a saída para medir a capacidade citotóxica foi a morte das células-alvo. A detecção de CD107a por citometria de fluxo permitiu aos investigadores identificar as células efectoras específicas com capacidade citotóxica. Desde a sua descoberta, uma grande variedade de publicações de dados de Estudos em ratos e humanos foi concluída mostrando a vantagem de usar um anticorpo anti-CD107a. O rato é um modelo animal imunológico valioso para o estudo de doenças como leucemia e enxerto vs. doença do hospedeiro (13), mas as leituras funcionais têm sido prejudicadas pela falta de anticorpos anti-rato específicos de alta qualidade para a citometria de fluxo. This paper describes the creation of an anticorpo toward rat CD107a and characterization of the degranulation response in rat NK and CD8+ T cells.
materiais e métodos
animais
hamsters inbred Arménios (Cytogen Research and Development Inc., MA, EUA) foram alojados no departamento de Medicina comparativa em Rikshospitalet, Hospital da Universidade de Oslo, de acordo com as Diretrizes institucionais. O rato cepas PVG-RT1U, PVG-RT7b, PVG-RT1N, e PVG-R23 foram usados de forma intercambiável e mantida por mais de 20 gerações e alojados em conformidade com as diretrizes definidas pelo Animal Experimental Conselho de acordo com o Ministério da Agricultura de Noruega e pela Convenção Europeia para a Protecção dos Animais Vertebrados utilizados para fins Experimentais e Outros Finalidade Científica. Os ratos foram utilizados com a idade de 8-12 semanas. As instalações dos animais de laboratório são submetidas a um programa de monitorização da saúde de rotina e testadas para pesquisa de organismos infecciosos de acordo com uma modificação das recomendações da Federação Europeia de Ciências Animais de laboratório. As experiências com animais foram regulamentadas através de regulamentos laboratoriais, que são apresentados pela Lei relativa ao bem-estar dos animais, na qual a Noruega segue a direcção laboratorial da UE e a Convenção laboratorial Europeia.
Abs e reagentes
anticorpos contra Nkp46, NKR-P1A 3.2.3-PB, ou unconjugated (obrigatório apenas NKR-P1A, mas não NKR-P1B, no PVG deformação), CD8 (OX8-biotina), CD2 (OX34, unconjugated), TCR (R73-Alexa647), o mouse IgD b allotype (TIB96-unconjugated, usado como mouse IgG isotype), e CD45.2 (His41-FITC, usado como mouse IgG isotype) foram feitas em nosso laboratório e conjugados de acordo com protocolos padrão. Os anticorpos contra o CD3 (IF4, não conjugados) e a sua IgM do rato isótipo (MM-30, não conjugada) e o controlo do isótipo da IgG do hamster Arménio (HTK88-FITC) foram comprados a Biolegend (San Diego, CA, EUA). Os anticorpos anti-CD107a comerciais foram comprados a AbCam (Cambridge, Reino Unido) (H4A3-FITC), eBioscience (San Diego, CA, EUA) (ID48-PerCP-eFluor), e Lifespan (Seattle, WA, EUA) (LS-C8580-não conjugados). LS-C8580 foi conjugado com o éster ALEXA488 NHS (Sigma-Aldrich, St. Louis, MO, EUA) para uso em ensaios funcionais. Anticorpos anti-bandeira (M2, não conjugados) e IgG anti-rato (cabra policlonal-FITC) foram comprados a Sigma-Aldrich (St.Louis, MO, EUA). O IL-2 foi obtido a partir de uma cultura celular dialisada sobrenadante de uma linha celular de ovário de hamster chinês (CHO) transfectada de forma estável com uma construção de expressão IL-2 do rato. A streptavidina conjugada com proteína Peridinina clorofila-A (PerCP), o controlo do isotipo policlonal do hamster FITC, o controlo do isótipo IgG1 do Ratinho FITC (MOPC-FITC) e o GolgiStop foram comprados na BD biosciences (Franklin Lakes, NJ, EUA). O hamster anti-arménio de cabra (policlonal-FITC) foi comprado à Jackson Immunoresearch (West Grove, PA, EUA). Sobrenadante de hybridomas OX41, CD172a (SIRPa), 73 (anti-rat TCRaß), OX19 (anti-CD5), OX12 (anti-Igk cadeia), e OX33 (anti-CD45RA) foram feitas em casa. O soro do hamster Control foi derivado de hamsters Arménios não imunizados.
a clonagem de ratos CD107a
Rat CD107a foi amplificada por PCR a partir de cDNA gerado a partir de splenócitos de ratos PVG e subclonado em um vetor de expressão pMX contendo um gene de resistência à puromicina (um dom generoso do Dr. Michael R. Daws) (14). Os primers CD107 foram projetados com base em uma sequência cd107a (LAMP1) cDNA de ratos (GenBank: NM_012857). Iniciador da frente: 5′-GCCCCAGCACTGTTCGAGGT-3′; iniciador inverso: 5′ – GTTGTTACGTCTGTACACACT-3′. Um peptídeo líder aniônico tripsin – 1 (MSALLILALVGAAVA) foi usado na expressão vetor, e a região transmembranar CD107 original foi substituída por um fragmento transmembranar CD8 para facilitar a expressão de alta superfície. Uma marca de bandeira (DYKDDDK) foi ligada ao N-terminal da proteína CD107 para fazer a expressão da superfície detectável. Todas as sequências inseridas e estrutura de leitura aberta na construção final de plasmídeos quiméricos foram examinadas e confirmadas pela sequenciação de ADN de Sanger.
transferindo BWZ.36 células com plasmídeo pMX-CD107a
293T foram semeadas numa placa de cultura de 6 células com meio RPMI 1640 de 4 ml, transfectadas com 7, 5 µl de reagente FuGENE6 (Roche, protocolo do fabricante) e incubadas a 37°C com 5% de CO2. O reagente FuGENE6 foi pré-diluído com Opti-MEM (Gibco) e misturado com 1, 5 µg de plasmídeo pMX-CD107a e 1 µg de plasmídeo retroviral específico pCL-ECO roedor (Addgene #12371). Vinte e quatro horas após a transfecção, o sobrenadante foi descantado e substituído por meio RPMI1640 com 2% de FBS e transferido para 32°C para produção retroviral. Quarenta e oito horas depois, o sobrenadante foi colhido e filtrado com um filtro de filtropur s de 0,2 µm (Sarstedt) e guardado a -80°C para transdução retroviral.105 BWZ.36 células foram semeadas por alvéolo numa placa de cultura de 24 alvéolos (Corning) e cultivadas com meio fresco RPMI1640 com 10% de FBS, durante a noite. O sobrenadante foi removido e RPMI1640 contendo 10% de FBS, 16 µg de polibreno (para uma concentração final de 8 µg/ml) e 1,5 ml de sobrenadante retroviral foi adicionado e centrifugado a 32°C a 2400 rpm durante 2 h. As células foram então incubadas a 32 ° C durante 1 h, após o que o sobrenadante foi removido e substituído por meio RPMI1640 fresco com 10% de FBS e cultivadas durante 3 dias, a 37°C com 5% de CO2 (no dia 2, pode utilizar-se um meio completo com 1 ng/ml de puromicina). Os transfectantes de bandeira BWZ.CD107a expandidos foram examinados para a expressão da marca da bandeira na superfície e, em seguida, foram usados para imunização de anticorpos ou rastreio de anticorpos.o plasmídeo de rato chimérico CD107a foi transfectado em células CHO. Brevemente, as células CHO foram cultivadas em meio RPMI1640 completo (cRPMI; RPMI1640 meio com 10% de FBS, 1mm na piruvato, 50µM 2-mercaptoetanol) até atingirem a confluência de 30%. O plasmídeo de 2, 5 µg foi misturado com 7, 5 µl de reagente Fugene 6 (Roche) e adicionado às células gota a gota. Dois dias depois, as células CHO foram destacadas com meio RPMI1640 complementado com EDTA 2mM e foram semeadas em placas de cultura de células inferiores bem planas (25 células/alvéolo) com meio de selecção (cRPMI complementado com 20 µg/ml de puromicina) para clonagem de transfectantes estáveis. Após 10-12 dias de cultura, os clones adultos foram rastreados com anticorpo anti-FLAG (M2). Um dos clones expressando o mais alto nível de superfície da bandeira e CD107a foi usado para imunizações.
imunização e fusão celular
os hamsters inbred arménios de 3 a 10 semanas de idade foram imunizados por injecções intraperitoneais (I. p.) com 2 × 106 células do CHO. CD107a uma vez por semana durante 3 semanas. Um impulso com 4 × 106 células BWZ.CD107a transfectadas de forma estável foi dado I. p.32 dias após a primeira imunização e os soros foram analisados para coloração superficial de ambas as células CHO.CD107a-FLAG e BWZ.Cd107a-FLAG transfectants. Dois dos três animais foram positivos, e 3 dias após o reforço, as células do baço foram colhidas e combinadas dos dois animais, Um dos quais tinha esplenomegalia. Cerca de 2, 0 × 108 células de baço e 1, 4 × 108 células de mieloma foram lavadas três vezes em DMEM com aditivos (1mm de piruvato de sódio, 0, 05 mM de 2-mercaptoetanol e antibiótico/Antimicótico) e centrifugadas a 90 g durante 10 minutos. Mantendo tudo a 37°C Deste ponto para a frente, o sedimento foi dissolvido batendo no tubo e adicionou-se polietilenoglicol 1500 (Roche), gota a gota, enquanto se agitava suavemente durante 1 minuto. Foram gradualmente adicionados três mililitros de DMEM com aditivos para os próximos 3 minutos de acabamento com um adicional de 7 ml antes da centrifugação a 500 g. o sedimento foi lavado com um autoclismo cuidadoso (sem ressuspensão) com DMEM com aditivos e 20% de FBS (DMEM-20) e cultivado durante a noite. As células foram colhidas no dia seguinte e foram adicionados 100 ml de DMEM-20 com 2× hipoxantina–aminopterina–timidina (SIGMA) e 10% de suplemento de clonagem de hibridoma (HCS) (PAA). A suspensão celular foi transferida para placas de 96 poços. Após 12 dias, sobrenadantes de clones em crescimento foram testados por citometria de fluxo para coloração de antigénios de superfície presentes em BWZ.CD107a-FLAG e CHO.CD107a-FLAG, mas não em BWZ.36 células transferidas com antigénios marcados irrelevantes como controlos negativos. Os 9 dos 12 clones positivos que produziram anticorpos específicos foram ainda subclonados utilizando DMEM-20, complementados com hipoxantina-timidina e HCS. Apenas um clone (SIM1) ainda produziu anticorpos após subclonagem e este foi mais uma vez subclonado. Anticorpos IgG específicos do hamster CD107a foram detectados pela IGG anti-Armenian hamster FITC (Jackson Immunoresearch). O anti-CD107a do hibridoma SIM1 foi purificado pela proteína G HP HiTrap (GE Healthcare, Life Sciences) e conjugado FITC de acordo com procedimentos padrão ou conjugado Alexa488 de acordo com o protocolo do fabricante.a partir do baço prepararam-se suspensões de células efectoras. Os linfócitos foram isolados utilizando um gradiente de Linfoprepo e, em seguida, passam por uma coluna de lã de nylon para remover células B e macrófagos. Para a geração de células NK activadas por IL-2 (LAK), as células restantes foram cultivadas durante a noite em IL-2. No dia seguinte, as células não aderentes foram removidas por lavagem com PBS e as células NK aderentes foram mantidas em RPMI complementadas com IL-2, 10% de FBS inactivados pelo calor, 1% de estreptomicina/penicilina, 1mm de piruvato de sódio e 50 µM de 2-mercaptoetanol. As células foram cultivadas durante 8-10 dias. Para a geração de células NK enriquecidas ou de células T e NK separadas, as células foram enriquecidas por seleção negativa após a etapa de lã de nylon. Para o enriquecimento de células NK, pan-mouse IgG Dynabeads (Invitrogen Dynal) foram revestidos com anticorpos contra macrófagos (OX41), células T (R73 e OX19), e as células B (OX12 e OX33). Para o enriquecimento das células T, as Dinabeads IGG pan-mouse foram manchadas com anticorpos contra os macrófagos (OX41) e as células B (OX12 e OX33). As células foram enriquecidas por dois passos de selecção negativa com esferas manchadas durante 30 minutos a 4 ° C. As células NK enriquecidas tinham uma pureza de aproximadamente 50-60% e foram utilizadas para estudos de degranulação. As células T enriquecidas (79-85% de pureza) foram ainda separadas para as células TCR+ utilizando uma Aria FACS (Biociências BD).
Degranulação Ensaios
Para medir a degranulação de resposta por coloração com anti-rat CD107a (SIM1) durante a célula-alvo estimulação, NK processadores de efeitos e YAC metas células foram incubadas, em uma razão de 1 para 1 de 3 × 105 células/poço (excepto se declarado o contrário), em meios contendo o SIM1 ou o mAb, a outros disponíveis comercialmente anti-CD107a anticorpos, ou isotype de controle. Para medir a resposta de degranulação à estimulação de anticorpos a partir de células NK, utilizámos placas de fundo plano com 96 alvéolos revestidas com concentrações variáveis de anti-NKp46 (Wen23), anti-NKR-P1A (3.2.3) e um controlo do isótipo IgG1 do rato (TIB96). No dia seguinte, as placas foram lavadas com PBS e bloqueadas com cRPMI antes da adição de 3 × 105 células NK enriquecidas suspensas em cRPMI contendo SIM1 foram adicionadas por Poço. Para medir a degranulação das células T, foram classificadas e cultivadas em cRPMI com IL-2 durante 2-3 dias. As placas de fundo com 96 alvéolos foram revestidas durante a noite com anticorpos contra CD3 (IF4), CD2 (OX34), ou um controle de isótopos de IgM (MM-30). Cerca de 3 × 105 células T foram adicionadas por poço em cRPMI contendo SIM1. Todos os ensaios foram incubados por 4 h. Golgistop foi adicionado durante os últimos 3 h de incubação para evitar a degradação do internalizado CD107a. As células foram então lavadas e coradas com anticorpos para o adequado superfície receptores e analisados utilizando o FACS Canto ou LSR II (BD Biosciences).ensaio de Libertação de crómio YAC – 1 células alvo (5 × 106 células/ml de cRPMI) com adição de 3.Incubaram-se 7 MBq51Cr a 37°C durante 1 h, mexendo a cada 15 minutos. As células foram então lavadas três vezes com PBS com 2% FBS e ressuspendidas para 1 × 105 células/ml em cRPMI. As células efectoras de LAK e as células-alvo foram revestidas com as razões especificadas num volume final de 200 µl. As células foram centrifugadas e incubadas durante 4 h a 37°C. A libertação específica de 51Cr foi medida utilizando o Cobra auto-Gama (Packard).
resulta em
para criar um anticorpo contra o CD107a, fizemos um vector de expressão contendo a região extracelular da membrana do rato CD107a, a região transmembranar do rato CD8, e uma marca de 3′-terminal para detectar a expressão da superfície (figura 1A). O vector foi transfectado em células CHO e no BWZ.Linha de 36 T de células e rastreada para a expressão CD107a utilizando um anticorpo anti-FLAG (M2) (figura 1B). Foram injectadas células-CHO stavelmente transfectadas CD107a em hamsters inbred Arménios uma vez por semana durante 3 semanas com um impulso final de células BWZ transfectadas stably CD107a 3 dias antes da fusão com a linha celular de mieloma NS0. Sobrenadantes dos diferentes clones foram testados quanto à especificidade para BWZ.CD107a-FLAG, mas não irrelevantes BWZ marcado com bandeira.36 transfectantes. Um clone, SIM1, foi encontrado para se ligar especificamente ao CD107a expressando transfectante, mas não ao controle transfetado da bandeira (figura 1C).

Figura 1. Geração de um anticorpo monoclonal CD107a Anti-rato (SIM1). A) mapa esquemático do vector de expressão do pMX com péptido líder, marca-bandeira, inserção CD107a e domínio transmembranar do CD8. B) ovário de hamster chinês e BWZ transfectados de forma estável.Foram testadas 36 células para a expressão da superfície celular do CD107a marcado com bandeira utilizando um anticorpo anti-bandeira (M2) (histogramas sombreados). O controlo negativo é apenas o anticorpo secundário (histograma transparente). C) As células BWZ transferidas com a bandeira CD107a ou antigénio irrelevante (bandeira NKR-P1F) foram manchadas com soro de controlo de hamster, sobrenadante SIM1 ou um anticorpo anti-FLAG (M2).
o clone SIM1 foi ainda testado em ensaios funcionais em paralelo com dois anticorpos CD107a comercialmente disponíveis, que poderiam potencialmente reagir cruzada com CD107a de rato na citometria de fluxo. O anticorpo clones testados foram H4A3 da AbCam (que cruz reage com humanos, rato, rato, e primatas em citometria de fluxo) e o anticorpo clone LS-C8580 de Vida Biociências (que cruz reage com CD107a do mouse, humanos e ratos, imunohistoquímica e Western blots de acordo com o site do fabricante). O nosso clone de anticorpos SIM1 identificou células degranuladoras na presença de células alvo e mostrou pouca coloração de fundo na ausência de alvos (figura 2A do painel superior). O Clone H4A3 manchou a maior percentagem de células NK após estimulação das células alvo (painel médio). No entanto, houve também um elevado nível de coloração de fundo na ausência de células alvo, indicando ligação não específica. Níveis muito baixos de degranulação, se houver, foram medidos pelo clone LS-C8580 mAb (Painel inferior). A especificidade destes anticorpos foi confirmada por coloração positiva do transfectante BWZ.CD107a-FLAG, mas não BWZ.Controlo da bandeira NKR-P1F (figura 2B). O anticorpo clone H4A3, que tem sido mostrado para ligar para humanos CD107a (16), não mancha rat CD107a transfected BWZ células, indicando que não há nenhuma reação transversal com ratos CD107a. O anti-mouse CD107a clone ID48 também não mancha o rato CD107a transfectant. LS-C8580 não conjugados, por outro lado, mostraram coloração específica de células transfectadas CD107a (dados não mostrados). No entanto, o clone LS-C8580 só está disponível como anticorpo não conjugado que não é adequado para estudos de degranulação. Tentativas repetidas em nosso laboratório para conjugar LS-C8580 para Alexa488, infelizmente, não forneceu qualquer forte coloração conjuga, embora o pequeno tamanho da amostra e a concentração de LS-C8580 pode ser a causa dos pobres conjugação. O LS-C8580 conjugado mostra coloração reduzida, mas específica, das células transfectadas CD107a (figura 2B), mas, como mostrado na figura 2A, Não fomos capazes de detectar células degranuladoras durante os ensaios funcionais com este conjugado. Em conclusão, o mAb SIM1 mancha especificamente as células NK do rato desgranulantes após estimulação com as células alvo.

Figura 2. SIM1 mede a degranulação a partir de células NK e T CD8. (A) A percentagem de células degranuladoras foi medida utilizando anticorpos anti-CD107a SIM1, H4A3 e LS-C8580, com ou sem células alvo YAC-1 como estímulo. Uma experiência representativa de quatro é apresentada (B). Coloração da linha de células BWZ.CD107a-FLAG com clones de anticorpos SIM1, H4A3, LS-C8580 ou ID48. BWZ.36 células transfectadas com antigénio marcador irrelevante (BWZ.NKR-P1G-FLAG) foi incluído como um controle negativo, (C) As células NK enriquecidas foram estimuladas com anti-NKp46, anti-NKR-P1A, ou rato IgG1 como controle isótipo, e SIM1 foi usado para medir a percentagem de células degranuladoras. As células NKp46+ (Wen23) ou NKR-P1Abright (3.2.3) foram associadas. D) as células TCR+ foram classificadas (Pureza 99%) e cultivadas em IL-2 durante 2-3 dias. As células foram então estimuladas com o Controlo anti-CD3 e anti-CD2 ou o isótipo da IgM do rato para anti-CD3. O painel inferior mostra estimulação com anti-CD3 e anti-CD2 e coloração com um controlo isótipo SIM1 (FITC hamster IgG policlonal). As células T foram separadas utilizando anticorpos R73-Alexa647 e 3, 2, 3-PB, tratados com células R73+/3, 2, 3−. Os dados apresentados são de uma experiência representativa de três experiências independentes separadas.a estimulação directa dos receptores NK activadores através de anticorpos ligados em placas é outro método potente para induzir a degranulação. Para testar o clone SIM1 neste ensaio funcional, incubámos células NK enriquecidas em placas revestidas de anticorpos para os receptores activadores NKp46 e NKR-P1A (figura 2C). Como um controle negativo, as placas foram revestidas com o controle do isótipo IgG1 do rato. Coloração com o anticorpo SIM1 identificado 25, 5 ou 44% de células degranuladoras após estimulação das células NK em placas revestidas com 5 µg/ml de anti-NKp46 ou anti-NKR-P1A, respectivamente. A percentagem de células degranuladoras aumentou ainda mais quando as placas foram revestidas com uma concentração mais elevada de anticorpos estimulantes (10 µg/ml). Não foi induzida nenhuma degranulação em poços revestidos com o controle isotípico IgG1 do rato.vimos claramente a degranulação nas células NK estimulada com células alvo ou com anticorpos contra receptores de activação usando o nosso anticorpo SIM1. Também queríamos confirmar isso em células T citotóxicas. As células T foram separadas das células do baço e cultivadas em IL-2 durante 2-3 dias. As células T foram então estimuladas com anti-CD3 e anti-CD2 ligados à placa (figura 2D). A degranulação foi medida a partir de células T CD8+ cultivadas quando estimulada com anti-CD3 e anti-CD2 nos dois dias 2 e 3. Não foi medida qualquer degranulação a partir de células T CD4 não citotóxicas, ou após estimulação com anticorpos isotipos de controlo, demonstrando ainda mais a especificidade do nosso anticorpo SIM1.as células activadas por Linfocina (LAK) são criadas através da cultura de células NK na IL-2 durante 7-10 dias e são frequentemente utilizadas como células efectoras muito potentes nos ensaios de libertação de crómio para estudar a citotoxicidade, pelo que devem ser capazes de gerar níveis elevados de degranulação. Para medir a degranulação a partir de células de LAK, inicialmente usamos um 1:1 Relação do effector com os alvos, mas encontrou níveis inesperadamente baixos de degranulação (dados não apresentados). No entanto, fazendo uma titulação para encontrar o efeito ideal para as razões alvo vimos níveis crescentes de degranulação poderia ser alcançado quando os rácios efetor para alvo eram inferiores a 1 (Figura 3A). A razão óptima para os ensaios de degranulação é, portanto, contrária aos ensaios de citotoxicidade em que o nível de citotoxicidade aumenta com rácios efectores mais elevados: objectivos (figura 3B).
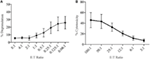
Figura 3. Efeito baixo:as razões-alvo são importantes para assegurar uma sensibilidade adequada nos ensaios de degranulação com células NK de rato. (A) degranulação das células de LAK cultivadas 8-10 dias em IL-2 contra alvos YAC-1 em diferentes efectores:rácios-alvo. B) a citotoxicidade do LAK cultivado IL-2 contra as células alvo YAC-1 foi confirmada com o ensaio de libertação de crómio concluído nos dias 8-10. Todos os gráficos são cumulativos de três ou mais experimentos separados com barras mostrando SD.
discussão
no teste inicial de SIM1 e os diferentes anticorpos comerciais CD107a em ensaios de degranulação no rato, escolhemos uma pequena gama de razões efetoras para alvo com uma inclinação para células mais efetoras do que alvos baseados na literatura atual (12, 16, 17). Efetoras para a célula-alvo, as proporções podem variar de papel em papel, mas estudos anteriores que já tituladas efetoras para o destino rácios têm mostrado que o ideal degranulação de mouse as células NK chegou ao 4.5:1 relação com YAC-1 em células-alvo (18) humano e as células NK matou células K562 melhor, na proporção de 5:1 ou 10:1 (12). No entanto, ao usar uma gama maior de efetores para as razões alvo, nós mostramos que a degranulação usando células LAK de rato foi mais efetivamente induzida ao usar quatro ou mais alvos por célula efetora. Esta diferença no efeito óptimo: a razão-alvo entre o rato e outras espécies pode dever-se ao tipo de células-alvo utilizadas, como as titulações do efeito humano e do rato em relação ao rácio-alvo nos estudos acima referidos, utilizando células-alvo provenientes da mesma espécie. As células efectoras podem ser mais sensíveis às células alvo da mesma espécie e, portanto, precisam de menos células alvo para serem ativadas. A linha celular YAC-1 utilizada no nosso estudo é um linfoma das células T do ratinho, que tem sido o padrão durante muitos anos para estimular a citotoxicidade das células NK do rato. Não podemos excluir que a utilização de uma célula-alvo no rato resulte numa estimulação mais forte das células NK e, subsequentemente, poderão ser necessárias menos células-alvo para induzir a degranulação.também se depreende claramente deste estudo que as razões efector / alvo utilizadas nos ensaios de citotoxicidade não estão bem correlacionadas com as razões necessárias para medir a resposta de degranulação óptima nas células efectoras. Isto não é surpreendente, pois a leitura para estes dois ensaios é diferente, com a citotoxicidade medindo a morte da célula alvo, e a degranulação medindo a resposta NK aos alvos.em conclusão, criámos um anticorpo contra CD107a (SIM1) no rato e caracterizámos a sua capacidade para detectar a degranulação em linfócitos citotóxicos no rato. Nós temos mostrado que SIM1 é específico para as células degranuladoras, e através da otimização do protocolo de degranulação, nós determinamos que usando effector:razões de células alvo inferiores a 1:4 garantir a estimulação ótima das células LAK. O desenvolvimento de CD107a (SIM1) anti-rato permite uma melhor análise e caracterização das respostas citotóxicas dos linfócitos do rato e será uma ferramenta valiosa nos muitos modelos de doença do rato.o estudo é aprovado pela Autoridade Nacional de investigação Animal (FDU), Noruega (número de autorização: ID-1698).
contribuições do autor
como tem sido responsável pela análise da expressão, ensaios funcionais, e escrita do manuscrito. K-ZD realizou a clonagem cDNA e geração de transfetantes. A JTV esteve envolvida no planeamento e supervisão do projecto e na escrita do manuscrito. A LK tem sido responsável pelas imunizações, a tecnologia hybridoma, a escrita do manuscrito e a supervisão do projeto.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.os autores agradecem Ulla Heggelund e Stine Martinsen pela assistência técnica no laboratório, e o pessoal da instalação animal do Departamento de Medicina comparativa em Rikshospitalet, Hospital da Universidade de Oslo pela ajuda com imunizações. Obrigado a Marit Inngjerdingen para discussões científicas.
financiamento
a investigação foi financiada pela Universidade de Oslo, Sudeste da Noruega Saúde Regional (2009104), e Legatet til Henrik Homans Minde.
1. Sumo de laranja. Formação e função da sinapse imunológica das células NK líticas. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed Resumo | CrossRef Texto Completo | Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli l, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot e, Walch M, Martinvalet D, et al. A perforina poros na membrana endossómica desencadeia a libertação da granzima B endocitosada para o citosol das células alvo. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Resumo | CrossRef Texto Completo | Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforina e granzimas: função, disfunção e patologia humana. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens a, Benestad HB, Vaage JT, et al. Um segundo transplante profiláctico de medula óssea não compatível protege contra a leucemia mielóide aguda (BNML) em ratos sem doença letal enxerto versus hospedeiro. Transplantação (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
PubMed Resumo | CrossRef Texto Completo | Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya a, Phillips J, Lanier LL, et al. Aplicações de clonagem de expressão mediada por retrovírus. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Redução da degranulação das células NK em doentes com herpes recorrente frequente. Clin Vaccine Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Resumo | CrossRef Texto Completo | Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Análise funcional das células NK humanas por citometria de fluxo. Methods Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
