

dióxido de carbono (CO2) é um composto químico. É um gás à temperatura ambiente. É feito de um carbono e dois átomos de oxigênio. As pessoas e os animais libertam dióxido de carbono quando expiram. Além disso, cada vez que algo orgânico é queimado (ou um fogo é feito), ele faz dióxido de carbono. As plantas usam dióxido de carbono para fazer alimentos. Este processo é chamado de fotossíntese. As propriedades do dióxido de carbono foram estudadas pelo cientista escocês Joseph Black na década de 1750. Os gases com efeito de estufa captam energia térmica. Os gases com efeito de estufa alteram o clima e o clima no nosso planeta, a Terra. Isto é chamado de mudança climática. Os gases com efeito de estufa são uma causa do aquecimento global, o aumento da temperatura da superfície da Terra.o dióxido de carbono é um produto final em organismos que obtêm energia a partir da decomposição de açúcares, gorduras e aminoácidos com oxigénio como parte do seu metabolismo. Este é um processo conhecido como respiração celular. Isto inclui todas as plantas, animais, muitos fungos e algumas bactérias. Em animais superiores, o dióxido de carbono viaja no sangue dos tecidos do corpo para os pulmões onde é respirado. As plantas absorvem dióxido de carbono da atmosfera para utilização na fotossíntese.gelo seco, ou dióxido de carbono sólido, é o estado sólido do gás CO2 abaixo de -109,3 ° F (-78,5°c). O gelo seco não ocorre naturalmente na terra, mas é feito pelo homem. É incolor. As pessoas usam gelo seco para arrefecer as coisas, e para fazer bebidas gasosas, matar roedores e congelar verrugas. O vapor de gelo seco causa asfixia e, eventualmente, morte. Recomenda-se precaução e assistência profissional sempre que estiver em uso gelo seco.

A habitual pressão não vai derreter de sólido para líquido, mas, em vez disso, as alterações diretamente do estado sólido para gás. Isto é chamado de sublimação. Ele vai mudar diretamente de um sólido para um gás a qualquer temperatura mais alta do que temperaturas extremamente frias. O gelo seco sublima-se à temperatura normal do ar. Gelo seco exposto ao ar normal emite gás dióxido de carbono que não tem cor. O dióxido de carbono pode ser liquidado a uma pressão superior a 5,1 atmosferas.o gás de dióxido de carbono que sai do gelo seco é tão frio que, quando se mistura com ar, arrefece o vapor de água no ar até ao nevoeiro, o que parece uma fumaça branca espessa. É muitas vezes usado no teatro para criar a aparência de nevoeiro ou fumaça.os químicos podem obter dióxido de carbono a partir do ar de arrefecimento. Chamam a isto destilação de ar. Este método é ineficiente porque uma grande quantidade de ar deve ser refrigerada para extrair uma pequena quantidade de CO2. Os químicos também podem usar várias reações químicas diferentes para separar o dióxido de carbono. O dióxido de carbono é produzido nas reações entre a maioria dos ácidos e a maioria dos carbonatos metálicos. Por exemplo, a reação entre ácido clorídrico e carbonato de cálcio (calcário ou giz) faz dióxido de carbono:
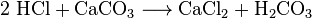
o ácido carbônico (H2CO3) então decompõe-se em água e CO2. Estas reacções causam espuma ou borbulhar, ou ambas. Na indústria, tais reações são usadas muitas vezes para neutralizar fluxos de ácidos residuais.
cal viva (CaO), um produto químico que tem uso generalizado, pode ser feito aquecendo calcário a cerca de 850 °C. Esta reação também faz emissão CO2:
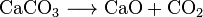
o dióxido de Carbono também é feita na combustão de carbono de combustíveis que contêm enxofre, como o metano (gás natural), destilados de petróleo (gasolina, diesel, querosene, propano), carvão ou madeira. Na maioria dos casos, a água também é liberada. Como exemplo, a reação química entre metano e oxigênio é:
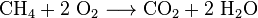
dióxido de carbono é feito em usinas de aço. O ferro é reduzido a partir de seus óxidos com o coque no alto-forno, produção de ferro-gusa e de dióxido de carbono:

o Fermento metaboliza o açúcar para produzir dióxido de carbono e o etanol, também conhecido como álcool, na produção de vinhos, cervejas e outras bebidas espirituosas, mas também na produção de bioetanol:
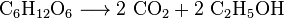
Todos os organismos aeróbicos produzir CO2 quando eles se oxida carboidratos, ácidos graxos e proteínas nas mitocôndrias das células. O grande número de reações envolvidas são extremamente complexas e não são facilmente descritas. (Eles incluem respiração celular, respiração anaeróbica e fotossíntese). Photoautotrophs (i.e. plantas, cianobactérias) utilizar outra reação: as Plantas absorvem o CO2 do ar, e que, juntamente com água, reagem para formar hidratos de carbono:
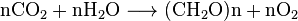
o dióxido de Carbono é solúvel em água, em que ele espontaneamente interconverts entre o CO2 e o H2CO3 (ácido carbônico). As concentrações relativas de CO2, H2CO3, e as formas desprotonadas HCO−
3 (bicarbonato) e CO2−
3(carbonato) dependem da acidez (pH). Em neutro ou ligeiramente alcalino da água (pH > 6.5), o bicarbonato de forma predominante (>50%) tornando-se o mais prevalente (>95%) em que o pH da água do mar, enquanto que em muito alcalino da água (pH > 10.4) a predominante (>50%) formulário de carbonato. As formas bicarbonato e carbonato são muito solúveis. Assim, a água do oceano equilibrada pelo ar (ligeiramente alcalina com pH típico = 8, 2–8, 5) contém cerca de 120 mg de bicarbonato por litro.o dióxido de carbono Industrial é produzido principalmente a partir de seis processos: captura de molas naturais de dióxido de carbono, ONDE é produzido pela acção de água acidificada em calcário ou dolomite.como subproduto de instalações de produção de hidrogénio, em que o metano é convertido em CO2; a partir da combustão de combustíveis fósseis ou de madeira;como subproduto da fermentação do açúcar na cerveja, uísque e outras bebidas alcoólicas; a partir da decomposição térmica de calcário, CaCO3, no fabrico de cal (óxido de cálcio, CaO);:
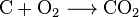 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of “dry ice”, a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

Pterapod shell dissolvido na água do mar ajustado para um oceano de química projetada para o ano de 2100.
-

Visão geral da fotossíntese e respiração. O dióxido de carbono (à direita), juntamente com a água, formam oxigênio e compostos orgânicos (à esquerda) por fotossíntese, que pode ser respirado para a água e (CO2).
-

O aumento dos níveis de CO2 ameaçado Apollo 13 astronautas que tiveram que se adaptar cartuchos a partir do módulo de comando para o fornecimento de dióxido de carbono purificador do módulo lunar, que eles usaram como um bote salva-vidas.
-

CO2 concentration meter using a nondispersive infrared sensor
