electronegatividade e Polaridade de ligação
embora tenhamos definido ligação covalente como partilha de electrões, os electrões numa ligação covalente nem sempre são partilhados igualmente pelos dois átomos ligados. A menos que a ligação conecte dois átomos do mesmo elemento, haverá sempre um átomo que atrai os elétrons na ligação mais fortemente do que o outro átomo, como mostrado na figura 4.3 “ligações covalentes polares versus ligações não-polares”. Quando tal desequilíbrio ocorre, há um acúmulo resultante de alguma carga negativa (chamada de carga negativa parcial e designada δ−) de um lado da ligação e alguma carga positiva (designada δ+) Do outro lado da ligação. Uma ligação covalente que tem uma partilha desigual de elétrons, como na Parte (b) da figura 4.3 “ligações covalentes polares versus ligações não-polares”, é chamada de ligação covalente covalente polar com uma distribuição de elétrons desequilibrada através da ligação.. Uma ligação covalente que tem uma partilha igual de elétrons (parte a) da Figura 4.3 “ligações covalentes polares versus ligações covalentes não-polares”) é chamada de ligação covalente não-polares com uma distribuição equilibrada de elétrons através da ligação..
figura 4.3 ligações covalentes polares versus ligações covalentes não-polares
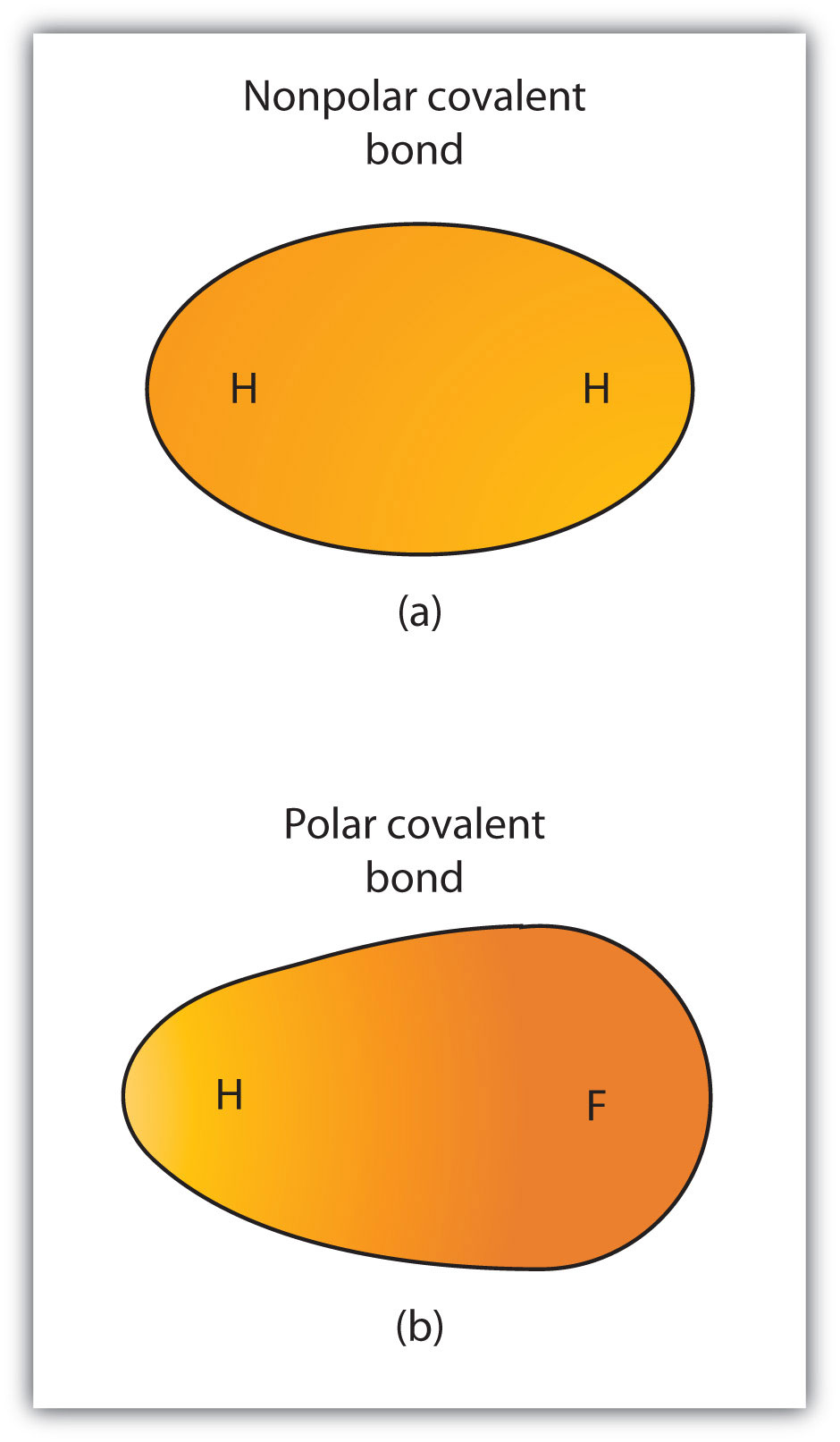
(a) os electrões na ligação covalente são igualmente partilhados por ambos os átomos de hidrogénio. Esta é uma ligação covalente não-polar. b) O átomo de flúor atrai os electrões na ligação mais do que o átomo de hidrogénio, conduzindo a um desequilíbrio na distribuição dos electrões. Esta é uma ligação covalente polar.
qualquer ligação covalente entre átomos de diferentes elementos é uma ligação polar, mas o grau de polaridade varia muito. Algumas ligações entre diferentes elementos são apenas minimamente polares, enquanto outras são fortemente polares. Ligações iônicas podem ser consideradas a última em polaridade, com elétrons sendo transferidos ao invés de compartilhados. Para julgar a polaridade relativa de uma ligação covalente, os químicos usam a medida relativa eletronegativitya de quão fortemente um átomo atrai elétrons quando forma uma ligação covalente., que é uma medida relativa de como um átomo atrai elétrons quando forma uma ligação covalente. Existem várias escalas numéricas para a classificação da eletronegatividade. A figura 4.4 “eletronegatividades de vários elementos” mostra uma das mais populares—a escala de Pauling. A polaridade de uma ligação covalente pode ser julgada determinando a diferença nas eletronegatividades dos dois átomos que fazem a ligação. Quanto maior a diferença nas eletronegatividades, maior o desequilíbrio da partilha de elétrons na ligação. Embora não existam regras duras e rápidas, a regra geral é se a diferença em eletronegatividades é inferior a 0,4, a ligação é considerada não-polar; se a diferença é maior que 0,4, a ligação é considerada polar. Se a diferença em eletronegatividades é grande o suficiente (geralmente maior que cerca de 1,8), o composto resultante é considerado iônico ao invés de covalente. Uma diferença de eletronegatividade de zero, é claro, indica uma ligação covalente não-polar.
Figura 4.4 eletronegatividades de vários elementos
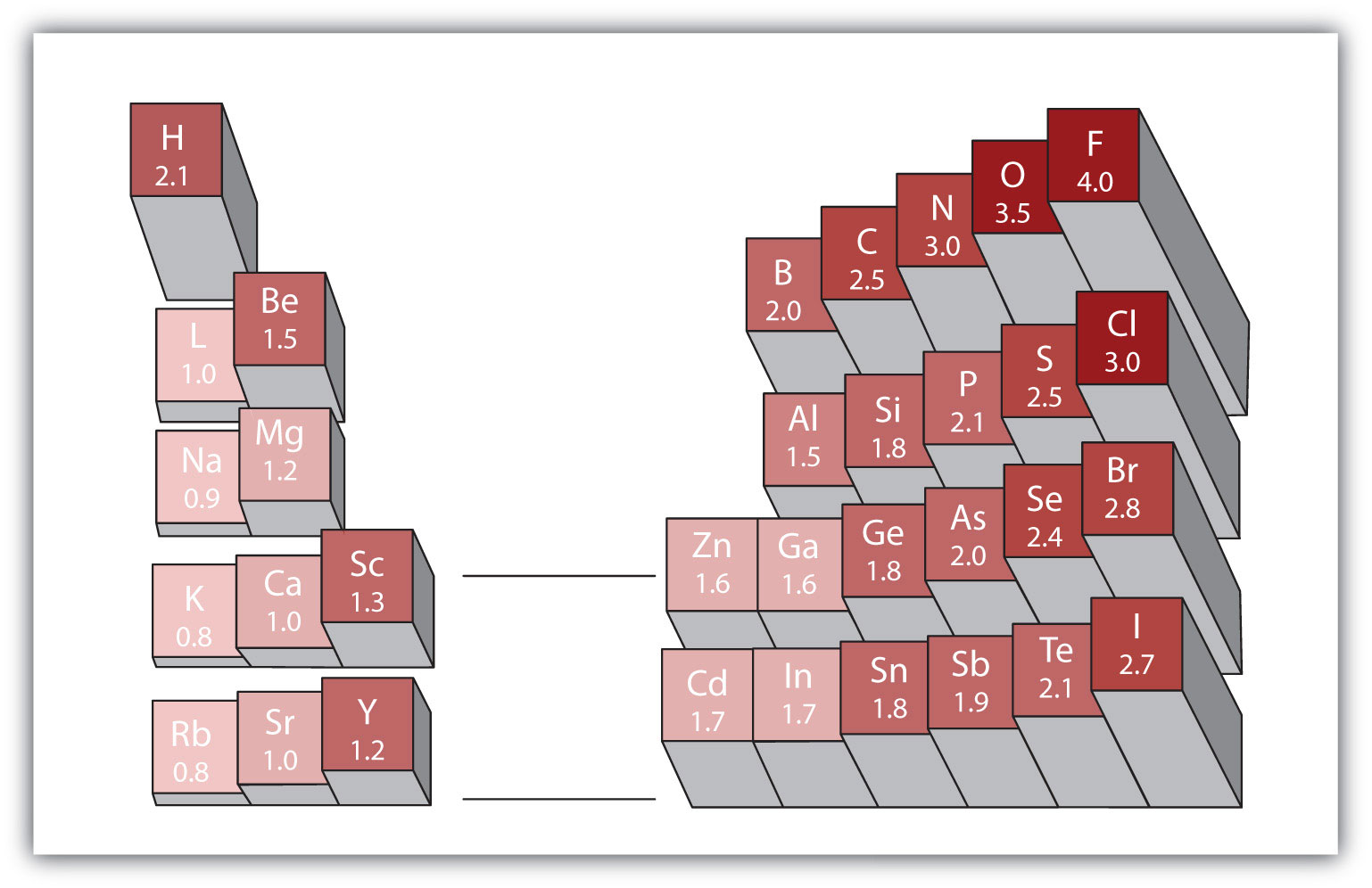
uma escala popular para eletronegatividades tem o valor para átomos de flúor fixado em 4.0, o valor mais alto.
olhando mais de perto: Linus Pauling
indiscutivelmente o químico mais influente do século XX, Linus Pauling (1901-94) é a única pessoa a ter ganho dois Prêmios Nobel individuais (ou seja, sem se preocupar). Na década de 1930, Pauling usou novas teorias matemáticas para enunciar alguns princípios fundamentais da ligação química. Seu livro de 1939 The Nature of the Chemical Bond é um dos livros mais significativos já publicados em Química.em 1935, Pauling interessou-se por moléculas biológicas, e recebeu o Prêmio Nobel de Química de 1954 por seu trabalho na estrutura proteica. (He was very close to discovering the double helix structure of DNA when James Watson and James Crick announced their own discovery of its structure in 1953. Mais tarde foi agraciado com o Prêmio Nobel da Paz de 1962 por seus esforços para banir os testes de armas nucleares.em seus últimos anos, Pauling ficou convencido de que grandes doses de vitamina C evitariam a doença, incluindo o resfriado comum. A maioria da pesquisa clínica não mostrou uma conexão, mas Pauling continuou a tomar grandes doses diárias. Morreu em 1994, tendo passado uma vida inteira estabelecendo um legado científico que poucos jamais igualarão.

Linus Pauling foi um dos químicos mais influentes do século XX.
exemplo 6
descreve a diferença de eletronegatividade entre cada par de átomos e a polaridade resultante (ou tipo de ligação).o carbono tem uma eletronegatividade de 2,5, enquanto o valor para o hidrogénio é de 2,1. A diferença é de 0,3, o que é bastante pequeno. A ligação C–H é, portanto, considerada não-polar.ambos os átomos de hidrogénio têm o mesmo valor de eletronegatividade—2.1. A diferença é zero, então a ligação é não-polar.
exercício de Capacitação
-
C e S
-
K e Br
-
N e N
-
Cs e F
descreve a diferença de eletronegatividade entre cada par de átomos e a polaridade resultante (ou tipo de ligação).
Quando uma molécula de títulos são polares, a molécula como um todo, pode apresentar uma distribuição desigual da carga, dependendo de como o indivíduo títulos são orientados. Por exemplo, a orientação de dois O–H de títulos em uma molécula de água (Figura 4.5 “Propriedades Físicas e Polaridade”) é dobrada: uma extremidade da molécula tem uma carga positiva parcial, e a outra extremidade tem uma carga parcial negativa. Em resumo, a molécula em si é polar. A polaridade da água tem um enorme impacto nas suas propriedades físicas e químicas. (Por exemplo, o ponto de ebulição da água é alto para uma molécula tão pequena e é devido ao fato de que as moléculas polares se atraem fortemente.) Em contraste, enquanto as duas ligações C=o em dióxido de carbono são polares, elas estão diretamente opostas uma à outra e assim cancelam os efeitos uns dos outros. Assim, as moléculas de dióxido de carbono são não-polares. Esta falta de polaridade influencia algumas das propriedades do dióxido de carbono. (Por exemplo, o dióxido de carbono torna-se um gás a -77°c, quase 200° menor do que a temperatura a que a água ferve.)
Figura 4.5 Propriedades Físicas e Polaridade

As propriedades físicas da água e do dióxido de carbono são afetados por suas polaridades.
exercícios de revisão de conceitos
-
Qual é o nome para a distância entre dois átomos numa ligação covalente?o que indica a eletronegatividade de um átomo?
-
Que tipo de ligação é formada entre dois átomos se a diferença nas eletronegatividades é pequena? Médio? Grande?
Respostas
-
o comprimento de ligação
-
Electronegativity qualitativa medida de quanto um átomo atrai os elétrons em uma ligação covalente bond.
nonpolar; polar; iónica
ligações chave
- ligações covalentes entre átomos diferentes têm diferentes comprimentos de ligação.as ligações covalentes podem ser polares ou não-polares, dependendo da diferença de eletronegatividade entre os átomos envolvidos.os exercícios são mais longos-uma ligação C-H ou uma ligação C-O? (Ver Quadro 4.2″comprimentos aproximados das obrigações de algumas obrigações únicas”.)
que é mais curto—uma ligação N–H ou uma ligação C–H? (Ver Quadro 4.2″comprimentos aproximados das obrigações de algumas obrigações únicas”.)
um nanómetro é de 10-9 m. utilizando os dados do quadro 4.2 “comprimentos aproximados das ligações de algumas ligações únicas” e do quadro 4. 3 “Comparison of Bond Lengths for Single and Multiple Bonds”, determine the length of each bond in nanometers.
- um C–O bond
- C=O vínculo
- H–N bond
- C≡N bond
Um angstrom (Å) é definida como a 10-10 m. Usando a Tabela 4.2 “Aproximado do comprimento da ligação de Algumas Obrigações” e a Tabela 4.3 “Comparação de Comprimentos de ligação para o Único e Vários Títulos”, determinar o comprimento de cada obrigação em angstroms.uma ligação C–C-A–C-A-C-A-C-A-C-A-C-A-C-A-C-A-C-A-C-A-C-A-C-A-C Porque é que a unidade nanométrica é útil como unidade para expressar comprimentos de ligação?
referem-se ao exercício 4. Porque é que a unidade angstrom é útil como unidade para expressar comprimentos de ligação?
Usando a figura 4.4 “eletronegatividades de vários elementos”, determinar qual átomo em cada par tem a eletronegatividade mais elevada.
- H ou C
- O ou Br
- Na ou Rb
- I ou Cl
Usando a Figura 4.4 “Electronegativities de Vários Elementos”, determinar qual o átomo em cada par tem o menor electronegativity.os electrões serão partilhados de forma igual ou desigual por cada ligação covalente? Se de forma desigual, para que átomo estão os electrões mais fortemente atraídos?
- um C–O bond
- um F–F bond
- S–N bond
- I–Cl bond
Será que os elétrons ser compartilhada igualmente ou de forma desigual em cada ligação covalente ligação? Se de forma desigual, para que átomo estão os electrões mais fortemente atraídos?
- C–C bond
- S–Cl bond
- O–H bond
- H–H bond
Respostas
-
Um C–O título é mais.
-
- 0.143 nm
- 0.120 nm
- 0.100 nm
- 0.116 nm
-
comprimentos reais das ligações são muito pequenos, pelo que a unidade nanométrica torna a expressão do comprimento mais fácil de compreender.
-
- C
- O
- Na
- Cl
-
- de forma desigual, em direção a O
- igualmente
- de forma desigual para N
- desigualmente para o Cl
