complexos de transferência de carga exibem transições de transferência de carga em que a absorção desencadeia a transferência de um elétron do doador para o aceitador.quando o iodo é dissolvido em soluções de solventes dadores, a cor púrpura do iodo molecular é substituída por uma cor amarelo-marrom. Isto porque complexos de transferência de carga como os formados por \(I_2\) podem absorver luz de formas que nem o doador nem o aceitador podem por si só. Especificamente, os complexos de transferência de carga exibem Bandas de transferência de carga (bandas CT) nos seus espectros de absorção. Na transição de transferência de carga, a transferência parcial inicial de carga da base de Lewis doador para o ácido de Lewis aceitador no complexo de transferência de carga é empurrada ainda mais pela fotoexcitação.
\
a natureza destas transições de transferência de carga é vista a partir da descrição orbital de ligação para complexos de transferência de carga de iodo. Quando um doador-I2 formas complexas a formação de doador-I2 colagem e antibonding orbitais resultar em uma mudança na\(I2 \sigma \rightarrow \sigma*\) transição para o de maior energia de um a formação de uma nova banda de transferência de carga associada a excitação de um elétron de grande parte da amina-centrado amina-I2 \(\sigma \) orbital para a grande I2-centrado amina-I2 \(\sigma *\) orbital.
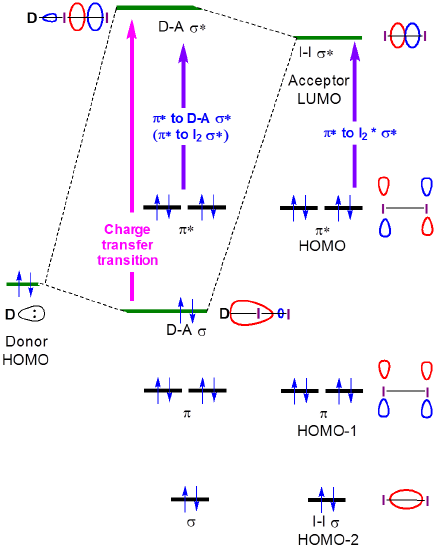
figura 6.4.2.\ (\PageIndex{2}\). Interações orbitais de fronteira que dão origem a mudanças nos espectros de absorção do iodo quando ele forma um complexo de transferência de carga com um doador base de Lewis.
soluções de I2 como misturas com bases de Lewis, tais como aminas e em solventes doadores claramente cargas Bandas de transferência. Vários destes espectros são apresentados na figura 6.4.2.3.
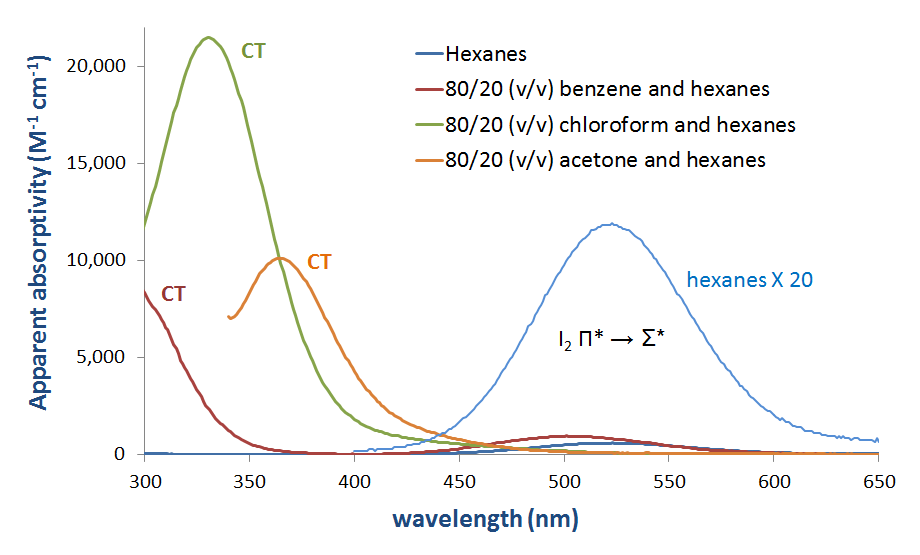
figura 6.4.2.\ (\PageIndex{3}\). Espectro de absorção do iodo molecular (I2) em vários solventes mostrando a aparência de uma banda CT em solventes dadores.*
em princípio, as energias tanto da transferência de carga e \(I_2~\pi *~\rightarrow ~D-A~ \sigma *\) transições ambos aumentam com a força do doador, como mostrado na figura 6.4.2.4.
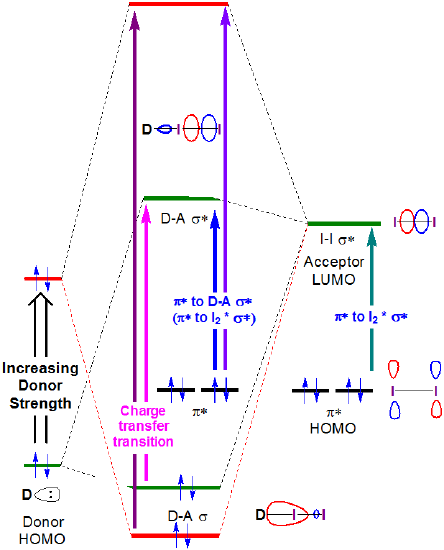
figura 6.4.2.\ (\PageIndex{4}\). Mudança esperada nas energias orbitais de fronteira associadas com a formação complexa do doador I2 quando a energia HOMO do doador é aumentada. como se pode ver na figura 6.4.2. a energia da banda de transferência de carga pode ser esperada para aumentar à medida que o HOMO doador aumenta em energia para se tornar mais próximo em energia para o Lumo aceitador. Embora se deva ter cuidado ao interpretar os espectros da fase de solução de I2, esta expectativa é confirmada por uma análise superficial e qualitativa dos espectros na figura 6.4.2.3. A energia de transição CT muda para comprimentos de onda inferiores (e, portanto, maior energia) como a energia orbital atômica mais ocupada para o átomo doador aumenta passando de acetona (oxigênio, -15.85 eV) para clorofórmio (cloro, -13.67 eV) e finalmente benzeno (Carbono, -10.66 eV).**
de Transferência de Carga Bandas de Metal de Transição Química
transições de Transferência de Carga são responsáveis pela cor intensa de muitos complexos de metais de transição. Nestes casos, no entanto, a fraca interacção ácido-Lewis envolve doação e aceitação de electrões incompletos numa ligação entre um metal e um ligante(ou \(P \pi-d \pi*\). As bandas de transferência de carga nos espectros de absorção destes complexos envolvem a transferência de elétrons entre o metal e ligando. Em particular,
- Metal de transferência de carga ligante (MLCT ou CTTL) bandas envolvem a transferência de um elétron de uma cheia ou parcialmente de metal cheia d orbital para um ligante \(\pi*\)-tipo de orbital.

- Ligante para o metal de transferência de carga (LMCT ou CTTL) bandas envolvem a transferência de um elétron de uma cheia ou parcialmente preenchidos ligante orbtial um metal d-orbital.
- metal to metal charge transfer bands can be observed in some bimetallic complexes. No entanto, estes são geralmente considerados apenas como uma transferência de elétrons do que como uma mudança no status de uma interação ácido-base de Lewis.
Porque o metal-ligante de transferência de carga bandas envolvem intermoleculares transferência de electrões entre o metal e o ligante para gerar uma alta energia redox estado do CT estado excitado é melhor oxidante e reductant do que o estado fundamental. Consequentemente, tem havido intensa investigação no desenvolvimento de complexos metálicos cujos estados excitados de transferência de carga são oxidantes poderosos e redutores na expectativa de que eles serão capazes de conduzir a oxidação fotocatalítica e redução de substratos.
* a absorvividade aparente de I2 em hexanos foi calculada a partir do espectro de absorção de 215 µM I2 em hexanos. Todas as outras absorvências aparentes foram calculadas a partir de espectros de absorção de soluções que foram de 44 µM em I2.
* * as posições da banda não são as energias da Banda CT e as energias HOMO dadas são níveis de Energia Atômica e não correspondem necessariamente ao HOMO do doador em solução. Devido a esta e outras simplificações, esta análise não se destina a substituir uma análise computacional rigorosa dos fatores que dão origem a posições de Banda CT.1. Meyerstein, D.; Treinina, A., complexos de transferência de carga de iodo e aniões inorgânicos em solução. Transactions of the Faraday Society 1963, 59 (0), 1114-1120. 2. Baskar, A. J. A.; Rajpurohit, A. S.; Panneerselvam, M.; Jacobb, M.; RoopSingh, D.; Kannappan, V., Experimental and theoretical analysis of substituent effect on charge transfer complexes of iodo and some alkylbenzenes in n-hexane solution at 303K. Chemical Data Collections 2017, 7-8, 80-92.
