objectivos de aprendizagem
- escrever a fórmula química para um composto iónico simples.
- reconhecer iões poliatómicos em fórmulas químicas.
já encontrámos algumas fórmulas químicas para compostos iónicos simples. Uma fórmula química é uma lista concisa dos elementos em um composto e as razões desses elementos. Para entender melhor o que significa uma fórmula química, devemos considerar como um composto iônico é construído a partir de seus íons.
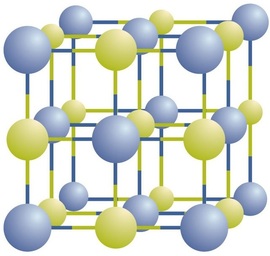
compostos iónicos existem como iões positivos e negativos alternados em matrizes tridimensionais regulares chamadas cristais (figura \(\PageIndex{1}\)). Como você pode ver, não existem “partículas” individuais \(\ce{NaCl}\) no array; em vez disso, há uma rede contínua de íons de sódio e cloreto alternados. No entanto, podemos usar a razão de íons de sódio para íons cloreto, expressa nos números inteiros mais baixos possíveis, como uma forma de descrever o composto. No caso do cloreto de sódio, a razão entre iões de sódio e iões cloreto, expressa em números inteiros mais baixos, é 1:1, então usamos \(\ce{NaCl}\) (um símbolo \(\ce{na}\) e um símbolo \(\ce{Cl}\) para representar o composto. Assim, \(\ce{NaCl}\) é a fórmula química para cloreto de sódio, que é uma forma concisa de descrever o número relativo de diferentes íons no composto. Uma amostra macroscópica é composta de miríades de pares NaCl; cada par individual chamado de unidade de Fórmula. Embora seja conveniente pensar que os cristais \(\ce{NaCl}\) são compostos de unidades \(\ce{NaCl}\) individuais, a figura \(\PageIndex{1}\) mostra que nenhum íon é exclusivamente associado a qualquer outro íon. Cada íon é cercado por íons de carga oposta.
a fórmula para um composto iônico segue várias convenções. Em primeiro lugar, o cátion é escrito antes do anião. Como a maioria dos metais formam catiões e a maioria dos não-metais formam aniões, as fórmulas tipicamente listam o metal primeiro e depois o não-metal. Em segundo lugar, as acusações não estão escritas numa fórmula. Lembre-se que em um composto iônico, as espécies componentes são íons, não átomos neutros, mesmo que a fórmula não contenha cargas. Finalmente, a fórmula adequada para um composto iônico sempre tem uma carga zero líquida, o que significa que a carga positiva total deve igualar a carga negativa total. Para determinar a fórmula adequada de qualquer combinação de íons, determine quantos de cada íon são necessários para equilibrar as cargas positivas e negativas totais no composto.
Esta regra baseia-se, em última análise, no facto de a matéria ser, em geral, neutra do ponto de vista eléctrico.
Por convenção, assumir que existe apenas um átomo se um subscrito não estiver presente. Nós não usamos 1 como um subscrito.
Se olharmos para o composto iónico constituído por iões de lítio e iões brometo, vemos que o ião lítio tem uma carga 1+ e o ião brometo tem uma carga 1. Só é necessário um ião de cada um para equilibrar estas cargas. A fórmula para brometo de lítio é \(\ce{LiBr}\).quando um composto iônico é formado a partir de magnésio e oxigênio, o íon magnésio tem uma carga de 2+, e o átomo de oxigênio tem uma carga de 2. Embora ambos os íons tenham cargas mais elevadas do que os íons em brometo de lítio, eles ainda se equilibram em uma proporção de um para um. Portanto, a fórmula adequada para este composto iônico é \(\ce{MgO}\).
considere agora o composto iônico formado por magnésio e cloro. Um íon de magnésio tem uma carga 2+, enquanto um íon de cloro tem uma carga 1:
\
combinando um íon de cada um não equilibra completamente as cargas positivas e negativas. A maneira mais fácil de equilibrar essas cargas é assumir a presença de dois íons cloreto para cada íon de magnésio:
\
Agora as cargas positivas e negativas estão equilibradas. Poderíamos escrever a fórmula química para este composto iônico como \(\ce{MgCl}\), mas a convenção é usar um índice numérico quando há mais de um íon de um dado tipo—\(\ce{MgCl2}\). Esta fórmula química diz que há um íon de magnésio e dois íons cloreto nesta fórmula. (Não leia a parte” Cl2 ” da fórmula como uma molécula do cloro elementar diatômico. O cloro não existe como um elemento diatômico neste composto. Pelo contrário, existe como dois íons cloreto individuais. Por convenção, a menor razão de número inteiro é usada nas fórmulas de compostos iônicos. A fórmula \(\ce{Mg2Cl4}\) tem cargas equilibradas com os íons numa proporção de 1:2, mas não é a menor proporção de números inteiros.
para compostos em que a razão de íons não é tão óbvia, os subscritos na Fórmula podem ser obtidos por cargas transversais: usar o valor absoluto da carga em um íon como o subscrito para o outro íon. Este método é apresentado esquematicamente na figura 3.3.2.
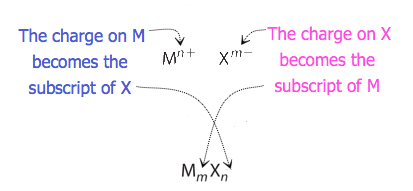
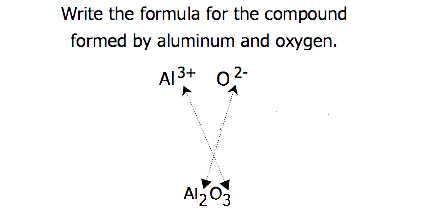
ao cruzar cargas, às vezes é necessário reduzir os subscritos para sua razão mais simples para escrever a fórmula empírica. Considere, por exemplo, o composto formado por Pb4+ e O2−. Usando os valores absolutos das cargas sobre os íons como subscritos dá a fórmula Pb2O4. Isto simplifica a sua fórmula empírica correta PbO2. A fórmula empírica tem um íon Pb4+ e dois íons O2.
exemplo \(\PageIndex{1}\)
escreva a fórmula química para um composto iónico composto por cada par de iões.
- os iões de sódio e o enxofre íon
- o alumínio íon e o íon fluoreto
- 3+ íon do ferro e o oxigênio do íon
Solução
- Para obter uma valence shell octeto, o sódio forma um íon com uma 1+ custo, enquanto que o enxofre íon tem uma 2− carga. Dois iões sódicos 1+ são necessários para equilibrar a carga 2 sobre o íon enxofre. Em vez de escrever a fórmula como \(\ce{NaNaS}\), encurtamo-la por convenção para \(\ce{Na2S}\).
- o ião alumínio tem uma carga de 3+, enquanto o ião fluoreto formado pelo flúor tem uma carga de 1. Três iões de flúor são necessários para equilibrar a carga 3+ no íon de alumínio. Esta combinação é escrita como \(\ce{AlF3}\).
- ferro pode formar dois íons possíveis, mas o íon com uma carga de 3+ é especificado aqui. O átomo de oxigênio tem uma carga de 2 como um íon. Para equilibrar as cargas positivas e negativas, nós olhamos para o múltiplo menos comum-6: dois íons de ferro 3+ dará 6+, enquanto três íons de oxigênio 2 dará 6−, equilibrando assim as cargas positivas e negativas globais. Assim, a fórmula para este composto iônico é \(\ce{Fe2O3}\). Em alternativa, utilizar o método das taxas de atravessamento indicado na figura 3.3.2.
exercício \(\PageIndex{1}\)
escreva a fórmula química para um composto iónico composto por cada par de iões.
- os iões de cálcio e o oxigênio do íon
- a 2+ de iões de cobre e o enxofre íon
- 1+ de iões de cobre e o enxofre íon
Resposta:
CaO
a Resposta b:
CuS
a Resposta c: alguns íons consistem de grupos de átomos ligados covalentemente e têm uma carga elétrica global. Como estes íons contêm mais de um átomo, eles são chamados íons poliatômicos. As estruturas de Lewis, nomes e fórmulas de alguns íons poliatômicos são encontrados na tabela 3.3.1.
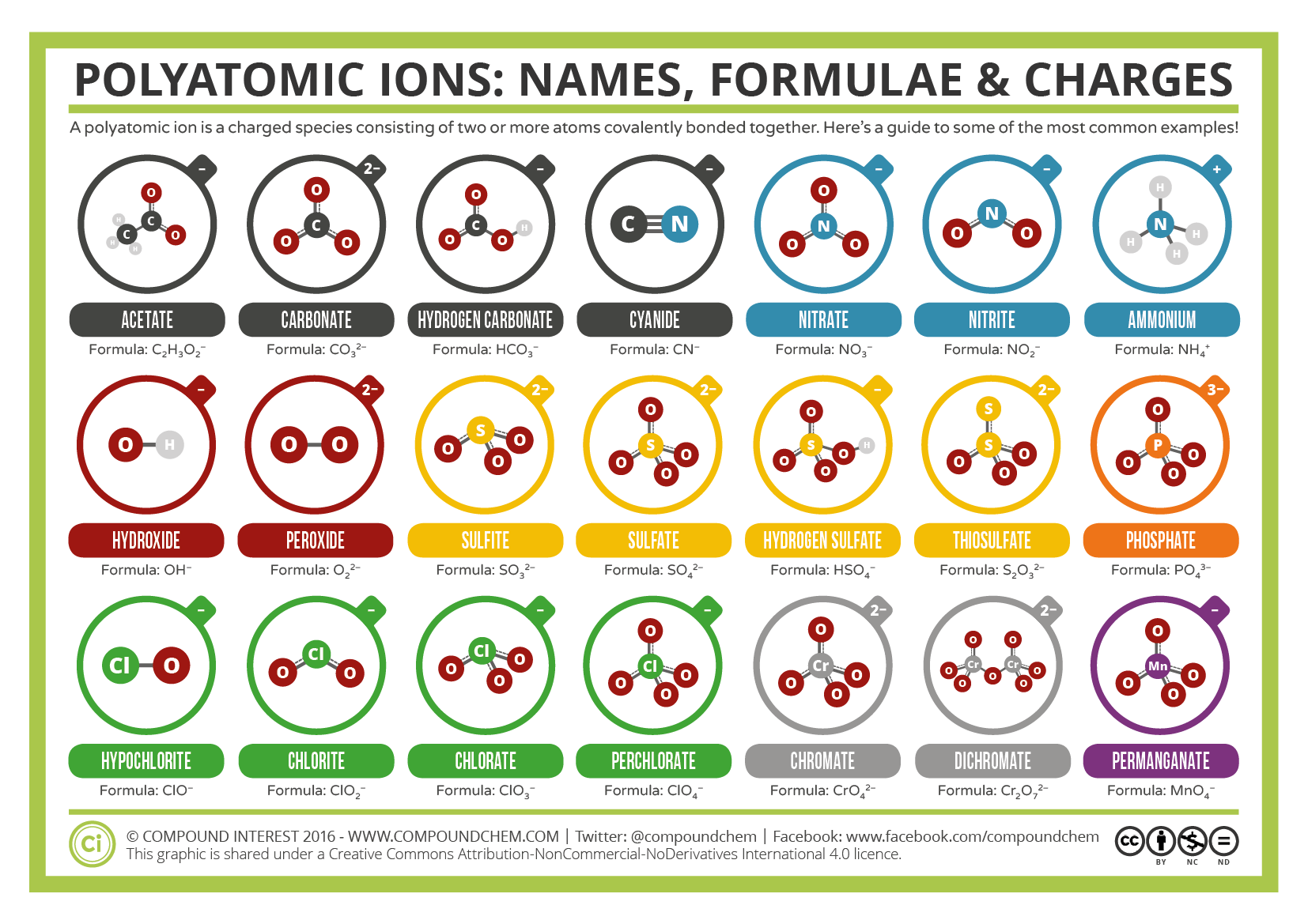
tabela \(\PageIndex{1}\): Alguns iões poliatómicos
poliatómicos têm fórmulas definidas, nomes e cargas que não podem ser modificados de qualquer forma. A tabela \(\PageIndex{2}\) lista os nomes iónicos e as fórmulas iónicas dos iões poliatómicos mais comuns. Por exemplo, \(\ce{NO3^{−}}\) é o íon nitrato; tem um átomo de azoto e três átomos de oxigénio e uma carga global de 1. A figura \(\PageIndex{2}\) lista os iões poliatómicos mais comuns.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Os íons poliatômicos restantes são todos negativamente carregados e, portanto, são classificados como aniões. No entanto, apenas dois destes, o íon hidróxido e o íon cianeto, são nomeados usando o sufixo “-ide” que é tipicamente indicativo de partículas carregadas negativamente. Os aniões poliatômicos restantes, que todos contêm oxigênio, em combinação com outro não-metal, existem como parte de uma série em que o número de oxígenos dentro da unidade poliatômica pode variar. Como tem sido repetidamente enfatizado em várias seções deste texto, não duas fórmulas químicas devem compartilhar um nome químico comum. Um único sufixo,” – ide”, é insuficiente para distinguir os nomes dos aniões em uma série poliatômica relacionada. Portanto, sufixos”- ate “e” – ite ” são empregados, a fim de denotar que os íons poliatômicos correspondentes são parte de uma série. Adicionalmente, estes sufixos também indicam o número relativo de oxigenos que estão contidos dentro dos íons poliatômicos. Note que todos os íons poliatômicos cujos nomes terminam em”- ate “contêm mais um oxigênio do que aqueles aniões poliatômicos cujos nomes terminam em “- ite”.”Infelizmente, muito parecido com o sistema comum para nomear metais de transição, estes sufixos apenas indicam o número relativo de oxígenos que estão contidos dentro dos íons poliatômicos. Por exemplo, o íon nitrato, que é simbolizado como NO3−1, tem mais um oxigênio do que o íon nitrito, que é simbolizado como NO2−1. No entanto, o íon sulfato é simbolizado como SO4−2. Enquanto tanto o íon nitrato quanto o íon sulfato compartilham um sufixo” – comeu”, o primeiro contém três oxigenos, mas o último contém quatro. Adicionalmente, tanto o íon nitrato quanto o íon sulfito contêm três oxigenos, mas estes íons poliatômicos não compartilham um sufixo comum. Infelizmente, a natureza relativa destes sufixos determina que as combinações de Fórmula iônica/nome iônico dos íons poliatômicos devem ser simplesmente memorizadas.
A regra para a construção de fórmulas para compostos iônicos contendo íons poliatômicos é a mesma que para fórmulas contendo íons monatômicos( um átomo): as cargas positivas e negativas devem Balancear. Se mais de um íon poliatômico particular for necessário para equilibrar a carga, toda a fórmula para o íon poliatômico deve ser fechada entre parênteses, e o índice numérico é colocado fora dos parênteses. Isto é para mostrar que o índice se aplica a todo o íon poliatômico. Dois exemplos são mostrados abaixo:

exemplo \(\Pagindex{2}\)
escreva a fórmula química para um composto iônico composto por cada par de íons.
O íon de cálcio e o íon nitrato
solução
exercício \(\PageIndex{2}\)
escreva a fórmula química para um composto iónico composto por cada par de iões.
- o íon magnésio e o carbonato de iões
- o alumínio íon e o acetato de iões
Resposta:
Mg2+ e CO32- = MgCO3
a Resposta b:
Al3+ e C2H3O2- = Al(C2H3O2)3
Reconhecer os Compostos Iónicos
Existem duas formas de reconhecer os compostos iónicos. Em primeiro lugar, os compostos entre elementos metálicos e não metálicos são geralmente iónicos. Por exemplo, CaBr2 contém um elemento metálico (cálcio, um metal do grupo 2A) e um elemento não-metálico (bromo, um grupo 7A não-metal). Portanto, é provavelmente um composto iônico. (Na verdade, é Jônico.) In contrast, the compound no2 contains two elements that are both nonmetals (nitrogen, from group 5A, and oxygen, from group 6A). Não é um composto iônico; pertence à categoria de compostos covalentes discutir em outro lugar. Note também que esta combinação de nitrogênio e oxigênio não tem carga elétrica especificada, por isso não é o íon nitrito.
Em Segundo Lugar, Se você reconhecer a fórmula de um íon poliatômico em um composto, o composto é iônico. Por exemplo, se você ver a fórmula \(\ce{Ba(NO3)2}\), você pode reconhecer a parte “NO3” como o íon nitrato, \(\rm{NO_3^−}\). (Lembre-se que a convenção para escrever fórmulas para compostos iônicos não deve incluir a carga iônica.) Esta é uma pista de que a outra parte da fórmula, \(\ce{Ba}\), é na verdade o íon \(\ce{Ba^2+}\), com a carga 2+ equilibrando a carga global 2 dos dois íons nitratos. Assim, este composto também é iônico.
exemplo \(\PageIndex{3}\)
identifique cada composto como iónico ou não.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{DE2}\)
Solução
- o Sódio é um metal, e o oxigênio é um metalóide; portanto, \(\ce{Na2O}\) é esperado para ser iônica.tanto o fósforo como o cloro não são metais. Portanto, \(\ce{PCl3}\) não é iónico.
- o \(\ce{NH4}\) na fórmula representa o ião amónio, \(\ce{NH4^ { + }}\), o que indica que este composto é iónico.o oxigénio e o flúor não são metais. Portanto, \(\ce{OF2}\) não é iónico.
exercício \(\PageIndex{3}\)
identificar cada composto como iónico ou não.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Responder a:
não iônico
a Resposta b: resposta c: resposta jónica D: não jónica D: não jónica D: não jónica D: não div d: olhando mais de perto: sangue e água do mar a Ciência reconheceu há muito que o sangue e a água do mar têm composições semelhantes. Afinal, ambos os líquidos têm compostos iónicos dissolvidos neles. A semelhança pode ser mais do que mera coincidência; muitos cientistas pensam que as primeiras formas de vida na Terra surgiram nos oceanos. Um olhar mais atento, porém, mostra que o sangue e a água do mar são bastante diferentes. Uma solução de cloreto de sódio a 0, 9% aproxima-se da concentração de sal encontrada no sangue. Em contraste, a água do mar é principalmente uma solução de cloreto de sódio a 3%, mais de três vezes a concentração no sangue. Aqui está uma comparação das quantidades de íons no sangue e a água do mar:
| Íon | % em água do mar | Porcentagem no Sangue |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Esta diferença é significativa porque o íon hidrogenocarbonato e alguns íons relacionados têm um papel crucial no controle das propriedades ácido-base do sangue. A quantidade de iões de fosfato de hidrogénio—\(\ce{HPO4^{2−}}\) e \(\ce{H2PO4^{−}}\)—na água do mar é muito baixa, mas estão presentes em quantidades mais elevadas no sangue, onde também afectam as propriedades ácido-base. Outra diferença notável é que o sangue não tem quantidades significativas do íon sulfato (\(\ce{SO4^{2−}}\)), mas este íon está presente na água do mar.fórmulas químicas adequadas para compostos iónicos equilibram a carga positiva total com a carga negativa total.grupos de átomos com uma carga global, chamados íons poliatômicos, também existem.
EXERCÍCIOS
-
Qual é a informação contida na fórmula de um composto iónico?
-
Por que as fórmulas químicas para alguns compostos iónicos contêm subscritos, enquanto outros não?3. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- Mg2+ e I−
- Na+ e O2−
4. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- Na+ e Br−
- Mg2+ e Br−
- Mg2+ e S2−
5. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- K+ e Cl−
- Mg2+ e Cl−
- Mg2+ e Se2−
6. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- Na+ e N3
- Mg2+ e N3
- Al3+ e S2−
7. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- Li+ e N3
- Mg2+ e P3
- Li+ e P3
8. Escreva a fórmula química para o composto iônico formado por cada par de íons.
9. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- Cr3+ e O2−
- Cr2+ e O2−
- Pb2+ e Cl−
- Pb4+ e Cl−
10. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- Cr3+ e NO3−
- Fe2+ e PO43−
- Ca2+ e CrO42−
- Al3+ e OH−
11. Escreva a fórmula química para o composto iônico formado por cada par de íons.
- NH4+ e NO3−
- H+ e Cr2O72−
- Cu+ e CO32−
- Na+ e HCO3−
12. Para cada par de elementos, determinar a carga para seus íons e escrever a fórmula adequada para o composto iônico resultante entre eles.
- Ba e S
- Cs e I
13. Para cada par de elementos, determinar a carga para seus íons e escrever a fórmula adequada para o composto iônico resultante entre eles.
- K e S
- Sc e Br
14. Que compostos você prevê que sejam iônicos?
- Li2O
- (NH4)2
- CO2
- FeSO3
- C6H6
- C2H6O
15. Que compostos você prevê que sejam iônicos?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
Respostas
1. a razão de cada tipo de íon no composto
2. Às vezes, mais de um íon é necessário para equilibrar a carga sobre o outro íon em um composto iônico.
- MgI2
- Na2O
- NaBr
- MgBr2
- GM
- KCL
- MgCl2
- mgse
- na3n
- mg3n2
- al2s3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- Cr2O3
- CRO
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- Ba2+, S2−, bas
- cs+, i−, CSI
- K+, S2−, K2s
- SC3+, br−, scbr3
- Iônica
- não Iônico
- Iônica
- não Iônico
- não Iônico
- não Iônico
- não Iônico
- não Iônico
- div>
- iônica
não iônico não iônico - iônica
não iônico não iônico
- iônica
