there are a number of ways in which a cell can move from one point in space to another. Em um meio líquido, esse método pode ser algum tipo de natação, utilizando movimentos ciliares ou flagelares para impulsionar a célula. Em superfícies sólidas, esses mecanismos claramente não funcionarão de forma eficiente, e a célula passa por um processo de rastejamento. Nesta seção, começamos com uma discussão sobre movimentos ciliares / flagelares, e então consideramos os requisitos mais complicados de rastreamento celular.cílios e flagelos, que diferem principalmente em comprimento e não em construção, são organelas baseadas em microtúbulos que se movem com um movimento para a frente e para trás. Isso se traduz para “remo” relativamente curta cílios, mas, no longo flagelados, a flexibilidade da estrutura faz com que o vai-e-vem de movimento para ser propagada como uma onda, de modo a flagellar movimento é mais ondulados ou whiplike (considere o que acontece quando você agitada de uma mangueira de jardim rapidamente de um lado para outro, comparado a um pequeno pedaço do mesmo mangueira). O núcleo de qualquer estrutura é chamado de axonema, que é composto de 9 microtúbulos conectados uns aos outros por proteínas motoras da dineína ciliar, e em torno de um núcleo central de dois microtúbulos separados.
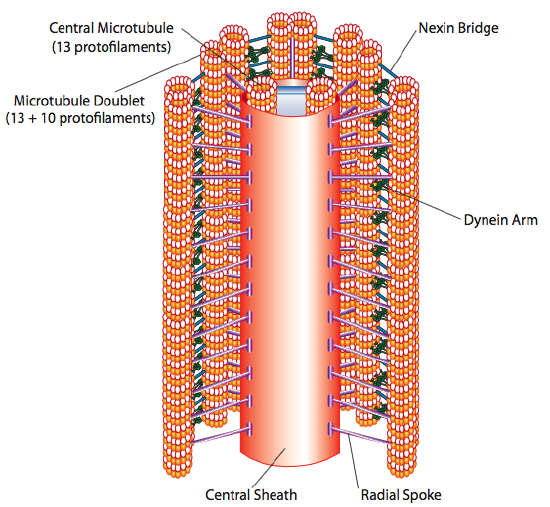
This is known as the” 9+2 ” formation, although the nine doublets are not the same as the two central microtubules. O túbulo A é um total de 13 protofilamentos, mas o túbulo B fundido contém apenas 10 protofilamentos. Cada um dos microtúbulos centrais é um total de 13 protofilamentos. O axonema 9+2 estende o comprimento do cílio ou flagelo da ponta até chegar à base, e se conecta ao corpo celular através de um corpo basal, que é composto de 9 trigêmeos microtúbulos organizar em um barril curto, muito parecido com os centrióis de que são derivados.
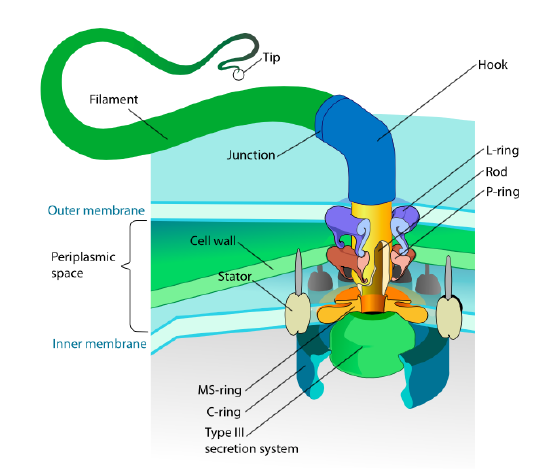
Esta secção refere-se apenas a eucariontes. Alguns procariontes também têm apêndices móveis chamados flagela, mas eles são completamente diferentes em estrutura e mecanismo. Os próprios flagelos são longos polímeros helicoidais da proteína flagelina, e a base das fibras flagelina está ligada a uma proteína motora rotacional, não a um motor translacional. Este motor (figura \(\PageIndex{18}\)) utiliza iões (H+ ou na+ dependendo das espécies) num gradiente electroquímico para fornecer energia para rodar até 100000 rotações por minuto. Pensa-se que a rotação é impulsionada por mudanças conformacionais no anel estator, aninhado na membrana celular.
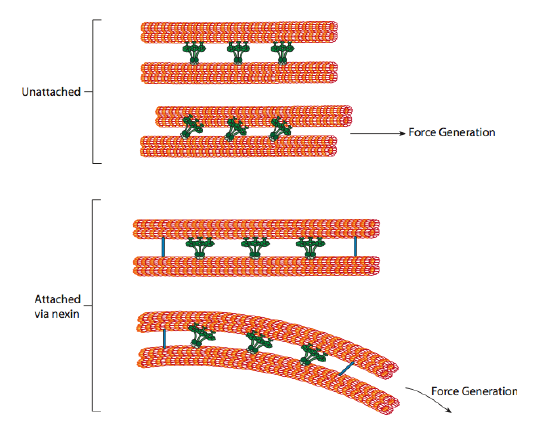
as dineínas ciliares fornecem a capacidade motora, mas existem duas outras proteínas de ligação no axonema também. Há nexins que unem o a-tubule de um doublet ao B-tubule de seu doublet adjacente, ligando assim o anel exterior. E, há raios radiais que se estendem do túbulo de cada duplo até o par central de microtúbulos no núcleo do axonema. Nenhum destes tem qualquer actividade motora. No entanto, eles são cruciais para o movimento de cílios e flagelos porque eles ajudam a transformar um movimento de deslizamento em um movimento de flexão. Quando a dineína ciliar (muito semelhante às dineínas citoplásmicas, mas tem três cabeças em vez de Duas) está envolvida, ela liga um microtúbulo de um lado, um microtúbulo B do duplo adjacente, e se move um em relação ao outro. Uma linha destas dineins movendo-se em concerto deslizaria assim um doublet em relação ao outro, se (e é um “se” grande) os dois doublets tiveram a liberdade completa do movimento. No entanto, uma vez que as doublets estão interligadas pelas proteínas nexin, o que acontece quando uma doublet tenta deslizar é que ele dobra a estrutura conectada em vez disso (figura \(\PageIndex{17}\)). Esta curva explica o movimento de remo dos cílios, que são relativamente curtos, bem como o movimento de chicote do longo flagela, que propaga o movimento de flexão para baixo do axonema.
Apesar de pensarmos ciliar e flagellar movimento como métodos para a propulsão de uma célula, tais como a flagellar de natação de esperma no sentido de um ovo, há também um número de lugares importantes, na qual a célula está parado, e os cílios são usados para mover o fluido passado célula. Na verdade, há células com cílios na maioria dos principais órgãos do corpo. Vários discinesias ciliares têm sido relatados, dos quais os mais proeminentes, discinesia ciliar primária (PCD), que inclui a síndrome de Kartagener (KS), é devido à mutação do DNAI1 gene, que codifica uma subunidade (intermediário corrente 1) de axonemal (ciliar) dynein. PCD é caracterizada por dificuldade respiratória devido a infecção recorrente, e o diagnóstico de KS é feito se houver também situs inversus, uma condição em que a assimetria normal esquerda-direita do corpo (por exemplo, estômago à esquerda, fígado à direita) é revertida. O primeiro sintoma é devido à inatividade dos numerosos cílios das células epiteliais nos pulmões. A sua função normal é manter o muco na via respiratória constantemente em movimento. Normalmente o muco ajuda a manter os pulmões úmidos para facilitar a função, mas se o muco se torna estacionário, torna-se um terreno fértil para as bactérias, bem como se tornando um irritante e obstáculo para a troca de gás adequado.
sito inversus é uma malformação interessante porque surge no desenvolvimento embrionário, e afeta apenas 50% dos pacientes com DPC porque a função ciliar prejudicada causa a aleatorização da assimetria esquerda-direita, não reversão. Em termos muito simples, durante o desenvolvimento embrionário inicial, a assimetria esquerda-direita é devida, em parte, ao movimento de sinais moleculares em uma direção esquerda através do nó embrionário. Este fluxo é causado pelo espancamento coordenado de cílios, de modo que quando eles não funcionam, o fluxo é interrompido e a aleatorização ocorre.outros sintomas de pacientes com DPC também apontam para o trabalho de cílios e flagelos no corpo. Infertilidade masculina é comum devido ao esperma imotil. Infertilidade feminina, embora menos comum, também pode ocorrer, devido à disfunção dos cílios do oviduto e tubo Falópio que normalmente movem o óvulo ao longo do ovário para o útero. Curiosamente, há também uma baixa associação de hidrocefalia internus (overfilling dos ventrículos do cérebro com líquido cefalorraquidiano, causando a sua ampliação que comprime o tecido cerebral ao seu redor) com PCD. Isto é provavelmente devido à disfunção de cílios nas células ependimais que cobrem os ventrículos, e que ajudam a circular o LCR, mas aparentemente não são completamente necessários. Uma vez que o fluxo de massa do LCR é pensado para ser impulsionado principalmente pela alteração sistólica/ diastólica na pressão arterial no cérebro, algumas hipóteses de que os cílios podem estar envolvidos principalmente em ow através de alguns dos canais mais apertados no cérebro.
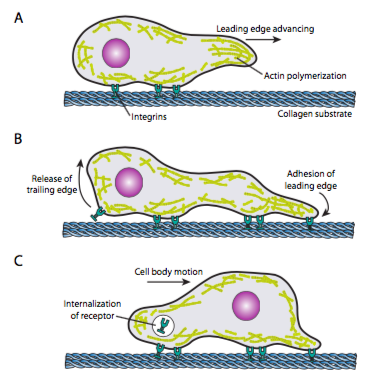
Cell crawling (Figure \(\PageIndex{19}\)) requer o rearranjo coordenado da rede de microfilamentos de borda dianteira, estendendo-se (por polimerização e filamentos deslizantes) e, em seguida, formando aderências no novo ponto mais avançado. Isto pode assumir a forma de filopodia ou lamellipodia, e muitas vezes ambos simultaneamente. Os filopodos são projeções longas e muito finas com feixes de núcleo de microfilamentos paralelos e altas concentrações de receptores de superfície celular. O seu objectivo é, em primeiro lugar, sentir o ambiente. Lamellipodia frequentemente se estende entre dois lopodia e é mais de um ruffle Largo do que um dedo. Internamente, a actina forma-se mais em malhas do que em feixes, e a aresta mais ampla permite que mais aderências sejam feitas ao substrato. A rede de microfilamentos então rearranja novamente, desta vez abrindo um espaço no citoplasma que atua como um canal para o movimento dos microtúbulos para a frente da célula. Isto coloca a rede de transporte no lugar para ajudar a mover o material intracelular para a frente. Como isso ocorre, as adesões antigas na extremidade traseira da célula são liberadas. Esta libertação pode ocorrer através de dois mecanismos primários: endocitose do receptor ou Desactivação do receptor por sinalização/Alteração conformacional. É claro que esta simplificação desmedida contradiz as complexidades na coordenação e controle de todas essas ações para realizar o movimento direcionado de uma célula.
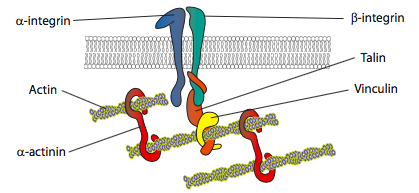
Um modelo de microfilament de geração de força, o Elástico Browniano Catraca Modelo (Mogilner e Oster, 1996), propõe que, devido ao movimento Browniano da membrana celular resultante da contínua minutos a oscilação térmica, os filamentos de actina, que empurra para as margens da membrana são flexionados em graus variados. Se a flexão for suficientemente grande, um novo monómero de actina pode encaixar-se entre a membrana e a ponta do filamento, e quando o filamento agora mais longo flexiona para trás, pode exercer uma maior pressão sobre a membrana. Obviamente um único filamento não gera muita força, mas a extensão coordenada de muitos filamentos pode empurrar a membrana para a frente.uma vez que uma célula recebe um sinal para se mover, a resposta inicial do citoesqueleto é polimerizar a actina, construindo mais microfilamentos para incorporar na borda dianteira. Dependendo do sinal (atraente ou repulsivo), a polimerização pode ocorrer no mesmo lado ou oposto da célula a partir do ponto de ativação do receptor do sinal. Significativamente, a polimerização de novo f-actin sozinho pode gerar força suficiente para mover a membrana para a frente, mesmo sem o envolvimento de motores de miosina! Modelos de geração de força estão sendo debatidos, mas geralmente começam com a incorporação de novo g-actin em um filamento na ponta, ou seja, na interface filamento-membrana. Mesmo que isso seja tecnicamente suficiente, em uma célula viva, myosins estão envolvidos, e ajudam a empurrar e organizar filamentos direcionalmente, a fim de configurar a nova linha de liderança. Além disso, alguns filamentos e redes devem ser rapidamente cortados, e novas conexões feitas, tanto entre filamentos e entre filamentos e outras proteínas, como moléculas de adesão ou microtúbulos.como é controlada a polimerização e o rearranjo da actina? Os receptores que sinalizam a locomoção celular podem iniciar caminhos um pouco diferentes, mas muitos compartilham algumas semelhanças na ativação de um ou mais membros da família Ras de pequenas GTPases. Estas moléculas sinalizadoras, tais como Rac, Rho e cdc42 podem ser ativadas pelo receptor tirosina cinases (ver vias de ativação RTK-Ras, Cap. 14). Cada um destes tem um papel ligeiramente diferente na motilidade celular: a ativação cdc42 leva à formação filopodia, Rac ativa uma via que inclui Arp2/3 e cofilina à formação lamellipodia, e Rho ativa a miosina II para controlar a adesão focal e a formação de fibras de estresse. Um tipo diferente de cascata de receptores, a cascata de sinalização G-proteína (também Capítulo 14), pode levar à ativação de PLC e subsequente clivagem de PIP2 e aumento na Ca2 citosólica+. Estas alterações, como observado anteriormente, também podem ativar a miosina II, bem como as enzimas remodeladoras gelsolin, cofilin e profilin. Isto quebra as estruturas de actina existentes para tornar a célula mais fluida, enquanto também contribui com mais g-actina para formar o novo citoesqueleto de borda dianteira.experiências in vitro demonstram que, à medida que a membrana avança, novos contactos adesivos são feitos através de moléculas de adesão ou receptores que se ligam ao substrato (frequentemente, as lâminas de cultura celular ou os pratos são revestidos com colagénio, filaminina ou outras proteínas de matriz extracelular). Os contactos recrutam então elementos do citoesqueleto para uma maior estabilidade para formar uma aderência focal (figura \(\PageIndex{20}\)). No entanto, a formação de adesões focais parece ser um artefato da cultura celular, e não é claro se os tipos de adesões que se formam in vivo recrutam os mesmos tipos de componentes do citoesqueleto.
o terceiro passo para a locomoção celular é o movimento em massa do conteúdo celular para a frente. Os mecanismos para esta fase não são claros, mas há algumas evidências de que usando ligações entre o citoesqueleto de actina na borda dianteira e partes dianteiras do citoesqueleto microtúbulo, os microtúbulos são reorganizados para formar um caminho de transporte eficiente para o movimento em massa. Outro aspecto a isso pode ser um efeito de” ondulação ” das redes actin, que direcionalmente abrem espaço para a borda dianteira. Os microtúbulos entram então nesse espaço mais facilmente do que trabalhar através de uma malha de actina apertada, forçando o fluxo na direção correta.
mais de microtubule-actina medicamentosas na célula a mobilidade tem sido feito por meio de pesquisas sobre o crescimento neuronal cone, que é por vezes referido como uma célula em uma coleira, porque ele age quase que de forma independente como um rastreamento de celular, procurando a via adequada para levar sua axônio da célula do corpo para sua própria conexão sináptica (A. W. Schaefer et al, Dev. Cell 15: 146-62, 2008).
finalmente, a célula deve desfazer as suas adesões antigas na extremidade posterior. Isto pode acontecer de várias maneiras diferentes. Observaram-se células rastejantes in vitro que se arrancam do substrato, deixando para trás pequenos pedaços de membrana e proteínas de adesão associadas ao processo. Presume-se que a força gerada provém de fibras de estresse actin-miosina que conduzem a aderências focais mais avançadas. No entanto, existem mecanismos menos destrutivos disponíveis para as células. Em alguns casos, a aderência do receptor celular para o substrato extracelular pode ser regulada internamente, talvez por fosforilação ou desphoforilação de um receptor. Outra possibilidade é a endocitose do receptor, retirando-o da superfície celular. Pode simplesmente reciclar até a borda dianteira onde é necessário (ou seja, transcitose), ou se não for mais necessário ou danificado, pode ser quebrado em um lisossomo.
