stosowanie spójnej terminologii w badaniach i między nimi ma kluczowe znaczenie dla umożliwienia efektywnego procesu próbnego. Standardy CDISC, takie jak CDASH, SDTM, SEND i ADaM standaryzują struktury używane podczas zbierania i przesyłania danych, ale co z wartościami danych?
ten post zawiera przegląd znormalizowanej terminologii kontrolowanej CDISC i sposobu jej wykorzystania do zbierania i przesyłania danych w sposób, który przyspiesza próby i umożliwia analizę krzyżową.
Jeśli jesteś zainteresowany czytaniem więcej o standardach CDISC możesz przeczytać nasze blogi wszystko, co musisz wiedzieć o SDTM i wprowadzenie do standardów CDISC.
CDISC współpracuje z NCI w celu zdefiniowania standardowej terminologii
CDISC współpracuje z National Cancer Institute (NCI) w celu zapewnienia spójności terminologii w badaniach klinicznych. Dzięki tej współpracy standardowy zestaw terminologii został zdefiniowany i jest aktualizowany co kwartał, zapewniając spójność semantyczną w badaniach. Korzystając z tej terminologii, ta sama informacja będzie reprezentowana w ten sam sposób we wszystkich badaniach.
weźmy prosty przykład – płeć:
- czy mężczyzna powinien być reprezentowany przez „Męski”, „Męski”, „M” lub „1”?
- jak należy rejestrować osoby interpłciowe?
w minionych dniach informacje te mogły być zbierane na różne sposoby dla każdego badania. Standard terminologii CDISC NCI definiuje obecnie, że jedynymi dopuszczalnymi opcjami są „F”, „M”, „U” i „UNDIFFERENTIATED”, oraz że osoba interpłciowa powinna być zapisana jako „UNDIFFERENTIATED”. Można zobaczyć, jak ten bardzo prosty przykład już znacznie ułatwia zrozumienie podstawowych danych i łatwe segmentowanie dla różnych populacji w różnych badaniach.
![]() Uwaga
Uwaga
katalog standardów danych FDA nakazuje teraz, aby znormalizowana terminologia NCI była używany do wszystkich nowych badań. To znacznie ułatwia życie recenzentowi, ponieważ wie, jak interpretować dane.

Jak definiowana jest terminologia CDISC NCI?
poniższa tabela pokazuje, jak definiowana jest standardowa terminologia płci.
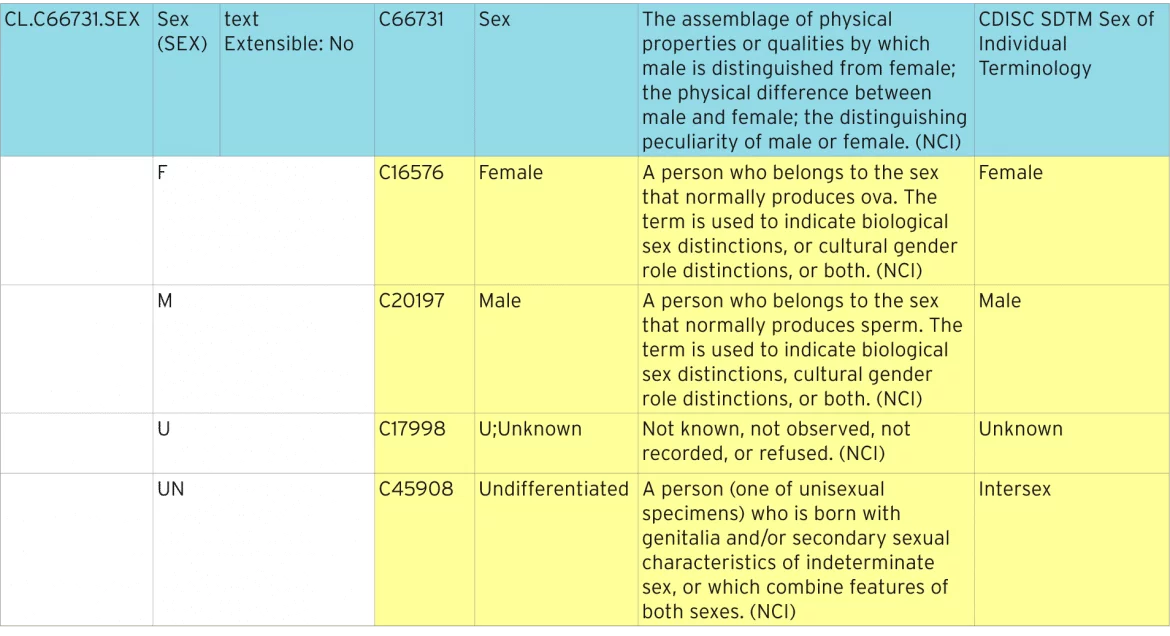
Identyfikacja standardowej terminologii
Niebieska linia reprezentuje listę kodów, która zawiera wszystkie poszczególne kody. Lista kodów ma standardowy ” kod C „z ” C66731″. Każdy z poszczególnych kodów ma swój własny kod C, np. „C16576”. Te kody C są używane w ODM i definiują metadane XML do identyfikacji list kodów jako standardowej terminologii NCI.
rozszerzalność
Ta lista kodowa jest zdefiniowana jako non-extensible, co oznacza, że gdziekolwiek jest używana lista kodowa, nie może zawierać żadnych terminów nie wymienionych tutaj. Listy kodów, które są rozszerzalne, mogą zawierać dodatkowe warunki. Te dodatkowe terminy muszą być opisane w Define-XML jako terminy rozszerzone i nie mogą być powielane ani synonimami istniejących terminów.
wartość zgłoszenia, synonimy i preferowany termin
wartość zgłoszenia jest tym, co należy przesłać do organu regulacyjnego. Wartość rzeczywiście wyświetlana w formularzu może być inna, a może jeden z synonimów lub preferowany termin.
dostępne w wielu kolorach
standardy terminologii NCI są dostępne w wielu formatach dostosowanych do różnych potrzeb, w tym Excel, ODM, HTML i RDF. Powyższy przykład pochodzi z wersji programu Excel.
pogrupowane w podzbiory dla CDASH, SDTM, ADaM i innych
dla wygody, Terminologia NCI jest pogrupowana w kilka podzbiorów.
- terminologia SDTM zawiera terminy do użycia w złożeniu opartym na SDTM
- terminologia CDASH zawiera terminy do użycia w gromadzeniu danych opartych na CDASH
- Terminologia ADaM zawiera terminy do użycia w zestawach danych ADaM
- terminologia SEND zawiera terminy do użycia w złożeniu opartym na SEND
- terminologia protokołu zawiera terminy do użycia z Modelem reprezentacji protokołu (PRM) i rejestrem badań klinicznych XML (CTR-XML)
używanie terminologii CDISC NCI w badaniu
przy definiowaniu metadanych przesyłania w define-XML, listy kodowe są używane do definiowania list stałych wartości dla niektórych zmiennych. Zgodnie z aktualnym rozporządzeniem FDA, te listy kodów muszą być zgodne ze znormalizowaną terminologią CDISC NCI, jeśli taka terminologia istnieje. Są one powiązane ze znormalizowaną terminologią poprzez dodanie aliasów do kodów C, np.:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
przy definiowaniu metadanych gromadzenia danych w ODM nie ma wymogu stosowania znormalizowanej terminologii, jednak spowoduje to usunięcie konieczności mapowania Warunki od zebranych danych do przesłanych danych. To znacznie upraszcza proces badania end-to-end i zwiększa spójność między badaniami.
zarządzanie aktualizacjami
zarządzanie aktualizacjami terminologii może być sporym nakładem pracy, szczególnie przy tak regularnej aktualizacji standardów. Skąd wiesz, jakie badania lub standardy organizacyjne mogą mieć wpływ na nową terminologię? Jak następnie dokonać wymaganych aktualizacji w sposób skuteczny i niezawodny?
najprostszym sposobem zarządzania tym jest użycie repozytorium metadanych CDISC, które pozwala zdefiniować standardy organizacyjne zbudowane na podstawie znormalizowanej terminologii i zbudować swoje badania na podstawie tych standardów. Ponieważ repozytorium rozumie relacje między wszystkimi standardami a badaniami, może uprościć proces aktualizacji do nowych wersji standardów terminologicznych CDISC NCI.
