cele nauki
- opis podstawowej struktury aminokwasu
- opis struktury chemicznej białek
- podsumowanie unikalnych cech białek
na początku tego rozdziału opisano słynny eksperyment, w którym naukowcy zsyntetyzowali aminokwasy w Warunkach symulujących te obecne na ziemi na długo przed ewolucją życia, jakie znamy. Związki te są zdolne do wiązania się ze sobą w zasadzie dowolnej liczby, dając cząsteczki o zasadniczo dowolnej wielkości, które posiadają szeroki wachlarz właściwości fizycznych i chemicznych i pełnią liczne funkcje istotne dla wszystkich organizmów. Cząsteczki pochodzące z aminokwasów mogą funkcjonować jako składniki strukturalne komórek i jednostek subkomórkowych, jako źródła składników odżywczych, jako zbiorniki magazynujące atom i energię oraz jako gatunki funkcjonalne, takie jak hormony, enzymy, receptory i cząsteczki transportowe.
aminokwasy i wiązania peptydowe

Rysunek 1.
aminokwas jest cząsteczką organiczną, w której atom wodoru, Grupa karboksylowa (–COOH) i grupa aminowa (–NH2) są związane z tym samym atomem węgla, tak zwanym węglem α. Czwarta grupa związana z węglem α różni się między różnymi aminokwasami i nazywa się pozostałością lub łańcuchem bocznym, reprezentowanym we wzorach strukturalnych literą R. pozostałość jest monomerem, który powstaje, gdy dwa lub więcej aminokwasów łączy się i usuwa cząsteczki wody. Podstawowa struktura białka, łańcuch peptydowy, składa się z reszt aminokwasowych. Unikalne cechy grup funkcyjnych i grup R pozwalają tym składnikom aminokwasów tworzyć wiązania wodorowe, jonowe i dwusiarczkowe, wraz z polarnymi/niepolarnymi interakcjami niezbędnymi do utworzenia drugorzędowych, trzeciorzędowych i czwartorzędowych struktur białkowych. Grupy te składają się głównie z węgla, wodoru, tlenu, azotu i siarki, w postaci węglowodorów, kwasów, amidów, alkoholi i Amin. Kilka przykładów ilustrujących te możliwości przedstawiono na rysunku 1.
aminokwasy mogą wiązać się chemicznie przez reakcję grupy kwasów karboksylowych jednej cząsteczki z grupą aminową drugiej. Reakcja ta tworzy wiązanie peptydowe i cząsteczkę wody i jest kolejnym przykładem syntezy odwodnienia (ryc. 2). Cząsteczki utworzone przez chemicznie łączące stosunkowo skromną liczbę aminokwasów (około 50 lub mniej) nazywane są peptydami, a prefiksy są często używane do określenia tych liczb: dipeptydy (dwa aminokwasy), tripeptydy (trzy aminokwasy) i tak dalej. Bardziej ogólnie określa się przybliżoną liczbę aminokwasów: oligopeptydy powstają przez połączenie do około 20 aminokwasów, podczas gdy polipeptydy są syntetyzowane do około 50 aminokwasów. Gdy liczba aminokwasów połączonych ze sobą staje się bardzo duża, lub gdy wiele polipeptydów jest używanych jako podjednostki budujące, makrocząsteczki, które wynikają, nazywane są białkami. Stale zmienna długość (liczba monomerów) tych biopolimerów, wraz z różnorodnością możliwych grup R na każdym aminokwasie, pozwala na prawie nieograniczoną różnorodność typów białek, które mogą być tworzone.

Rysunek 2. Tworzenie wiązania peptydowego jest reakcją syntezy odwodnienia. Grupa karboksylowa pierwszego aminokwasu (alaniny) jest połączona z grupą aminową drugiego aminokwasu (alaniny). W procesie tym uwalniana jest cząsteczka wody.
pomyśl o tym
- ile aminokwasów jest w polipeptydach?
struktura białka
wielkość (długość) i specyficzna sekwencja aminokwasowa białka są głównymi determinantami jego kształtu, a kształt białka ma kluczowe znaczenie dla jego funkcji. Na przykład, w procesie biologicznego wiązania azotu (patrz cykle biogeochemiczne), mikroorganizmy glebowe zbiorowo znane jako rhizobia symbiotycznie oddziałują z korzeniami roślin strączkowych, takich jak soja, orzeszki ziemne lub fasola, tworząc nową strukturę zwaną guzkiem na korzeniach roślin. Następnie roślina wytwarza białko nośnikowe zwane leghemoglobiną, białko, które przenosi azot lub tlen. Leghemoglobina wiąże się z bardzo wysokim powinowactwem do substratu tlenu w określonym regionie białka, gdzie odpowiedni jest kształt i Sekwencja aminokwasowa (miejsce aktywne). Jeśli kształt lub środowisko chemiczne miejsca aktywnego jest zmienione, nawet nieznacznie, podłoże może nie być w stanie związać się tak silnie, lub może nie wiązać się w ogóle. Tak więc, aby białko było w pełni aktywne, musi mieć odpowiedni kształt do swojej funkcji.
struktura białka jest podzielona na cztery poziomy: pierwotny, wtórny, trzeciorzędowy i czwartorzędowy. Podstawową strukturą jest po prostu sekwencja aminokwasów tworzących łańcuch polipeptydowy. Rysunek 3 przedstawia pierwotną strukturę białka.
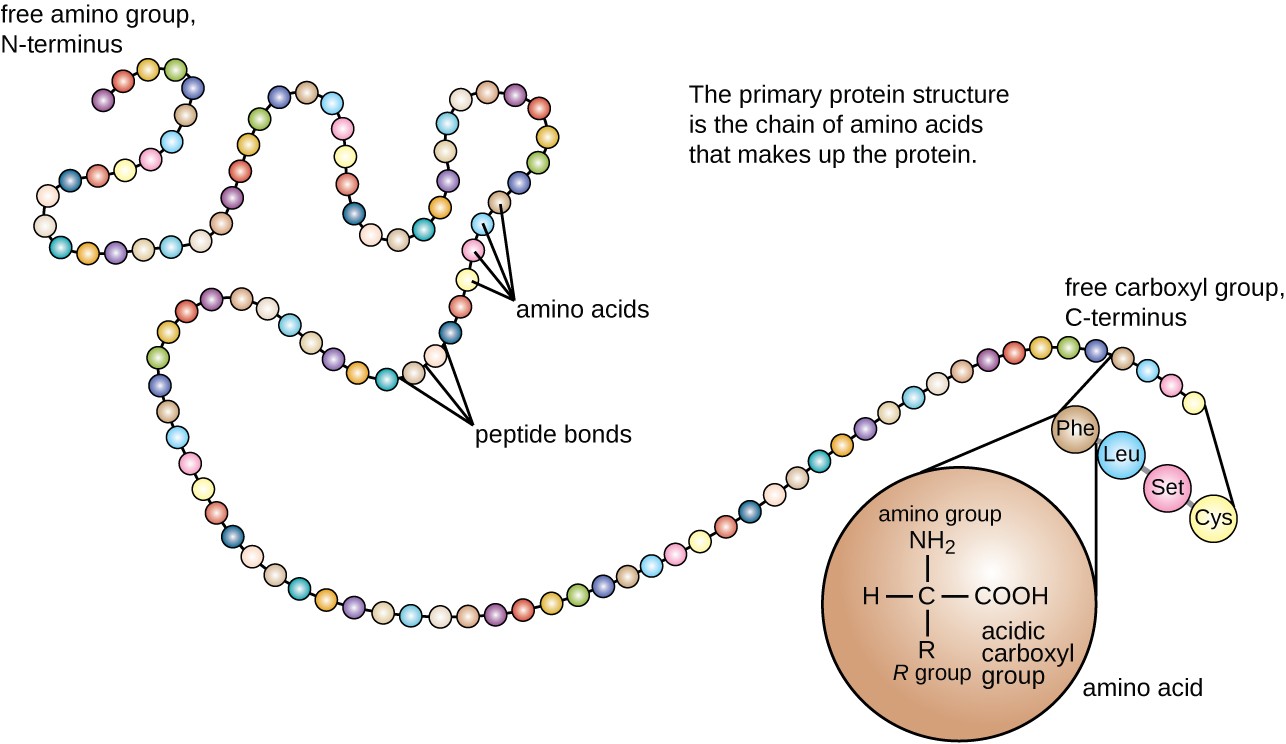
Rysunek 3. Kliknij, aby wyświetlić większy obraz. Podstawową strukturą białka jest sekwencja aminokwasów.
łańcuch aminokwasów, który definiuje pierwotną strukturę białka, nie jest sztywny, ale jest elastyczny ze względu na naturę wiązań, które trzymają aminokwasy razem. Gdy łańcuch jest wystarczająco długi, wiązanie wodorowe może wystąpić między grupami funkcyjnymi aminy i karbonylu w obrębie szkieletu peptydu (z wyłączeniem grupy po stronie R), co prowadzi do zlokalizowanego fałdowania łańcucha polipeptydowego na helisy i arkusze. Kształty te stanowią strukturę drugorzędową białka. Najczęstszymi strukturami wtórnymi są α-helisa i β-plisowany arkusz. W strukturze α-helisy helisa jest utrzymywana przez wiązania wodorowe między atomem tlenu w grupie karbonylowej jednego aminokwasu a atomem wodoru grupy aminowej, która jest tylko czterema jednostkami aminokwasowymi dalej wzdłuż łańcucha. W arkuszu β-plisowanym plisy są tworzone przez podobne wiązania wodorowe między ciągłymi sekwencjami grup karbonylowych i aminowych, które są dalej oddzielone na szkielecie łańcucha polipeptydowego (Fig.4).

Rysunek 4. Drugorzędną strukturą białka może być α-helisa lub β-plisowany arkusz, lub oba.
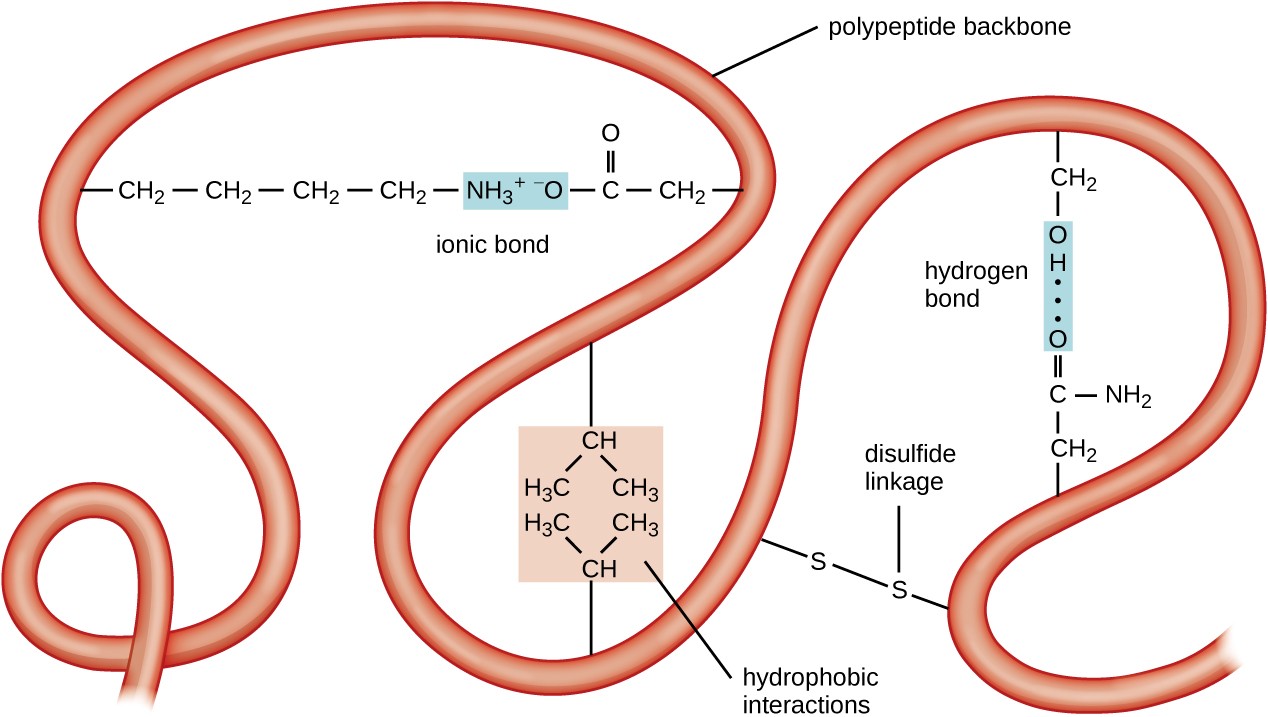
Rysunek 5. Kliknij, aby zobaczyć większy obraz. Trzeciorzędowa struktura białek jest określana przez różne siły atrakcyjne, w tym interakcje hydrofobowe, wiązanie jonowe, wiązanie wodorowe i wiązania dwusiarczkowe.
kolejnym poziomem organizacji białek jest struktura trzeciorzędowa, która jest wielkoskalowym trójwymiarowym kształtem pojedynczego łańcucha polipeptydowego. Struktura trzeciorzędowa jest określana przez interakcje między reszt aminokwasowych, które są daleko od siebie w łańcuchu. Różnorodne interakcje powodują powstanie struktury trzeciorzędowej białek, takich jak mosty dwusiarczkowe, które są wiązaniami między grupami funkcyjnymi sulfhydrylu (–SH) na grupach bocznych aminokwasów; wiązania wodorowe; wiązania jonowe; i hydrofobowe interakcje między niepolarowymi łańcuchami bocznymi. Wszystkie te oddziaływania, słabe i silne, łączą się w celu określenia ostatecznego trójwymiarowego kształtu białka i jego funkcji (ryc. 5).
proces, w którym łańcuch polipeptydowy przybiera wielkoskalowy, trójwymiarowy kształt nazywa się fałdowaniem białek. Złożone białka, które są w pełni funkcjonalne w ich normalnej roli biologicznej mówi się, że posiadają natywną strukturę. Gdy białko traci swój trójwymiarowy kształt, może nie być już funkcjonalne. Te rozłożone białka są denaturowane. Denaturacja oznacza utratę struktury wtórnej i struktury trzeciorzędowej (i, jeśli występuje, struktury czwartorzędowej) bez utraty struktury pierwotnej.
niektóre białka są złożeniami kilku oddzielnych polipeptydów, znanych również jako podjednostki białkowe. Białka te funkcjonują odpowiednio tylko wtedy, gdy wszystkie podjednostki są obecne i odpowiednio skonfigurowane. Interakcje, które trzymają te podjednostki razem tworzą czwartorzędową strukturę białka. Ogólna struktura czwartorzędu jest stabilizowana przez stosunkowo słabe oddziaływania. Na przykład hemoglobina ma czwartorzędową strukturę czterech kulistych podjednostek białkowych: dwóch polipeptydów α i dwóch β, z których każdy zawiera hem na bazie żelaza(ryc.

Rysunek 6. Cząsteczka hemoglobiny ma dwa polipeptydy α i dwa β wraz z czterema grupami hemowymi.
inną ważną klasą białek są białka sprzężone, które mają część nieproteinową. Jeśli sprzężone białko ma przyłączony węglowodan, nazywa się go glikoproteiną. Jeśli ma dołączony lipid, nazywa się go lipoproteiną. Białka te są ważnymi składnikami błon. Rycina 7 podsumowuje cztery poziomy struktury białka.

Rysunek 7. Struktura białka ma cztery poziomy organizacji. (kredyt: modyfikacja pracy przez National Human Genome Research Institute)
pomyśl o tym
- co może się zdarzyć, jeśli pierwotna, wtórna, trzeciorzędowa lub czwartorzędowa struktura białka zostanie zmieniona?
struktura pierwotna, dysfunkcyjne białka i mukowiscydoza

Rysunek 8. Kliknij, aby wyświetlić większy obraz. Normalne białko CFTR jest białkiem kanałowym, które pomaga sól (chlorek sodu) poruszać się i z komórek.
białka związane z błonami biologicznymi są klasyfikowane jako zewnętrzne lub wewnętrzne. Białka zewnętrzne, zwane także białkami obwodowymi, są luźno związane z jedną stroną błony. Białka wewnętrzne lub białka integralne są wbudowane w błonę i często funkcjonują jako część systemów transportowych jako białka transmembrane. Mukowiscydoza (CF) jest ludzkim zaburzeniem genetycznym spowodowanym zmianą białka przezbłonowego. Dotyczy to głównie płuc, ale może również wpływać na trzustkę, wątrobę, nerki i jelita. CF jest spowodowany utratą aminokwasu fenyloalaniny w białku przezbłonowym mukowiscydozy (CFTR). Utrata jednego aminokwasu zmienia pierwotną strukturę białka, które normalnie pomaga transportować sól i wodę do i z komórek (ryc. 8).
zmiana struktury pierwotnej uniemożliwia prawidłowe funkcjonowanie białka, co powoduje, że organizm wytwarza niezwykle gęsty śluz, który zatyka płuca i prowadzi do gromadzenia się lepkiego śluzu. Śluz blokuje trzustkę i zatrzymuje naturalne enzymy, które pomagają organizmowi rozkładać pokarm i wchłaniać niezbędne składniki odżywcze.
w płucach osób z mukowiscydozą zmieniony śluz zapewnia środowisko, w którym bakterie mogą się rozwijać. Kolonizacja ta prowadzi do powstawania biofilmów w małych drogach oddechowych płuc. Najczęstszymi patogenami występującymi w płucach pacjentów z mukowiscydozą są Pseudomonas aeruginosa (Fig. 9a) i Burkholderia cepacia. Pseudomonas różnicuje się w obrębie biofilmu w płucach i tworzy duże kolonie, zwane” mucoid ” Pseudomonas. Kolonie mają unikalną pigmentację, która pojawia się w testach laboratoryjnych (rysunek 9b) i dostarcza lekarzom pierwszej wskazówki, że pacjent ma mukowiscydozę (takie kolonie są rzadkie u zdrowych osób).

Rysunek 9. a) skaningowy mikrograf elektronowy pokazuje oportunistyczną bakterię Pseudomonas aeruginosa. b) pigment produkujący P. aeruginosa na agarze cetrymidowym pokazuje zielony pigment zwany piocyjaniną. (kredyt a: modyfikacja pracy przez Centers for Disease Control and Prevention)
kluczowe pojęcia i podsumowanie
- aminokwasy są małymi cząsteczkami niezbędnymi do życia. Każdy z nich ma węgiel α, z którym związany jest atom wodoru, Grupa karboksylowa i grupa aminowa. Czwarta związana Grupa, reprezentowana przez R, różni się składem chemicznym, rozmiarem, polaryzacją i ładunkiem pomiędzy różnymi aminokwasami, zapewniając zmienność właściwości.
- peptydy są polimerami powstałymi w wyniku połączenia aminokwasów poprzez syntezę odwodnienia. Wiązania między połączonymi aminokwasami nazywane są wiązaniami peptydowymi. Liczba aminokwasów połączonych ze sobą może się różnić od kilku do wielu.
- białka są polimerami utworzonymi przez połączenie bardzo dużej liczby aminokwasów. Pełnią wiele ważnych funkcji w komórce, służąc jako składniki odżywcze i enzymy; cząsteczki magazynujące węgiel, azot i energię oraz elementy strukturalne.
- struktura białka jest krytycznym wyznacznikiem jego funkcji i jest opisana przez stopniowaną klasyfikację: pierwotną, wtórną, trzeciorzędową i czwartorzędową. Natywna struktura białka może być zaburzona przez denaturację, co powoduje utratę jego struktury wyższego rzędu i funkcji biologicznej.
- niektóre białka są tworzone przez kilka oddzielnych podjednostek białkowych, interakcje tych podjednostek tworzą czwartorzędową strukturę kompleksu białkowego.
- sprzężone białka mają niepolipeptydową część, która może być węglowodanem (tworzącym glikoproteinę) lub frakcją lipidową (tworzącą lipoproteinę). Białka te są ważnymi składnikami błon.
wielokrotnego wyboru
która z poniższych grup różni się między różnymi aminokwasami?
- atom wodoru
- Grupa karboksylowa
- Grupa R
- grupa aminowa
aminokwasy obecne w białkach różnią się w których z poniższych?
- rozmiar
- kształt
- grupy boczne
- wszystkie powyższe
które z poniższych obligacji nie są zaangażowane w strukturę trzeciorzędową?
- wiązania peptydowe
- wiązania jonowe
- interakcje hydrofobowe
- wiązania wodorowe
wypełnij puste pole
sekwencja aminokwasów w białku nazywa się jego __________.
denaturacja oznacza utratę __________ oraz __________ konstrukcje bez utraty __________ struktura.
True/False
zmiana jednego aminokwasu w sekwencji białka zawsze powoduje utratę funkcji.
pomyśl o tym
- ogrzewanie białka w wystarczającym stopniu może spowodować jego denaturę. Biorąc pod uwagę definicję denaturacji, co to stwierdzenie mówi o sile wiązań peptydowych w porównaniu do wiązań wodorowych?
- pokazany obraz przedstawia tetrapeptyd.

- ile wiązań peptydowych znajduje się w tej cząsteczce?
- Zidentyfikuj grupy boczne czterech aminokwasów tworzących ten peptyd.
