Krótki opis dwóch rodzajów zaprogramowanej śmierci komórki: apoptozy i autofagii
apoptoza, czyli zaprogramowana śmierć komórki typu i, jest najczęściej badaną formą śmierci komórki. Jego cechy morfologiczne można zidentyfikować pod mikroskopem świetlnym i obejmują kurczenie się komórek, zagęszczanie chromatyny,wyblaknięcie błony cytoplazmatycznej i wreszcie tworzenie ciał apoptotycznych (ryc. 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
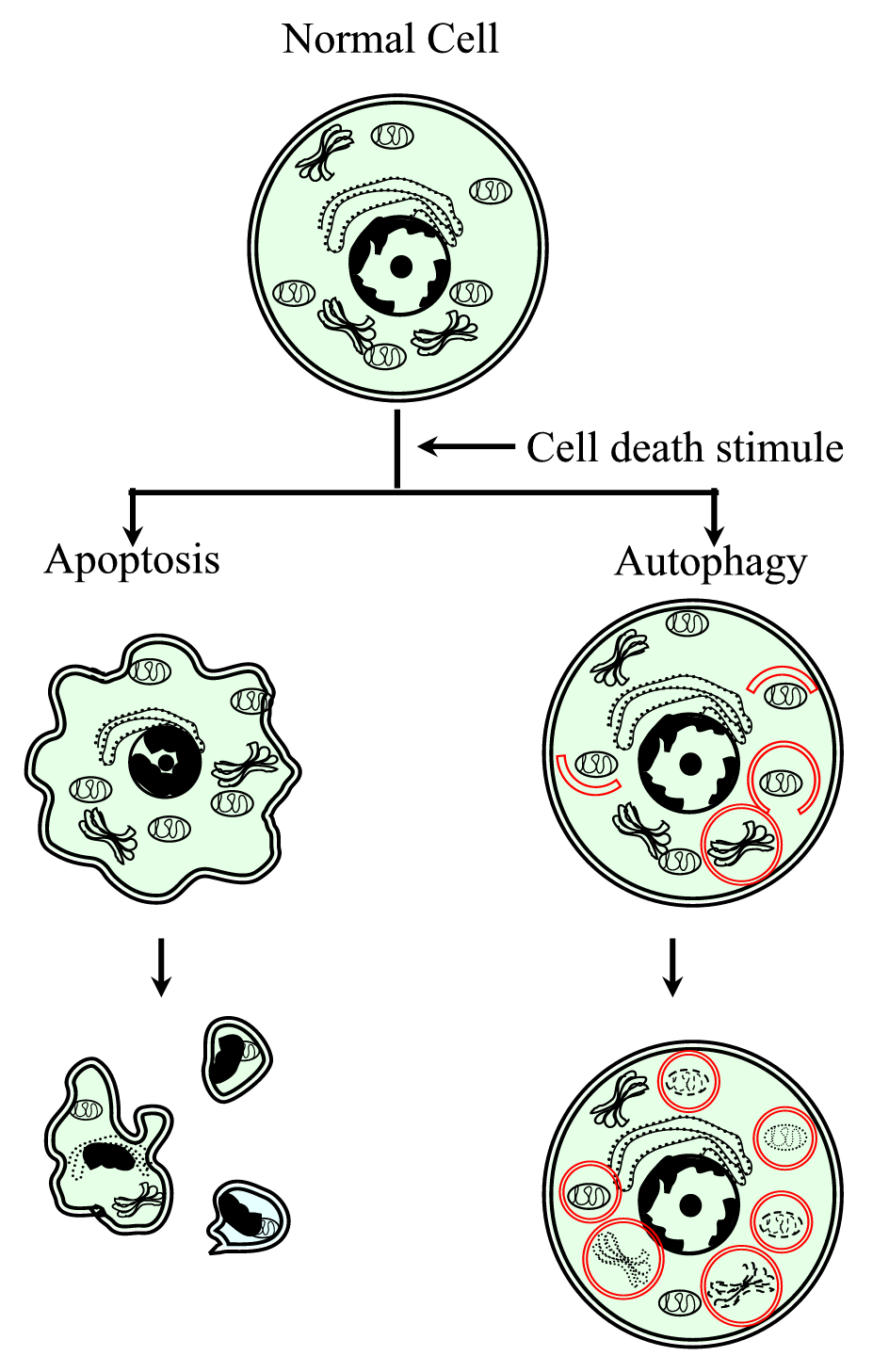
Figure 1.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:XSI=”http://www.w3.org/2001/XMLSchema-instanceSchematyczne przedstawienie zaprogramowanego procesu śmierci komórki typu i (apoptoza) i typu II (autofagia). Apoptoza charakteryzuje się skurczem komórkowym, zagęszczeniem chromatyny, błoniastymi pęcherzykami i tworzeniem ciał apoptotycznych. Autofagia charakteryzuje się obecnością dużej liczby autofagosomów z zawartością cytoplazmy. Oba rodzaje śmierci komórek nie generują odpowiedzi zapalnej, ponieważ błona cytoplazmatyczna jest zachowana, dopóki gruz komórkowy nie zostanie wyeliminowany przez sąsiedztwo lub przez wyspecjalizowane.
kaspazy są specyficznymi dla cysteinylo-asparaginianu proteazami, które są syntetyzowane w nieaktywnej formie jako zymogeny zwane pro-kaspazami (Fig. To właśnie ta nieaktywna forma umożliwia kontrolowane wykonanie procesu śmierci komórki. Kaspazy zostały po raz pierwszy zidentyfikowane u nicienia Ceanorhabditis elegans, ale u ssaków występują formy homologiczne .
cechy charakterystyczne apoptozy, takie jak fragmentacja DNA i zagęszczona chromatyna, wynikają z aktywności kaspazy. Podczas apoptozy DNA ulega fragmentacji do wielkości nukleosomów (200 bp) . Czynnikiem odpowiedzialnym za fragmentację DNA podczas apoptozy jest specyficzna Dnaza (CAD, dnaza aktywowana kaspazą) aktywowana przez aktywną kaspazę-3 . Aktywna kaspaza-3 bierze z kolei udział w zmianach morfologicznych komórek podczas apoptozy, gdzie rozszczepia związaną z rho kinazę-1 (ROCK-1) w celu jej aktywacji, co ostatecznie wpływa na układ cytoszkieletu, powodując morfologię skurczu apoptotycznego .

Rysunek 2.
xmlns:xlink=”http://www.w3.org/1999/xlink ” xmlns:MML=”http://www.w3.org/1998/Math/MathML”xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instancekaspazy biorące udział w procesie apoptotycznym są syntetyzowane w postaci nieaktywnej jako zymogeny, są tworzone przez pro-domenę, dużą podjednostkę i małą podjednostkę. Zymogeny są aktywowane tworząc tetramery.
apoptotyczna śmierć komórek jest silnie regulowana przez członków rodziny chłoniaków B-cell 2 (Bcl-2). Członkowie rodziny Bcl-2 zostali sklasyfikowani jako białka anty-apoptotyczne i pro-apoptotyczne zgodnie z ich homologią Bcl-2 (BH) i organizacją domeny (ryc. 3). Obecność domen BH1, BH2, BH3 i BH4 odpowiada grupie hamującej apoptozę. Natomiast grupa pro-apoptotyczna jest podzielona na dwie grupy: te z domenami BH1, BH2 i BH3 oraz te z domenami BH3 (zdefiniowanymi jako BH3; patrz recenzja w). Ta rodzina białek pełni swoje funkcje na poziomie wewnątrzkomórkowym wewnątrz mitochondriów, kluczowego elementu w apoptozie.

Rysunek 3.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns: mml= „http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceB-cell lymphoma 2 (Bcl-2) family proteins. A) ogólna schematyzacja struktury białek Bcl-2. B) członkowie anty-apoptotyczni-posiadają wszystkie cztery domeny BH. C) członkowie proapoptotyczni, którzy z kolei dzielą się na dwie grupy: multidomain i BH3.
apoptozę można zainicjować dwoma dobrze opisanymi drogami: zewnętrznymi i wewnętrznymi (Rysunek 4). Aktywacja zewnętrzna jest prowadzona przez udział ligandów śmierci (takich jak czynnik martwicy nowotworu – Nadrodzina TNF i ligandy indukowane przez apoptozę związane z TNF lub TRAIL) z ich poznanymi receptorami śmierci powierzchniowej komórki (takimi jak receptor TNF 1, FAS, receptor TRAIL 1 lub receptor TRAIL 2) (recenzja w ). Po rozpoznaniu ligandu i związaniu się z jego receptorem powstaje szereg kompleksów wewnątrzkomórkowych, które aktywują inicjujące kaspazy (takie jak -8 i -10), które następnie aktywują kaspazy kationowe (takie jak -3, -6 i -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. Interakcja ligand-receptor indukuje montaż kompleksu sygnałowego indukującego śmierć (DISC) w celu promowania aktywacji kaspazy-8, która z kolei jest w stanie aktywować się do wykonawcy kaspazy -3, -6 lub -7, prowadząc do zmian morfologicznych apoptozy. Droga wewnętrzna jest kierowana przez mitochondrialną permeabilizację błony zewnętrznej, która umożliwia uwalnianie elementów proapoptotycznych jako cytochromu-C. cytochrom-C indukuje czynnik aktywujący proteazę apoptozy 1 (Apaf-1) w celu promowania aktywacji kaspazy-9 w celu zmontowania apoptosomu. Apoptosom jest zdolny do aktywacji do kaspaz egzekutora.
wewnętrzny szlak apoptotyczny może być aktywowany przez różne bodźce, w tym uszkodzenie DNA, głód czynnika wzrostu i stres oksydacyjny . Podczas ekspozycji komórek na te bodźce wpływ mają mitochondria, ponieważ kilku członków rodziny Bcl-2 jest aktywowanych i promuje przenikanie błony zewnętrznej mitochondriów (MOMP). Przenikliwa zewnętrzna błona mitochondriów umożliwia uwalnianie cytochromu c (cyt c), który jest związany z białkiem Apaf-1. Związek cyt c i apaf-1 wiąże się następnie z inicjującą kaspazą-9, tworząc kompleks, który stanowi apoptosom, który ma zdolność do aktywacji inicjujących kaspaz, które pełnią swoje funkcje poprzez rozszczepianie określonych substratów komórkowych.
drugi proces śmierci komórki, autofagia, jest genetycznie zaprogramowanym i ewolucyjnie konserwowanym procesem, który powoduje degradację przestarzałych organelli i białek. Jest aktywowany przez takie bodźce zewnątrzkomórkowe, jak głód składników odżywczych, niedotlenienie, wysoka temperatura i zmienione warunki wewnątrzkomórkowe, w tym nagromadzenie uszkodzonych lub zbędnych organelli (recenzja w ).
w organizmach eukariotycznych opisano trzy rodzaje autofagii: mikroautofagię, makroautofagię (potocznie zwaną po prostu autofagią) i autofagię za pośrednictwem opiekuna (ryc. 5). Mikroautofagia obejmuje pochłanianie składników cytoplazmatycznych bezpośrednio na poziomie lizosomu za pomocą procesu invaginacji, podczas gdy makroautofagia pociąga za sobą tworzenie pęcherzyków podwójną błoną, które zawierają składniki komórkowe, które łączą się z lizosomami, tworząc autofagolizosom. Wewnątrz autofagolizosomu dochodzi do degradacji składników wewnątrz pęcherzykowych i, jeśli to możliwe, do recyklingu przez komórkę (recenzja w ). Autofagia z udziałem opiekuna pociąga za sobą wreszcie udział opiekuna w rozpoznawaniu białek wyznaczonych do eliminacji przez lizosomy .

Rysunek 5.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceschematyczne reprezentacje różnych mechanizmów autofagii. Makroautofagia – autofagia-polega na tworzeniu się pęcherzyka o podwójnej błonie, który pochłania zawartość cytoplazmy, która zostanie doprowadzona do lizosomu, który ma zostać zdegradowany. Mikroautofagia charakteryzuje się bezpośrednim pochłanianiem składników cytoplazmatycznych przez lizosom. Proces ten polega na przebudowie błony organelle poprzez utworzenie lizosomalnej błony invagination. Podczas autofagii pośredniczonej przez opiekuna, białka degradowane są kierowane do Hsp70, które z kolei transportują ładunek docelowy do lizosomu.
autofagia jest kierowana przez geny ATG(związane z autofagią), które są wymagane do aktywacji kompleksu sygnałowego, który wyzwala tworzenie autofagosomów . Atggenes zostały odkryte w drożdżach, ale wiele z nich ma ortologi u wyższych eukariotów(ryc. 6). Tworzenie autofagosomu wiąże się z udziałem cytoplazmatycznego białka LC3 (Atg8), które ulega lipidacji przez fosfatydyloetanoloaminę, a następnie jest rekrutowane do powstającej błony autofagosomu (Fig. 7). Akumulacja lipidowanego białka LC3 (znanego jako LC3-II) jest stosowana jako marker autofagii .

Rysunek 6.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns: mml= „http://www.w3.org/1998/Math/MathML ” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink=”http://www.w3.org/1999/xlink” xmlns:mml=”http://www.w3.org/1998/Math/MathML” xmlns:xsi=”http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. Białko LC3 jest lipidowane przez fosfatydyloetanoloaminę.
autofagowa śmierć komórek, lub zaprogramowana śmierć komórek typu II, charakteryzuje się masywnym pochłonięciem cytoplazmy przez pęcherzyki autofagowe. Ta intensywna aktywność autofagiczna różni się znacznie od autofagii, która występuje w sposób ciągły na poziomach podstawnych. Badania ultrastrukturalne u Drosophila ujawniły nagromadzenie autofagicznych wakuoli w większości tkanek larwalnych. Ten typ zaprogramowanej śmierci komórki rozpoczyna się degradacją cytoplazmatycznych organelli przez autofagię, chociaż elementy cytoszkieletu są zachowane do późnych etapów procesu (recenzja w ).
