wprowadzenie
komórki cytotoksyczne są integralną częścią walki z zakażonymi wirusami i komórkami nowotworowymi. Komórki te zabijają poprzez trzy różne szlaki, uwalnianie granulek litycznych, szlak receptora-ligandu Fas lub szlak receptora TRAIL-TRAIL. Na potrzeby niniejszego artykułu skupimy się na degranulacji. Gdy komórka cytotoksyczna napotka komórkę docelową, ściśle przylega do niej, tworząc synapsę immunologiczną. Granulki lityczne są następnie spolaryzowane w kierunku synapsy immunologicznej i uwalniane z komórki cytotoksycznej skierowanej w kierunku celu (1). Granulki te zawierają różne cytotoksyczne mediatory, takie jak perforyna i granzymy. Uwolniona perforyna może tworzyć przejściowe pory w błonie komórki docelowej, umożliwiając granzymom przedostanie się do komórki docelowej. Wejście jest prawdopodobnie również pośredniczone przez oligomery perforyny tworzące niekompletne pory (łuki) (2), a także zasugerowano, że granzymy i perforyna mogą być pobierane do komórek docelowych poprzez szlak endosomalny (3, 4). Dane stojące za tymi proponowanymi mechanizmami zostały ostatnio szczegółowo omówione (5). Gdy granzymy dostają się do komórek docelowych aktywuje się szlak kaspazy, co prowadzi do apoptozy (6, 7). Błona tych cytotoksycznych granulek zawiera glikoproteinę błonową związaną z lizosomami-1 (LAMP1), znaną również jako CD107a (8). Luminalna część CD107a szczura jest przejściowo narażona na pozakomórkową stronę błony komórkowej po degranulacji, zanim zostanie ponownie zinternalizowana. Dlatego barwienie CD107a wskazuje, że doszło do degranulacji (9). Chociaż rola CD107a jest nadal określana, badania siRNA przeciwko CD107a wykazały, że jest ona niezbędna do handlu perforyną w pęcherzykach, ponieważ dostarczanie perforyny do granulek litycznych jest hamowane w przypadku braku CD107a (10). Wykazano również, że CD107a odgrywa rolę w ochronie komórek cytotoksycznych przed śmiercią poprzez wiązanie się z perforyną i zapobieganie insercji do błony komórkowej (11).
istnieją dwa główne typy limfocytów cytotoksycznych, komórki NK (natural killer cells) i komórki T CD8. Oba typy komórek zabijają poprzez uwalnianie granulek litycznych, szlak receptora FAS / ligandu FAS i Szlak receptora TRAIL / TRAIL, ale bodziec niezbędny do aktywacji tych dwóch grup komórkowych jest inny. Komórki T rozpoznają antygen prezentowany przez cząsteczki MHC klasy i poprzez ich aktywujący receptor limfocytów T (TCR), podczas gdy komórki NK rozpoznają antygeny komórek docelowych poprzez różne receptory hamujące i aktywujące. Receptory hamujące są ważne dla zapobiegania zabijaniu zdrowych komórek NK, podczas gdy receptory aktywujące indukują cytotoksyczność komórek NK.
przed zidentyfikowaniem CD107a jako markera degranulacji w komórkach NK (12), wynikiem pomiaru zdolności cytotoksycznej była śmierć komórek docelowych. Wykrycie CD107a za pomocą cytometrii przepływowej pozwoliło naukowcom zidentyfikować specyficzne komórki efektorowe o zdolności cytotoksycznej. Od czasu jego odkrycia ukończono szeroki wachlarz publikacji danych z badań na myszach i ludziach, pokazujących zalety stosowania przeciwciała anty-CD107a. Szczur jest cennym immunologicznym modelem zwierzęcym do badania chorób takich jak białaczka i graft vs. choroba gospodarza (13), ale odczyty funkcjonalne zostały utrudnione przez brak wysokiej jakości swoistych przeciwciał przeciw szczurom CD107a do cytometrii przepływowej. W artykule opisano tworzenie przeciwciał skierowanych przeciwko szczurom CD107a i charakterystykę odpowiedzi degranulacyjnej w komórkach T szczura NK i CD8+.
materiały i metody
Zwierzęta
, MA, USA) zostały umieszczone w Zakładzie Medycyny porównawczej w Rikshospitalet w Szpitalu Uniwersyteckim w Oslo, zgodnie z wytycznymi instytucjonalnymi. Szczepy szczurów PVG-RT1U, PVG-RT7b, PVG-RT1N i PVG-R23 były używane zamiennie i utrzymywane przez ponad 20 pokoleń i trzymane zgodnie z wytycznymi określonymi przez Radę ds. zwierząt doświadczalnych podlegającą Ministerstwu Rolnictwa Norwegii oraz przez Europejską Konwencję o ochronie zwierząt kręgowych wykorzystywanych do celów doświadczalnych i innych celów naukowych. Szczury stosowano w wieku 8-12 tygodni. Pomieszczenia dla zwierząt laboratoryjnych są poddawane rutynowemu programowi monitorowania stanu zdrowia i testowane pod kątem organizmów zakaźnych zgodnie z modyfikacją zaleceń Federation of European Laboratory Animal Science Association. Eksperymenty na zwierzętach były regulowane przepisami laboratoryjnymi, które zostały przedstawione w ustawie o dobrostanie zwierząt, w której Norwegia przestrzega wytycznych UE dotyczących laboratoriów i europejskiej Konwencji laboratoryjnej.
Abs i odczynniki
przeciwciała przeciwko NKp46 , NKR-P1A 3.2.3-PB lub niezwiązany (wiążący tylko NKR-P1A, ale nie NKR-P1B, w szczepie PVG), CD8 (OX8-biotyna), CD2 (OX34, niezwiązany), TCR (R73-Alexa647), allotyp myszy IgD b (tib96-niezwiązany, używany jako izotyp myszy IgG) i CD45.2 (His41-FITC, używany jako izotyp myszy IgG) zostały wykonane w naszym laboratorium i sprzężone zgodnie z do standardowych protokołów. Przeciwciała przeciwko CD3 (IF4, niezwiązane) i jego izotypowi mysi IgM (MM-30, niezwiązane) oraz ormiańskiemu chomikowi IgG isotyp control (HTK88-FITC) zakupiono w Biolegend (San Diego, CA, USA). Komercyjne przeciwciała anty-CD107a zostały zakupione od AbCam (Cambridge, UK) (H4A3-FITC), eBioscience (San Diego, CA, USA) (ID48-PerCP-eFluor) i Lifespan (Seattle, WA, USA) (LS-C8580-unconjugated). LS-C8580 koniugowano z estrem Alexa488 NHS (Sigma-Aldrich, St. Louis, MO, USA) do stosowania w testach funkcjonalnych. Przeciwciała anty-FLAG (m2, niezwiązane) i anty-mysie IgG (goat polyclonal-FITC) zostały zakupione od Sigma-Aldrich (St.Louis, MO, USA). IL-2 otrzymano z dializowanej hodowli komórkowej supernatantu linii komórkowej jajnika chomika chińskiego (CHO) stabilnie transfekowanej konstruktem ekspresji IL-2 szczura. Peridynina-sprzężona z białkiem chlorofilu A (PerCP) streptawidyna, Kontrola poliklonalnego izotypu chomika FITC IgG, Kontrola izotypu myszy FITC IgG1 (MOPC-FITC) i GolgiStop zostały zakupione w BD biosciences (Franklin Lakes, NJ, USA). Koza anty-ormiański chomik (polyclonal-FITC) został zakupiony od Jackson Immunoresearch (West Grove, PA, USA). Supernatanty z hybridomas OX41, CD172a (SIRPa), R73 (anty-rat TCRaß), OX19 (anty-CD5), OX12 (anty-Igk chain) i OX33 (anty-CD45RA) zostały wytworzone we własnym zakresie. Surowica dla chomika kontrolnego pochodzi z nie szczepionych chomików ormiańskich.
klonowanie CD107a szczura
cd107a szczura było amplifikowane PCR z cDNA generowanego z PVG szczura splenocyty i subklonowane do wektora ekspresyjnego pMX zawierającego Gen oporności na puromycynę (hojny dar od dr. Michaela R. Dawsa) (14). Startery CD107 zostały zaprojektowane w oparciu o sekwencję cDNA rat CD107a (LAMP1) (GenBank: Nm_012857). Forward primer: 5′-GCCCAGCACTGTTCGAGGT-3′; reverse primer: 5′-GTTGTCCCCTGTACACACT-3′. W wektorze ekspresyjnym zastosowano anionowy peptyd prowadzący trypsyny-1 (MSALLILALVGAAVA), a oryginalny region transmembrany CD107 został zastąpiony fragmentem TRANSMEMBRANY CD8 w celu ułatwienia ekspresji wysokiej powierzchni. Znacznik flagowy (DYKDDDDK)ligowano do n-terminala białka CD107 w celu wykrycia ekspresji powierzchniowej. Wszystkie wstawione sekwencje i otwarta ramka odczytu w końcowej chimerycznej konstrukcji plazmidowej zostały zbadane i potwierdzone przez sekwencjonowanie DNA Sangera.
transfekcja BWZ.36 komórek z plazmidem pMX-CD107a
komórki 293t zaszczepiono do 6-studzienkowej płytki hodowli komórkowej z 4 ml pożywką RPMI 1640, transfekowano 7,5 µl odczynnika FuGENE6 (Roche, protokół producenta) i inkubowano w 37°C z 5% CO2. Odczynnik FuGENE6 wstępnie rozcieńczono Opti – mem (Gibco) i zmieszano z 1,5 µg plazmidu pMX-CD107a i 1 µg PCL-ECO specyficznego dla gryzoni retrowirusowego plazmidu opakowaniowego (Addgene #12371). Dwadzieścia cztery godziny po transfekcji supernatant odsączono i zastąpiono pożywką RPMI1640 z 2% FBS i przeniesiono do 32°C w celu wytworzenia retrowirusu. Czterdzieści osiem godzin później supernatant zebrano i przesączono filtrem Filtropur s o średnicy 0,2 µm (Sarstedt) i zapisano w temperaturze -80°C do transdukcji retrowirusowej.
105 BWZ.36 komórek zaszczepiono na studzienkę do 24-studzienkowej płytki hodowli komórkowej (Corning) i hodowano świeżą pożywką RPMI1640 z 10% FBS, przez noc. Supernatant usunięto i RPMI1640 zawierający 10% FBS, 16 µg polibrenu (do końcowego stężenia 8 µg / ml) i dodano 1,5 ml supernatantu retrowirusowego i odwirowano w 32°C przy 2400 obr. / min przez 2 godziny. Następnie komórki inkubowano w temperaturze 32°C przez 1 godzinę, po czym supernatant usunięto i zastąpiono świeżym pożywką RPMI1640 z 10% FBS i hodowano przez 3 dni, w temperaturze 37°C z 5% CO2 (w dniu 2 można było użyć pożywki pełnej z 1 ng/ml puromycyny). Ekspandowane transfektanty BWZ. CD107a-FLAG zbadano pod kątem ekspresji powierzchniowej znacznika FLAG, a następnie wykorzystano do immunizacji przeciwciała lub przesiewania przeciwciała.
generowanie Transfektantów z ekspresją CD107a
chimeryczny szczurowy plazmid CD107a transfekowano do komórek CHO. Krótko mówiąc, komórki CHO hodowano w pełnym pożywce RPMI1640 (cRPMI; pożywka RPMI1640 z 10% FBS, 1 mm pirogronianu Na, 50µm 2-merkaptoetanolu), aż osiągnęły 30% zbiegu. 2,5 µg plazmidu zmieszano z 7,5 µl odczynnika Fugenu 6 (Roche) i dodano do komórek kroplami. Dwa dni później komórki CHO odłączono pożywką RPMI1640 uzupełnioną 2 mm EDTA i wysiewano w 96-studzienkowych płytkach do hodowli komórek z płaskim dnem (25 komórek/studzienkę) pożywką selekcyjną (cRPMI uzupełnioną 20 µg/ml puromycyny) w celu klonowania stabilnych transfektantów. Po 10-12 dniach hodowli dorosłe klony przesiewano przeciwciałami anty-FLAG (m2). Do immunizacji użyto jednego z klonów wykazujących najwyższy poziom powierzchniowy FLAG i CD107a.
immunizacja i Fuzja komórek
chomiki ormiańskie w wieku od 3 do 10 tygodni szczepiono wstrzyknięciami dootrzewnowymi (IP) 2 × 106 CHO.CD107a – FLAG komórek raz w tygodniu przez 3 tygodnie. 32 dni po pierwszej immunizacji poddano wzmocnieniu stabilnie transfekowanymi komórkami BWZ.CD107a-FLAG 4 × 106, a surowice analizowano pod kątem barwienia powierzchniowego zarówno CHO.CD107a-FLAG, jak i BWZ.CD107a-TRANSFEKTANTY flagowe. Dwa z trzech zwierząt były dodatnie, a 3 dni po wzmocnieniu komórki śledziony zostały pobrane i połączone od dwóch zwierząt, z których jedno miało powiększenie śledziony. Około 2,0 × 108 komórek śledziony i 1,4 × 108 komórek szpiczaka NS0 przemyto trzy razy w DMEM z dodatkami (1 mm pirogronianu sodu, 0,05 mM 2-merkaptoetanolu i antybiotyku/antymikotycznym) i odwirowano w 90 g przez 10 minut. Trzymając wszystko w temperaturze 37°C od tego punktu do przodu, osad rozpuszczono przez dotknięcie rurki i dodano kropla po kropli wstępnie napełniony glikolem polietylenowym 1500 (Roche), delikatnie mieszając przez 1 min. Trzy mililitry DMEM z dodatkami dodawano stopniowo przez następne 3 minuty, kończąc dodatkowym 7 ml przed odwirowaniem w 500 g. pellet przemyto przez ostrożne płukanie (bez mieszania) DMEM z dodatkami i 20% FBS (DMEM-20) i hodowano przez noc. Komórki zebrano następnego dnia i dodano 100 ml DMEM–20 z 2× hypoxanthine–aminopterin-thymidine (SIGMA) i 10% hybridoma cloning supplement (HCS) (PAA). Zawiesina ogniw została przeniesiona na 96-studzienne płytki. Po 12 dniach supernatanty z rosnących klonów testowano metodą cytometrii przepływowej pod kątem barwienia antygenów powierzchniowych obecnych na BWZ. CD107a-FLAG i CHO.CD107a-FLAG, ale nie na BWZ.36 komórek transfekowanych z nieistotnymi antygenami oznaczonymi znacznikiem jako kontrola negatywna. 9 z 12 pozytywnych klonów wytwarzających specyficzne przeciwciała poddano dalszej subklonacji przy użyciu DMEM-20 uzupełnionego hipoksantyną-tymidyną i HCS. Tylko jeden klon (SIM1) nadal wytwarzał przeciwciała po podklonowaniu, a ten był dalej podklonowany jeszcze raz. Przeciwciała IgG specyficzne dla chomika CD107a zostały wykryte przez FITC anty-ormiański Chomik IgG (Jackson Immunoresearch). Anty-CD107a z hybrydomy SIM1 oczyszczono za pomocą białka HiTrap G HP (GE Healthcare, Life Sciences) i skoniugowano FITC zgodnie ze standardowymi procedurami lub skoniugowano Alexa488 zgodnie z protokołem producenta.
wytwarzanie komórek efektorowych
wytworzono zawiesiny pojedynczych komórek ze śledziony. Limfocyty izolowano za pomocą gradientu Limfoprep, a następnie przepuszczano przez kolumnę z wełny nylonowej w celu usunięcia komórek B i makrofagów. W celu wytworzenia aktywowanych IL-2 komórek NK (LAK) pozostałe komórki hodowano przez noc w IL-2. Następnego dnia komórki nieadhezyjne usunięto przez przemywanie PBS, a przylegające komórki NK utrzymywano w RPMI uzupełnionym IL-2, 10% inaktywowanym termicznie FBS, 1% streptomycyną/penicyliną, 1 mm pirogronianem sodu i 50 µM 2-merkaptoetanolem. Komórki hodowano przez 8-10 dni. W celu wytworzenia wzbogaconych komórek NK lub posortowanych komórek T i NK, komórki wzbogacono przez selekcję negatywną po etapie wełny nylonowej. W celu wzbogacenia komórek NK, Pan-mysi IgG Dynabeads (Invitrogen Dynal) pokryto przeciwciałami przeciwko makrofagom (OX41), komórkom T (R73 i OX19) i komórkom B (OX12 i OX33). W celu wzbogacenia komórek T, Pan-mysie Dynabeady IgG zabarwiono przeciwciałami przeciwko makrofagom (OX41) i komórkom B (OX12 i OX33). Komórki wzbogacono dwoma etapami selekcji negatywowej za pomocą bejcowanych koralików przez 30 minut w temperaturze 4°C. Wzbogacone komórki NK miały czystość około 50-60% i były wykorzystywane do badań degranulacji. Wzbogacone komórki T (czystość 79-85%) posortowano dalej dla komórek TCR+ przy użyciu FACS Aria (BD Biosciences).
testy degranulacji
w celu zmierzenia odpowiedzi degranulacji poprzez barwienie przeciw szczurom CD107a (SIM1) podczas stymulacji komórek docelowych, efektory NK i komórki docelowe YAC inkubowano w stosunku 1 do 1 wynoszącym 3 × 105 komórek / studzienkę (o ile nie zaznaczono inaczej) w nośnikach zawierających SIM1 MAB, inne dostępne na rynku przeciwciała anty-CD107a lub kontrolę izotypu. Aby zmierzyć odpowiedź degranulacyjną na stymulację przeciwciał z komórek NK, użyliśmy płaskich 96-studzienkowych płytek pokrytych różnymi stężeniami anty-Nkp46 (Wen23), anty-NKr-P1A (3.2.3) i kontroli izotypu IgG1 myszy (TIB96). Następnego dnia płytki przemyto PBS i Zablokowano cRPMI przed dodaniem wzbogaconych 3 × 105 komórek NK zawieszonych w cRPMI zawierających SIM1 na studzienkę. Aby zmierzyć degranulację komórek T, posortowano je i hodowano w cRPMI z IL-2 przez 2-3 dni. 96-studzienkowe płytki z płaskim dnem pokryto przez noc przeciwciałami przeciwko CD3 (IF4), CD2 (OX34) lub kontroli izotypu IgM (MM-30). W cRPMI zawierającym SIM1 dodano około 3 × 105 komórek T na studzienkę. Wszystkie testy inkubowano przez 4 godziny. Golgistop dodano przez ostatnie 3 godziny inkubacji, aby zapobiec degradacji zinternalizowanego CD107a. komórki następnie przemyto i zabarwiono przeciwciałami skierowanymi przeciwko odpowiednim receptorom powierzchniowym i przeanalizowano za pomocą FACS Canto lub LSR II (BD Biosciences).
Test uwalniania chromu
komórki docelowe YAC-1 (5 × 106 komórek / ml cRPMI) z dodatkiem 3.7 MBq51Cr inkubowano w temperaturze 37°C przez 1 godzinę, mieszając co 15 minut. Następnie komórki przemyto trzy razy PBS z 2% FBS i zawieszono do 1 × 105 komórek/ml w cRPMI. Komórki efektorowe LAK i komórki docelowe powlekano w określonych proporcjach w końcowej objętości 200 µl. Komórki odwirowywano i inkubowano przez 4 godziny w temperaturze 37°C. specyficzne uwalnianie 51Cr mierzono za pomocą Cobra auto-gamma (Packard).
wyniki
aby wytworzyć przeciwciało przeciwko CD107a, wykonaliśmy wektor ekspresyjny zawierający zewnątrzkomórkowy region błonowy szczura CD107a, region przezbłonowy szczura CD8 i 3 ’ – końcowy znacznik znacznika do wykrywania ekspresji powierzchniowej (Fig. Wektor transfekowano do komórek CHO i BWZ.36 linii komórek T i przebadano ją pod kątem ekspresji CD107a przy użyciu przeciwciała anty-FLAG (m2) (Fig.1B). Cd107a stabilnie transfekowane komórki CHO wstrzykiwano do ormiańskich chomików wsobnych raz w tygodniu przez 3 tygodnie z końcowym wzmocnieniem stabilnie transfekowanych komórek BWZ CD107a na 3 dni przed fuzją z linią komórek szpiczaka NS0. Supernatanty z różnych klonów zostały przetestowane pod kątem specyficzności wobec BWZ. CD107a-FLAG, ale nie bez znaczenia FLAG-tagged BWZ.36 transfektantów. Stwierdzono, że jeden klon, SIM1, wiąże się specyficznie z transfektantem wyrażającym cd107a, ale nie z kontrolą transfekcji FLAG (Fig.1C).

Rysunek 1. Wytwarzanie przeciwciała monoklonalnego CD107a przeciw szczurom (SIM1). A) schematyczna mapa wektorowa wektora ekspresyjnego pMX z peptydem prowadzącym, znacznikiem znacznika, wkładką CD107a i domeną transbłonową CD8. B) stabilnie transfekowany jajnik chomika chińskiego i BWZ.36 komórek zbadano pod kątem ekspresji powierzchniowej komórek cd107a oznaczonego znacznikiem FLAG przy użyciu przeciwciała anty-FLAG (m2) (zacienione histogramy). Kontrola negatywna to samo przeciwciało wtórne (przezroczysty histogram). C) komórki BWZ transfekowane antygenem flagowym CD107a lub antygenem nieistotnym (NKR-P1F-FLAG) zostały zabarwione surowicą kontrolną chomika, supernatantem SIM1 lub przeciwciałem anty-flagowym (m2).
klon SIM1 był dalej testowany w testach funkcjonalnych równolegle z dwoma dostępnymi na rynku przeciwciałami CD107a, które mogły potencjalnie reagować krzyżowo z CD107a szczura w cytometrii przepływowej. Testowane klony przeciwciała to H4A3 z AbCam (który reaguje krzyżowo z ludźmi, szczurami, myszami i naczelnymi w cytometrii przepływowej) oraz klon przeciwciała LS-C8580 z LifeSpan BioSciences (który reaguje krzyżowo z CD107a z myszy, ludzi i szczurów w immunohistochemii i Western blots zgodnie ze stroną internetową producenta). Nasz klon przeciwciała SIM1 zidentyfikował komórki degranulujące w obecności komórek docelowych i wykazał niewielkie zabarwienie tła w przypadku braku celów (górny panel rysunek 2A). Klon H4A3 wybarwiał największy odsetek komórek NK po stymulacji komórek docelowych (panel środkowy). Stwierdzono jednak również wysoki poziom barwienia tła przy braku komórek docelowych, co wskazuje na niespecyficzne Wiązanie. Bardzo niski poziom degranulacji, jeśli w ogóle, był mierzony przez klon LS-c8580 mAb (dolny panel). Swoistość tych przeciwciał potwierdzono przez dodatnie zabarwienie transfektantu BWZ. CD107a-FLAG, ale nie BWZ.NKr-P1F-Kontrola flagi (rys. 2b). Klon przeciwciała h4a3, który, jak wykazano, wiąże się z ludzkim CD107a (16), nie plamił szczurzych komórek BWZ transfekowanych CD107a, co wskazuje na brak reakcji krzyżowej z szczurzym CD107a. klon ID48 przeciwko mysim CD107a również nie plamił szczurzego transfektantu CD107a. Z drugiej strony, niezwiązany LS-C8580 wykazał specyficzne zabarwienie komórek Transfekowanych CD107a (dane nie są pokazane). Jednakże klon LS-C8580 jest dostępny tylko jako niezwiązane przeciwciało, które nie nadaje się do badań degranulacji. Wielokrotne próby w naszym laboratorium koniugacji LS-C8580 do Alexa488 niestety nie dostarczyły żadnych silnych koniugatów barwienia, chociaż niewielka wielkość próbki i stężenie LS-C8580 może być przyczyną słabej koniugacji. Sprzężony LS-C8580 wykazuje zmniejszone, ale specyficzne zabarwienie komórek transfekowanych CD107a (Fig. 2b), ale jak pokazano na fig.2a, nie byliśmy w stanie wykryć komórek degranulujących podczas testów funkcjonalnych z tym koniugatem. Podsumowując, SIM1 MAB specyficznie plami degranulujące komórki NK szczura po stymulacji komórkami docelowymi.

Rysunek 2. SIM1 mierzy degranulację z komórek T natural killer (NK) i CD8. (A) procent komórek degranulujących mierzono przy użyciu przeciwciał anty-CD107a SIM1, H4A3 i LS-C8580, z komórkami docelowymi YAC-1 lub bez nich jako bodźcem. Pokazano jeden reprezentatywny eksperyment z czterech (B). Barwienie linii komórkowej BWZ. CD107a-FLAG klonami przeciwciał SIM1, H4A3, LS-C8580 lub ID48. BWZ.36 komórek transfekowanych antygenem flagowym (BWZ.NKr-P1G-FLAG) włączono jako kontrolę negatywną, (C) wzbogacone komórki NK stymulowano związanymi płytkami anty-nkp46, anty-NKr-P1A lub mysimi IgG1 jako kontrolę izotypu, a SIM1 wykorzystano do pomiaru procentowej degranulacji komórek. Nkp46+ (Wen23) lub NKr-P1 (3.2.3). D) komórki TCR+ posortowano (Czystość 99%) i hodowano w IL-2 przez 2-3 dni. Następnie komórki stymulowano kontrolą izotypu anty-CD3 związanego z płytką i anty-CD2 lub mysim IgM dla anty-CD3. Dolny panel wykazuje stymulację anty-CD3 i anty-CD2 oraz barwienie kontrolą izotypu SIM1 (FITC chomika IgG poliklonal). Komórki T posortowano za pomocą przeciwciał R73-Alexa647 i 3.2.3− PB, gatujących na komórkach R73+/3.2.3. Pokazane dane pochodzą z jednego reprezentatywnego eksperymentu trzech oddzielnych niezależnych eksperymentów.
bezpośrednia stymulacja aktywacji receptorów NK przez przeciwciała związane z płytką jest kolejną skuteczną metodą indukcji degranulacji. Aby przetestować klon SIM1 w tym teście funkcjonalnym, inkubowaliśmy wzbogacone komórki NK na płytkach pokrytych przeciwciałami skierowanymi przeciwko aktywującym receptorom NKp46 i NKr-P1A (Fig.2C). W ramach kontroli negatywnej płyty pokryto mysią kontrolą izotypu IgG1. Barwienie przeciwciałem SIM1 zidentyfikowało 25,5 lub 44% komórek degranulujących po stymulacji komórek NK w płytkach pokrytych odpowiednio 5 µg/ml anty-nkp46 lub anty-NKr-P1A. Odsetek komórek degranulujących wzrósł jeszcze bardziej, gdy płytki były pokryte wyższym stężeniem przeciwciał stymulujących (10 µg/ml). Nie indukowano degranulacji w studzienkach pokrytych mysią kontrolą izotypu IgG1.
wyraźnie widzieliśmy degranulację w komórkach NK stymulowanych komórkami docelowymi lub przeciwciałami przeciwko receptorom aktywacyjnym za pomocą naszego przeciwciała SIM1. Chcieliśmy to również potwierdzić w cytotoksycznych limfocytach T. Komórki T sortowano z komórek śledziony i hodowano w IL-2 przez 2-3 dni. Następnie limfocyty T stymulowano płytkami anty-CD3 i anty-CD2 (Fig. 2D). Degranulację mierzono z hodowanych limfocytów T CD8+ po stymulacji anty-CD3 i anty-CD2 w obu dniach 2 i 3. Nie mierzono degranulacji z niecytotoksycznych limfocytów T CD4 lub po stymulacji przeciwciałem kontrolującym izotyp, co dodatkowo dowodzi swoistości naszego przeciwciała SIM1.
komórki lymphokine-activated killer (Lak) są tworzone przez hodowlę komórek NK W IL-2 przez 7-10 dni i są powszechnie stosowane jako bardzo silne komórki efektorowe w testach uwalniania chromu do badania cytotoksyczności i dlatego powinny być w stanie generować wysoki poziom degranulacji. Aby zmierzyć degranulację z komórek LAK, początkowo użyliśmy 1:1 stosunek efektora do celów, ale stwierdzono nieoczekiwanie niski poziom degranulacji (dane nie pokazano). Jednakże, dokonując miareczkowania w celu znalezienia optymalnych proporcji efektora do docelowego, zauważyliśmy, że wzrost poziomu degranulacji można osiągnąć, gdy stosunek efektora do docelowego wynosił poniżej 1 (ryc. 3A). Optymalny stosunek dla testów degranulacji jest zatem w przeciwieństwie do testów cytotoksyczności, w których poziom cytotoksyczności wzrasta przy wyższych proporcjach efektor: cel (Fig. 3b).
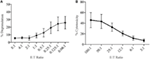
Rysunek 3. Niski efektor:wskaźniki docelowe są ważne dla zapewnienia odpowiedniej czułości w testach degranulacji komórek NK szczurów. A) degranulacja komórek LAK hodowanych 8-10 dni w IL-2 przeciwko celom YAC-1 w różnych proporcjach efektora: cel. B) cytotoksyczność Lak hodowanego IL – 2 przeciwko komórkom docelowym YAC-1 potwierdzono testem uwalniania chromu zakończonym w dniach 8-10. Wszystkie wykresy składają się z trzech lub więcej oddzielnych eksperymentów z paskami pokazującymi SD.
dyskusja
we wstępnym badaniu SIM1 i różnych komercyjnych przeciwciał CD107a w testach degranulacji u szczurów, wybraliśmy mały zakres współczynników efektora do docelowego z odchyleniem w kierunku większej liczby komórek efektorowych niż docelowych w oparciu o aktualną literaturę (12, 16, 17). Stosunek efektora do komórki docelowej może się różnić w zależności od papieru, ale wcześniejsze badania, w których stosunek efektora do komórki docelowej był miareczkowany, wykazały, że optymalna degranulacja z komórek NK myszy osiągnęła szczyt w stosunku 4,5: 1 z komórkami docelowymi YAC-1 (18) i ludzkimi komórkami NK zabiła komórki k562 najlepiej w stosunku 5: 1 lub 10:1 (12). Jednakże, stosując większy zakres współczynników efektora do celu, pokazujemy, że degranulacja przy użyciu komórek szczura LAK była skuteczniej indukowana przy użyciu czterech lub więcej celów na komórkę efektora. Ta różnica w optymalnym stosunku efektor: cel między szczurem a innymi gatunkami może wynikać z rodzaju użytych komórek docelowych, ponieważ w miareczkowaniu stosunku efektor: cel u ludzi i myszy w wyżej wymienionych badaniach wykorzystano komórki docelowe pochodzące od tego samego gatunku. Komórki efektorowe mogą być bardziej wrażliwe na komórki docelowe tego samego gatunku i dlatego potrzebują mniej komórek docelowych do aktywacji. Linia komórek YAC-1 użyta w naszym badaniu to chłoniak z komórek T myszy, który od wielu lat jest standardem w stymulowaniu cytotoksyczności z komórek NK szczura. Nie można wykluczyć, że użycie komórki docelowej szczura spowodowałoby silniejszą stymulację komórek NK, a następnie może być potrzebna mniejsza liczba komórek docelowych do wywołania degranulacji.
z tego badania wynika również, że współczynniki efektora do docelowego stosowane w testach cytotoksyczności nie korelują dobrze ze współczynnikami potrzebnymi do pomiaru optymalnej odpowiedzi degranulacji w komórkach efektorowych. Nie jest to zaskakujące, ponieważ odczyty dla tych dwóch testów są różne, z cytotoksycznością mierzącą śmierć komórki docelowej i degranulacją mierzącą odpowiedź NK na cele.
podsumowując, zebraliśmy przeciwciało przeciwko szczurom CD107a (SIM1) i scharakteryzowaliśmy jego zdolność do wykrywania degranulacji w limfocytach cytotoksycznych u szczurów. Wykazaliśmy, że SIM1 jest specyficzny dla komórek degranulujących i poprzez optymalizację protokołu degranulacji ustaliliśmy, że przy użyciu współczynników effector:cel cell niższych niż 1: 4 zapewniamy optymalną stymulację komórek LAK. Opracowanie anty-szczurzego CD107a (SIM1) umożliwia lepszą analizę i charakterystykę cytotoksycznych odpowiedzi limfocytów szczura i będzie cennym narzędziem w wielu modelach chorób szczura.
Oświadczenie o etyce
badanie zostało zatwierdzone przez Krajowy Urząd ds. badań nad zwierzętami (FDU), Norwegia (numer zezwolenia: ID-1698).
author Contributions
AS był odpowiedzialny za analizę ekspresji, testy funkcjonalne i pisanie manuskryptu. K-ZD przeprowadził klonowanie cDNA i generację transfektantów. JTV było zaangażowane w planowanie i nadzór nad projektem, a także w pisanie rękopisu. LK była odpowiedzialna za szczepienia, technologię hybrydomy, pisanie manuskryptu i nadzór nad projektem.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
autorzy dziękują Ulli Heggelund i Stine Martinsen za pomoc techniczną w laboratorium, a pracownikom zakładu dla zwierząt na Wydziale Medycyny porównawczej w Rikshospitalet, Szpital Uniwersytecki w Oslo za pomoc w szczepieniach. Podziękowania dla Marit Inngjerdingen za dyskusje naukowe.
finansowanie
badania zostały sfinansowane przez Uniwersytet w Oslo, Regional Health w południowo-wschodniej Norwegii (2009104) i Legatet til Henrik Homans Minde.
1. Orange JS. Tworzenie i funkcja synapsy immunologicznej litycznych komórek NK. Nat Rev Immunol (2008) 8(9):713-25. doi: 10.1038/nri2381
PubMed Abstract | CrossRef Full Text/Google Scholar
2. Metkar SS, Marchioretto m, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Pory perforyny w błonie endosomalnej powodują uwalnianie endocytozowanego granzymu B do cytozolu komórek docelowych. Nat Immunol (2011) 12(8):770-7. doi: 10.1038 / ni.2050
PubMed Abstract / CrossRef Full Text / Google Scholar
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens a, Benestad HB, Vaage JT, et al. Drugi profilaktyczny MHC-niedopasowany przeszczep szpiku kostnego chroni przed ostrą białaczką szpikową szczura (bnml) bez śmiertelnej choroby przeszczep przeciwko gospodarzowi. Transplantacja (2008) 85(1):102-11. doi: 10.1097/01.tp.0000296856.53493.1 f
PubMed Abstract | CrossRef Full Text/Google Scholar
14. Onishi m, Kinoshita S,Morikawa Y, Shibuya a, Phillips J, Lanier LL, et al. Zastosowania klonowania ekspresji za pośrednictwem retrowirusa. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Zmniejszona degranulacja komórek NK u pacjentów z często nawracającą opryszczką. Klin Szczepionka Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO i in. Analiza funkcjonalna ludzkich komórek NK metodą cytometrii przepływowej. Metody Mol Biol (2010) 612: 335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
