angiotensyna II powoduje wzrost ciśnienia krwi poprzez działanie w różnych miejscach:
- nadnercza: angiotensyna II zwiększa uwalnianie hormonu steroidowego aldosteronu, który działa miejscowo w celu zwiększenia retencji sodu i wydzielania potasu z nerek. Efektem netto jest retencja wody, przywracając w ten sposób równowagę płynów.
- : Angiotensyna II zwiększa również retencję sodu poprzez bezpośrednie działanie na kanaliki proksymalne nerek, a także wpływa na szybkość przesączania kłębuszkowego i nerkowy przepływ krwi.
- układ sercowo-naczyniowy: angiotensyna II jest silnym endogennym środkiem zwężającym naczynia krwionośne, powodując zwężenie tętnic i żył oporowych, podnosząc ciśnienie krwi. Ponadto, zarówno w naczyniach krwionośnych, jak i w sercu, przedłużające się zwiększenie stężenia angiotensyny II pobudza wzrost komórek i wynikający z tego przerost.
- ośrodkowy układ nerwowy: W mózgu angiotensyna II działa na tylny płat przysadki mózgowej, stymulując uwalnianie hormonu antydiuretycznego (Adh, znanego również jako wazopresyna argininy (AVP)). ADH zwiększa wchłanianie zwrotne wody w przewodach nerkowych. Angiotensyna II działa również na narząd podpajęczynówkowy w mózgu, powodując zwiększone pragnienie, zachęcając do spożycia wody.
przewlekła aktywacja układu RAAS może prowadzić do szkodliwej przebudowy i zwiększonego stanu zapalnego serca, naczyń krwionośnych i nerek, a także nadciśnienia tętniczego i przewlekłej choroby nerek.
neuronowa kontrola układu sercowo-naczyniowego
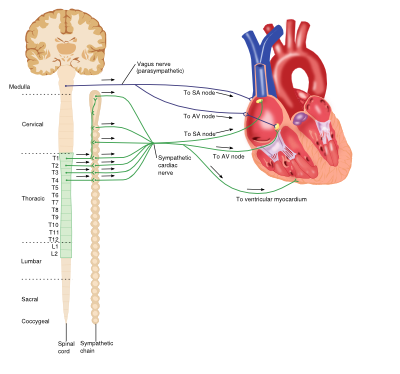
współczulny (adrenergiczny) układ nerwowy
układ nerwowy adrenergiczny jest ważnym elementem wielu procesów w organizmie, w tym układu sercowo-naczyniowego. Krążące katecholaminy (np. adrenalina i noradrenalina) wiążą się i aktywują receptory adrenergiczne na błonach komórkowych. Receptory adrenergiczne są klasą receptorów sprzężonych z białkiem G, które wywołują różne efekty specyficzne dla tkanek i występują w kilku podtypach.
unaczynienie
dominującym receptorem obecnym w naczyniach krwionośnych jest receptor A1-adrenergiczny, którego aktywacja przez wiązanie katecholamin powoduje aktywację wewnątrzkomórkowego szlaku sygnałowego fosfolipazy C (PLC), trójfosforanu inozytolu (IP3), diacyloglicerolu (DAG). Powoduje to ostatecznie skurcz miocytów, skurcz naczyń krwionośnych i w konsekwencji wzrost ogólnoustrojowego ciśnienia krwi.
Serce
chociaż serce jest miogeniczne, czyli impuls do skurczu jest samoczynny, na wyjście serca wpływa ośrodkowy układ nerwowy. Efektem netto układu współczulnego na serce jest zwiększenie pojemności minutowej serca. Receptory adrenergiczne znajdujące się w sercu należą do podrodziny receptorów ß i obejmują receptory ß1 i ß3. Wiązanie katecholaminy z receptorami ß1 w sercu powoduje zwiększenie pojemności minutowej serca poprzez szereg mechanizmów: pozytywne efekty chronotropowe, pozytywne efekty inotropowe zwiększały automatyczność i przewodzenie zarówno w miocytach komorowych, jak i węźle przedsionkowo-komorowym (AV). Jednakże aktywacja receptora ß3 antagonizuje te działania, wywołując negatywny efekt inotropowy i zapewniając wbudowany system kontroli w sercu.
długotrwały wzrost poziomu katecholamin w krążeniu (np. w przypadku wydzielania z guzów nadnerczy lub w czasie stresu) może prowadzić do przewlekłych problemów sercowo-naczyniowych, takich jak nadciśnienie tętnicze i zaburzenia rytmu serca.
przywspółczulny układ nerwowy
układ przywspółczulny opiera się na wiązaniu acetylocholiny neuroprzekaźnika (Ach) z receptorami muskarynowymi i ma różne role w całym organizmie.
unaczynienie
chociaż naczynia krwionośne wykazują ekspresję receptorów muskarynowych, nie otrzymują unerwienia cholinergicznego; jednak zastosowanie egzogennego Ach powoduje szybkie i głębokie rozszerzenie naczyń krwionośnych.
Serce
aktywacja receptorów muskarynowych (Podtyp m2) w sercu przez Ach uwolniony z nerwu błędnego powoduje zmniejszenie pojemności minutowej serca poprzez działanie przeciwne do stymulacji adrenergicznej: negatywne działanie chronotropowe i zmniejszenie przewodzenia węzła AV, a także zmniejszenie siły skurczów przedsionków.
układ płytek/krzepnięcia
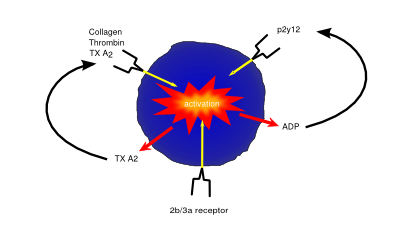
płytki krwi (znane również jako trombocyty) to małe komórki pozbawione jąder odpowiedzialnych za hemostazę lub krzepnięcie krwi. Wykrywa się uszkodzenia lub uszkodzenia prowadzące do utraty krwi i ekspozycji zewnątrzkomórkowych włókien kolagenowych, aktywując płytki krwi. Po aktywacji płytki stają się przylepne, przyklejając się zarówno do uszkodzonej ściany naczynia, jak i do siebie nawzajem, tworząc kępę komórek lub „skrzep”, pomagając zapuścić przeciek naczynia. Następnie zaczynają wydzielać cytokiny, które zachęcają do inwazji fibroblastów obecnych w otaczającej tkance, które tworzą bardziej trwały plaster, albo tworząc zdrową tkankę, albo odkładając macierz zewnątrzkomórkową, tworząc bliznę.
istnieje kilka stanów, w których nieprawidłowe krzepnięcie może być szkodliwe dla organizmu; nadmierne krzepnięcie może prowadzić do zablokowania naczyń i niedokrwienia lub udaru; rzadziej niedobór krzepnięcia może prowadzić do nadmiernej utraty krwi, na przykład w hemofilii. Aby zwalczyć te choroby, istnieją leki, które modulują proces krzepnięcia.
leki przeciwzakrzepowe
leki zapobiegające krzepnięciu (leki przeciwzakrzepowe) są ważne u osób ze zwiększonym ryzykiem uszkodzenia spowodowanego krzepnięciem, takiego jak udar lub niedokrwienie.
Aspiryna, jako środek przeciwbólowy i przeciwgorączkowy, jest lekiem przeciwzakrzepowym podawanym w małych dawkach osobom zagrożonym uszkodzeniem w wyniku krzepnięcia (np. po zawale serca). Działanie antykoagulacyjne aspiryny wynika z tłumienia kluczowych czynników krzepnięcia, takich jak prostaglanding i tromboksany, poprzez nieodwracalną inaktywację enzymu cyklooksygenazy PTGS. Hamowanie czynników takich jak tromboksan A2 zmniejsza agregację płytek krwi, a tym samym zapobiega tworzeniu się skrzepów.
inhibitory P2Y12, takie jak klopidogrel, wywierają działanie przeciwzakrzepowe poprzez hamowanie podtypu p2y12 płytkowego receptora ADP. Blokując P2Y12, leki te zapobiegają aktywacji płytek krwi i tworzeniu sieci fibryny potrzebnej do krzepnięcia.
leki takie jak abcysymab i tyrofiban zapobiegają krzepnięciu poprzez hamowanie receptora glikoproteiny IIb/IIIa, zapobiegając zarówno aktywacji płytek, jak i agregacji.
farmakokinetyka
podczas podawania leku pacjentowi ważne jest poznanie kilku faktów na temat leku w celu maksymalizacji skuteczności i zminimalizowania skutków ubocznych/toksyczności. Obejmują one informacje o tym, jaka dawka jest skuteczna, jak długo lek pozostaje aktywny w organizmie, jak szybko jest rozkładany/usuwany z organizmu i jak łatwo organizm może wchłonąć/użyć tego leku. W poniższej tabeli wyszczególniono te właściwości farmakokinetyczne i sposób ich obliczania:
| właściwość | opis | jednostki Standardowe (Skrót) | wzór |
|---|---|---|---|
| dawka | ilość aktywnego leku podana pacjentowi | mg (D) | specyficzny dla leku (z badań klinicznych) |
| stężenie | ilość leku w danej objętości osocza | µg/ml (c) | = D / vd |
| EC50 | stężenie leku potrzebne do wywołania odpowiedzi w połowie drogi między odpowiedzią zerową a maksymalną. | µg/ml (EC50) | y = bottom + (Top-Bottom)/(1+ Hill Coefficient) |
| objętość dystrybucji | teoretyczna objętość leku zajmowałaby się w przypadku równomiernego rozłożenia w tkankach w celu uzyskania obecnego stężenia w osoczu. | L (Vd) | D / C |
| stała eliminacji (szybkość) | szybkość, z jaką lek jest usuwany z organizmu. | H-1 (Ke) | ln(2) / t1/2 lub CL / Vd |
| biodostępność | ile podanej dawki jest dostępnych do rzeczywistego użycia przez organizm. | brak jednostek wyrażających ułamek (f) | 100 × (AUC (po)×d (iv))/(AUC (iv)×d (Po))
AUC = pole pod krzywą po = Podanie doustne iv = podanie dożylne |
| Cmax lub Cmin | maksymalne (Cmax)/Minimalne (Cmin) stężenie leku w osoczu osiągane po podaniu leku | µg/ml (Cmax lub Cmin) | zidentyfikowane poprzez bezpośredni pomiar stężenia c w osoczu |
| tmax | czas potrzebny do osiągnięcia Cmax leku po podaniu | h (Tmax) | zidentyfikowane poprzez bezpośredni pomiar stężenia c w osoczu po podaniu czas |
| okres półtrwania | czas potrzebny do osiągnięcia połowy pierwotnego stężenia leku | h (t1/2) | ln(2) / Ke |
| klirens leku | objętość osocza oczyszczonego z leku w ustalonym czasie | l/H (CL) | vd x ke Lub d / pole pod krzywą |
częste interakcje między lekami
ważne jest, aby mieć świadomość interakcji, które mogą wystąpić między jednocześnie podawanymi lekami, ponieważ mogą one wpływać na skuteczność i (lub) toksyczność lub powodować niepożądane skutki uboczne efekty. Takie interakcje mogą na przykład wpływać na wchłanianie leku, jego biodostępność lub skuteczność, lub łączyć się w celu wytworzenia niepożądanych metabolitów, a także mieć wpływ na analizy kliniczne. Jeśli połączenie dwóch leków zmniejsza efekt jednego lub obu z nich, interakcja jest określana jako efekt antagonistyczny; jednak jeśli, odwrotnie, kombinacja dwóch leków zwiększa efekt jednego lub obu z nich, interakcja jest określana jako efekt synergistyczny. Leki działające na układ sercowo-naczyniowy mają wysoką interaktywność, co jest problemem, ponieważ pacjenci z chorobami układu sercowo-naczyniowego zwykle otrzymują więcej niż jeden lek. Niektóre typowe interakcje lek-lek związane z lekami sercowo-naczyniowymi są wymienione poniżej:
| Drug | Drugs that drug action | Drugs that ↓ drug action |
|---|---|---|
| Digoxin |
|
|
| Warfarin |
|
|
| Klopidogrel |
|
|
| Furosemide |
|
|
| ACE Inhibitors |
|
|
| ß-blockers |
|
|
| statyny |
|
|
istnieje kilka mechanizmów, za pomocą których leki są rozkładane przez organizm, zwykle poprzez degradację przez enzymy. Jedną z powszechnych rodzin enzymów biorących udział w metabolizmie leków jest rodzina cytochromu P450 (CYP); duża, zróżnicowana grupa enzymów, które zachęcają do utleniania różnych substratów, zarówno endogennych (np. hormony steroidowe) i egzogenne (np. toksyny i leki). Enzymy CYP stanowią do 75% metabolizmu leków, wspomagając niektóre leki w tworzeniu ich aktywnych związków, ale głównie dezaktywując leki w nieaktywne metabolity, które mają zostać wydalone. Enzymy CYP mogą wpływać na działanie leku na kilka sposobów; mogą zwiększać metabolizm leku (albo zwiększać działanie poprzez tworzenie aktywnego produktu ubocznego, albo zmniejszać działanie poprzez metabolizm aktywnego leku) lub ich działanie może być hamowane przez leki, które konkurują o dostęp do miejsca aktywnego enzymu CYP, zapobiegając normalnej interakcji między lekiem a enzymem. Wiele leków wywiera interakcje z innymi lekami poprzez interakcję z systemem CYP. Na przykład, jeśli lek a jest metabolizowany przez CYP, a lek B hamuje aktywność CYP, jednoczesne podawanie spowoduje zmniejszenie biodostępności leku A. u ludzi istnieje 18 rodzin i 43 podrodziny enzymów z grupy CYP, które są ukierunkowane na różne substraty. Niektóre enzymy CYP ważne w medycynie sercowo-naczyniowej, ich substraty sercowo-naczyniowe i niektóre z ich interakcji przedstawiono w poniższej tabeli:
| enzymy | substraty (np.) | inhibitory (np.) | induktory (np.) |
|---|---|---|---|
| CYP2C19 |
|
|
|
| CYP3A4 |
|
|
|
| CYP2C9 |
|
|
|
| CYP2D6 |
|
|
|
oprócz interakcji między lekami, na działanie wielu leków wpływa również jedzenie lub picie. Na przykład należy zachować ostrożność podczas spożywania alkoholu z wieloma rodzajami leków, ponieważ może to spowodować stres w wątrobie, która już ciężko pracuje, aby metabolizować leki w organizmie. Sok grejpfrutowy również może powodować problemy, ponieważ wiadomo, że hamuje CYP3a. aby uzyskać więcej informacji na temat interakcji między lekami a jedzeniem / napojami, zobacz ten przewodnik: Ogólne zastosowanie medycyny
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio a, Böhm m, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T, Køber L, Lip GY, Maggioni AP, Parkhomenko a, Pieske BM, Popescu BA, Rønnevik PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J, Trindade PT, voors AA, zannad f, Zeiher A oraz Komitet ESC ds. wytycznych dotyczących praktyki.. Wytyczne ESC w diagnostyce i leczeniu ostrej i przewlekłej niewydolności serca 2012: Grupa Zadaniowa ds. diagnostyki i leczenia ostrej i przewlekłej niewydolności serca 2012 Europejskiego Towarzystwa Kardiologicznego. Opracowany we współpracy ze Stowarzyszeniem niewydolności serca (HFA) ESC. Eur Heart J. 2012 Jul;33(14):1787-847. DOI: 10.1093/eurheartj | ehs104 / PubMed ID:22611136
- Rydén L, Standl E, Bartnik M, Van den Berg g, Betteridge J, de Boer MJ, Cosentino F, йенссон b, M. Laakso, Malmberg K, Priori S, Ostergren J, Tuomilehto J, Thrainsdottir I, Vanhorebeek I, Stramba-Badiale M, Lindgren P, Qiao Q, Priori SG, Blanc JJ, Budaj A, Camm J, Dean V, Deckers J, дикстейн K, Lekakis J, McGregor K, Metra M, Morais J, Osterspey A, Tamargo J, Саморано JL, Deckers JW, Bertrand M, B Charbonnel, Erdmann E, Ferrannini E, Flyvbjerg A, Gohlke H, Juanatey JR, Graham I, Монтейру PF, Parhofer K, Pyörälä K, Raz I, Schernthaner G, Volpe M, Wood D, Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC)., oraz European Association for the Study of Diabetes (EASD).. Wytyczne dotyczące cukrzycy, chorób przedcukrzycowych i chorób układu krążenia: streszczenie. Grupa Zadaniowa ds. cukrzycy i chorób sercowo-naczyniowych Europejskiego Towarzystwa Kardiologicznego (ESC) oraz Europejskiego Stowarzyszenia Badań nad cukrzycą (EASD). Eur Heart J. 2007 Jan; 28 (1): 88-136. DOI: 10.1093/eurheartj | ehl260 / PubMed ID:17220161
- Perk J, De Backer G, Gohlke H, Graham i, Reiner z, Verschuren M, Albus C, Benlian P, Boysen G, Cifkova R, Deaton C, Ebrahim S, Fisher M, Germano G, Hobbs R, Hoes a, Karadeniz S, Mezzani a, Prescott E, Ryden L, Scherer M, Syvänne m, Scholte op Reimer WJ, Vrints C, wood d, ZAMORANO JL, zannad F, European Association for Cardiovascular Prevention & Rehabilitacja (Eacpr)., oraz Komitet ESC ds. wytycznych dotyczących praktyki (CPG).. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). Piąta wspólna grupa zadaniowa Europejskiego Towarzystwa Kardiologicznego i innych towarzystw ds. profilaktyki chorób układu krążenia w praktyce klinicznej (złożona z przedstawicieli dziewięciu towarzystw i zaproszonych ekspertów). Eur Heart J. 2012 Jul;33(13):1635-701. DOI:10.1093/eurheartj | ehs092/PubMed ID: 22555213
- Grupa Zadaniowa ds. leczenia ostrego zawału mięśnia sercowego z uniesieniem odcinka ST Europejskiego Towarzystwa Kardiologicznego (ESC)., Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati a, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli m, van 't Hof a, Widimsky P, and Zahger D. Postępowanie w ostrym zawale mięśnia sercowego u pacjentów z uniesieniem odcinka st. Eur Heart J. 2012 Oct;33(20):2569-619. DOI: 10.1093 / eurheartj / ehs215 / PubMed ID:22922416
- Blomström-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, Camm AJ, Campbell WB, Haines DE, Kuck KH, Lerman BB, Miller DD, Shaeffer CW Jr, Stevenson WG, Tomaselli GF, Antman EM, Smith SC Jr, Alpert JS, Faxon DP, Fuster V, Gibbons RJ, Gregoratos G, Hiratzka LF, Hunt sa, Jacobs ak, Russell ro Jr, priori SG, Blanc JJ, Budaj a, Burgos EF, Cowie m, Deckers JW, Garcia ma, Klein ww, Lekakis J, Lindahl B, Mazzotta G, Morais JC, oto a, smiseth o, Trappe HJ, American College of Cardiology., American Heart Association Task Force on Practice Guidelines., oraz European Society of Cardiology Committee for Practice Guidelines. Komitet pisemny do opracowania wytycznych dotyczących postępowania z pacjentami z Nadkomorowymi zaburzeniami rytmu serca.. ACC/AHA / ESC guidelines for the management of patients with supraventricular arrhythias–executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythias). Krążenie. 2003 Oct 14;108(15):1871-909. DOI: 10.1161/01.CIR.0000091380.04100.84 / PubMed ID:14557344
- Europejskie Stowarzyszenie profilaktyki chorób układu krążenia & Rehabilitacja., Reiner z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, Agewall S, Alegria E, Chapman MJ, Durrington P, Erdine s, Halcox J, Hobbs R, Kjekshus J, Filardi PP, Riccardi G, Storey RF, Wood D, and ESC Committee for Practice Guidelines (CPG) 2008-2010 and 2010-2012 Committee.. Wytyczne ESC/EAS dotyczące postępowania z dyslipidemiami: Grupa Zadaniowa ds. zarządzania dyslipidemiami Europejskiego Towarzystwa Kardiologicznego (ESC) i Europejskiego Towarzystwa miażdżycy (EAS). Eur Heart J. 2011 Jul;32(14):1769-818. DOI:10.1093/eurheartj | ehr158/PubMed ID: 21712404
wszystkie abstrakty Medline: PubMed
