elektroujemność i polaryzacja wiązania
chociaż zdefiniowaliśmy wiązanie kowalencyjne jako współdzielenie elektronów, elektrony w wiązaniu kowalencyjnym nie zawsze są dzielone równo przez dwa połączone Atomy. Jeśli Wiązanie nie łączy dwóch atomów tego samego pierwiastka, zawsze będzie jeden atom, który przyciąga elektrony w wiązaniu silniej niż drugi atom, jak pokazano na rysunku 4.3 „Polarne kontra niepolarne wiązania kowalencyjne”. Gdy zachodzi taka nierównowaga, powstaje nagromadzenie pewnego ładunku ujemnego (zwanego częściowym ładunkiem ujemnym i oznaczonego δ−) Po jednej stronie wiązania i pewnego ładunku dodatniego (oznaczonego δ+) po drugiej stronie wiązania. Wiązanie kowalencyjne, które ma nierówny podział elektronów, jak w części (b) rysunku 4.3 „Polarne kontra niepolarne wiązania kowalencyjne”, nazywa się polarnym wiązaniem kowalencyjnym wiązanie kowalencyjne z niezrównoważonym rozkładem elektronów w wiązaniu.. Wiązanie kowalencyjne, które ma równy podział elektronów (część (A) z fig.4.3 „Polarne kontra niepolarne wiązania kowalencyjne”) nazywa się niepolarnym wiązaniem kowalencyjnym o zrównoważonym rozkładzie elektronów w całym wiązaniu..
rysunek 4.3 Polarne kontra niepolarne wiązania kowalencyjne
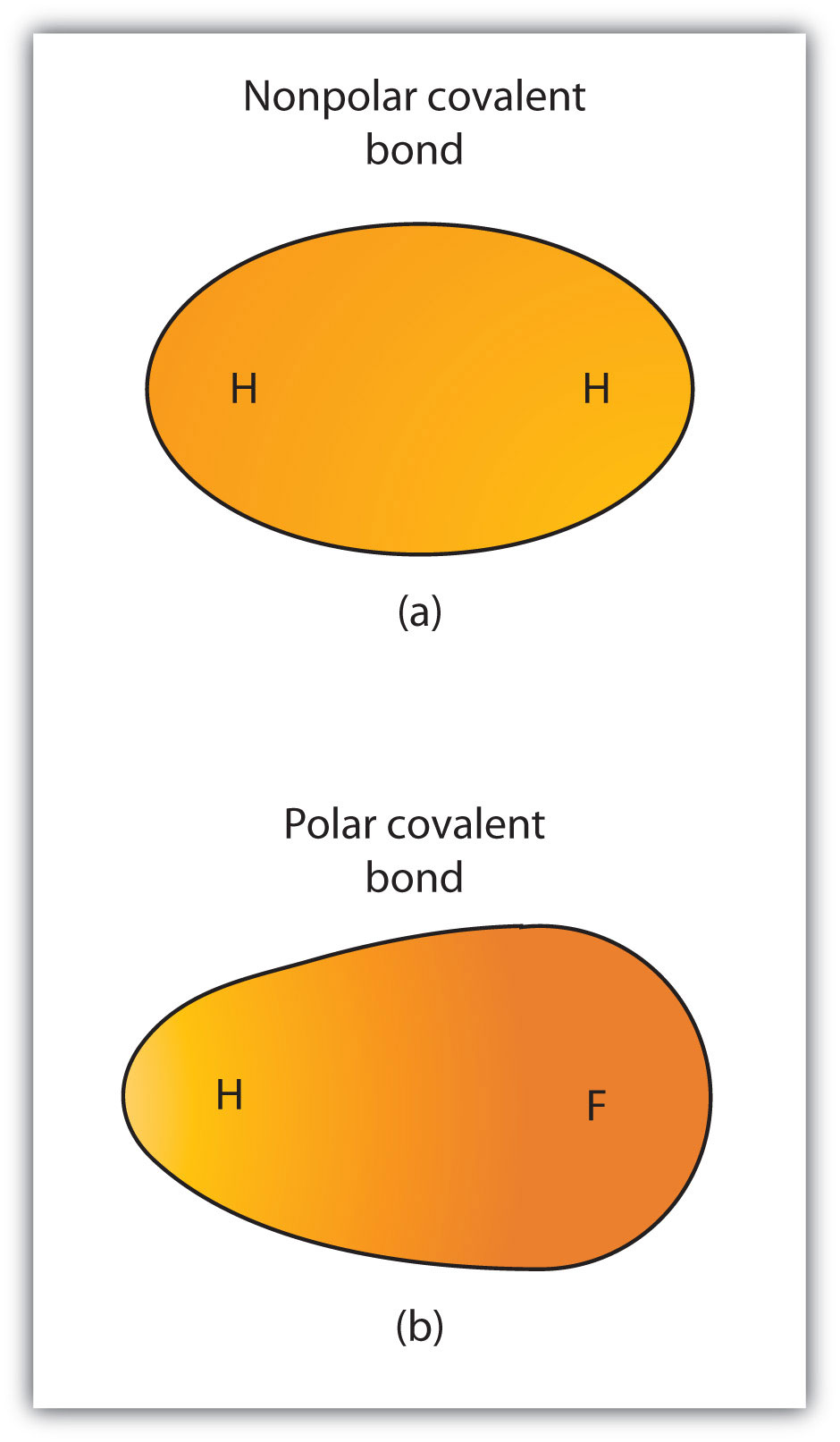
(a) elektrony w wiązaniu kowalencyjnym są równo dzielone przez oba atomy wodoru. Jest to niepolarne wiązanie kowalencyjne. (b) atom fluoru przyciąga elektrony w wiązaniu bardziej niż atom wodoru, co prowadzi do nierównowagi w rozkładzie elektronów. To jest polarne wiązanie kowalencyjne.
każde wiązanie kowalencyjne między atomami różnych pierwiastków jest wiązaniem polarnym, ale stopień polaryzacji jest bardzo zróżnicowany. Niektóre wiązania między różnymi elementami są tylko minimalnie polarne, podczas gdy inne są silnie polarne. Wiązania jonowe można uznać za najwyższą polaryzację, przy czym elektrony są przenoszone, a nie dzielone. Aby ocenić względną polaryzację wiązania kowalencyjnego, chemicy używają elektroenergetycznościwłaściwej miary tego, jak silnie atom przyciąga elektrony, gdy tworzy wiązanie kowalencyjne., co jest względną miarą tego, jak silnie atom przyciąga elektrony, gdy tworzy wiązanie kowalencyjne. Istnieją różne skale numeryczne dla elektroujemności ratingowej. Rysunek 4.4 „elektroujemność różnych elementów” pokazuje jedną z najbardziej popularnych-skalę Paulinga. Polaryzację wiązania kowalencyjnego można ocenić określając różnicę elektroujemności dwóch atomów tworzących Wiązanie. Im większa różnica elektroujemności, tym większa nierównowaga podziału elektronów w wiązaniu. Chociaż nie ma twardych i szybkich reguł, ogólna zasada jest taka, że jeśli różnica elektroujemności jest mniejsza niż około 0,4, Wiązanie jest uważane za niepolarne; jeśli różnica jest większa niż 0,4, Wiązanie jest uważane za polarne. Jeśli różnica elektroujemności jest wystarczająco duża (na ogół większa niż około 1,8), powstały związek jest uważany za jonowy, a nie kowalencyjny. Różnica elektroujemności zerowa, oczywiście, wskazuje na niepolarne wiązanie kowalencyjne.
Rysunek 4.4 elektroujemność różnych pierwiastków
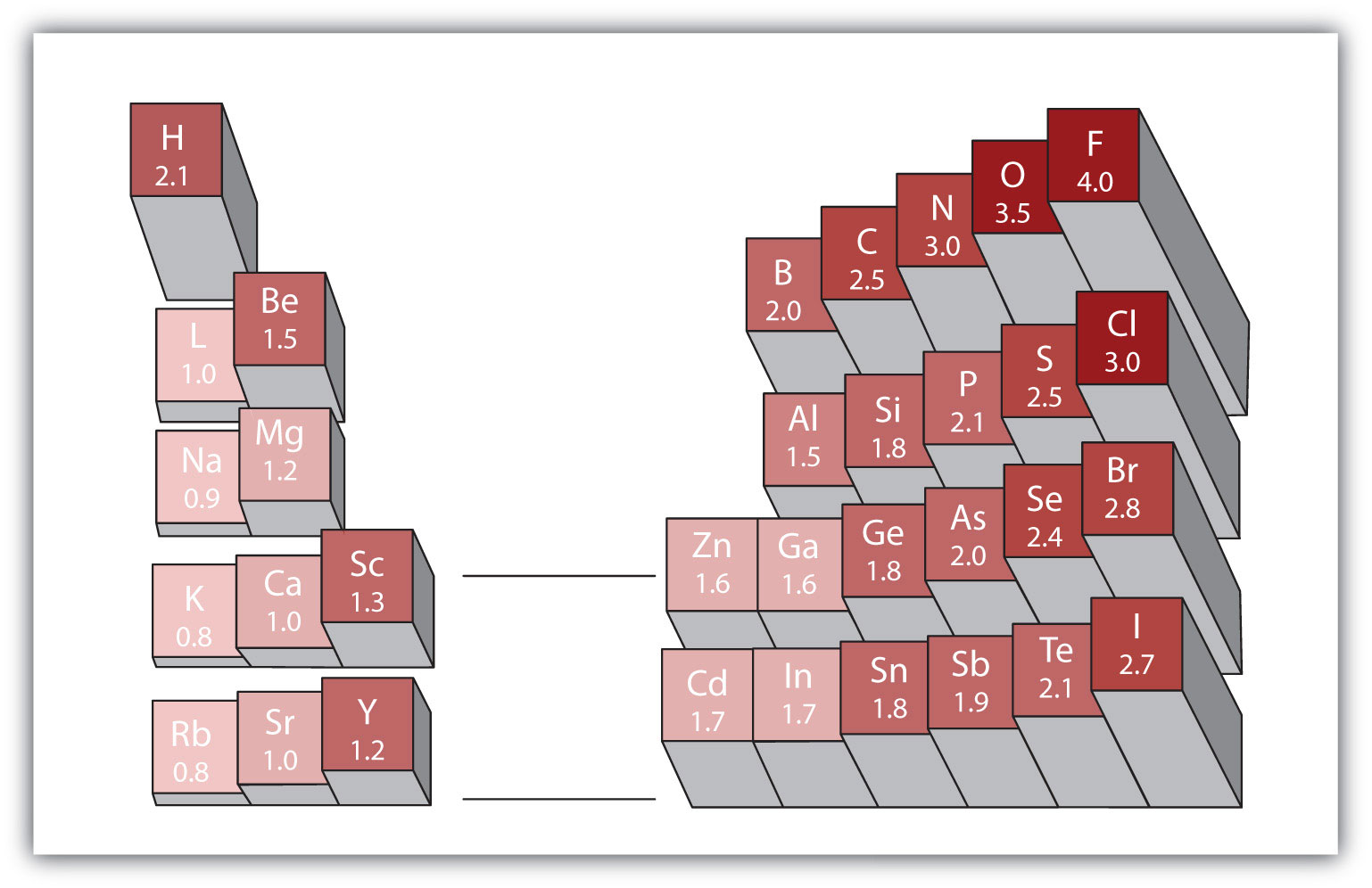
popularna skala elektroujemności ma wartość dla atomów fluoru ustawioną na 4,0, najwyższą wartość.
przyglądając się bliżej: Linus Pauling
prawdopodobnie najbardziej wpływowy chemik XX wieku, Linus Pauling (1901-1994) jest jedyną osobą, która zdobyła dwie indywidualne (tj. nieujawnioną) Nagrody Nobla. W latach 30. Pauling wykorzystał nowe teorie matematyczne do sformułowania podstawowych zasad wiązania chemicznego. Jego książka z 1939 the Nature of the Chemical Bond jest jedną z najważniejszych książek kiedykolwiek opublikowanych w chemii.
w 1935 roku Pauling zainteresował się cząsteczkami biologicznymi, a w 1954 roku otrzymał Nagrodę Nobla w dziedzinie chemii za pracę nad strukturą białek. (Był bardzo bliski odkrycia struktury podwójnej helisy DNA, kiedy James Watson i James Crick ogłosili własne odkrycie jej struktury w 1953 roku.) Został później uhonorowany Pokojową Nagrodą Nobla w 1962 roku za wysiłki na rzecz zakazu testowania broni jądrowej.
w późniejszych latach Pauling był przekonany, że duże dawki witaminy C zapobiegną chorobom, w tym przeziębieniom. Większość badań klinicznych nie wykazała związku, ale Pauling nadal przyjmował duże dawki dziennie. Zmarł w 1994 roku, przez całe życie ustanawiając naukowe dziedzictwo, które niewielu będzie miało sobie równych.

Linus Pauling był jednym z najbardziej wpływowych chemików XX wieku.
przykład 6
opisuje różnicę elektroujemności między każdą parą atomów a wynikającą z tego polaryzacją (lub rodzajem wiązania).
- C i H
- H I H
- Na I Cl
- O I H
roztwór
- węgiel ma elektroujemność 2,5, podczas gdy wartość dla wodoru wynosi 2,1. Różnica wynosi 0,3, co jest raczej niewielkie. Wiązanie C-H uznaje się zatem za niepolarne.
- oba atomy wodoru mają tę samą wartość elektroujemności-2.1. Różnica wynosi zero, więc wiązanie jest niepolarne.
- elektroujemność sodu wynosi 0,9, natomiast chloru 3,0. Różnica wynosi 2,1, co jest dość wysokie, a więc sód i chlor tworzą związek jonowy.
- przy 2.1 Dla wodoru i 3.5 dla tlenu, różnica elektroujemności wynosi 1.4. Spodziewalibyśmy się wiązania bardzo polarnego, ale nie tak polarnego, że Wiązanie O-H jest uważane za jonowe.
ćwiczenie budowania umiejętności
-
c I O
-
K I Br
-
N I N
-
Cs I f
Opisuj różnicę elektroujemności między każdą parą atomów a wynikającą z tego polaryzacją (lub rodzajem wiązania).
gdy wiązania cząsteczki są polarne, cząsteczka jako całość może wykazywać nierównomierny rozkład ładunku, w zależności od tego, jak poszczególne wiązania są zorientowane. Na przykład orientacja dwóch wiązań O-H w cząsteczce wody (rysunek 4.5 „Właściwości fizyczne i polaryzacja”) jest wygięta: jeden koniec cząsteczki ma częściowy ładunek dodatni, a drugi koniec ma częściowy ładunek ujemny. Krótko mówiąc, sama cząsteczka jest polarna. Polaryzacja wody ma ogromny wpływ na jej właściwości fizyczne i chemiczne. (Na przykład temperatura wrzenia wody jest wysoka dla tak małej cząsteczki i wynika z faktu, że cząsteczki polarne silnie się przyciągają.) W przeciwieństwie do tego, podczas gdy dwa wiązania C = O W dwutlenku węgla są polarne, leżą naprzeciwko siebie i tak anulują wzajemnie swoje efekty. Tak więc cząsteczki dwutlenku węgla są niepolarne ogólnie. Ten brak polaryzacji wpływa na niektóre właściwości dwutlenku węgla. (Na przykład dwutlenek węgla staje się gazem w temperaturze -77°c, prawie 200° poniżej temperatury, w której gotuje się woda.)
rysunek 4.5 Właściwości fizyczne i polaryzacja

na właściwości fizyczne wody i dwutlenku węgla mają wpływ ich polaryzacje.
Concept Review Exercises
-
jak nazywa się odległość między dwoma atomami w wiązaniu kowalencyjnym?
-
co wskazuje elektroujemność atomu?
-
Jaki rodzaj wiązania powstaje między dwoma atomami, jeśli różnica elektroujemności jest niewielka? Średni? Duży?
odpowiedzi
-
długość wiązania
-
elektroujemność jest jakościową miarą tego, jak bardzo atom przyciąga elektrony w wiązaniu kowalencyjnym.
-
niepolarne; polarne; jonowe
najważniejsze informacje
- wiązania kowalencyjne między różnymi atomami mają różną długość wiązania.
- wiązania kowalencyjne mogą być polarne lub niepolarne, w zależności od różnicy elektroujemności między zaangażowanymi atomami.
ćwiczenia
-
co jest dłuższe—Wiązanie C–H czy Wiązanie C–O? (Patrz tabela 4.2 „przybliżone długości wiązań niektórych pojedynczych wiązań”.)
-
która jest krótsza—Wiązanie N–H czy Wiązanie C–H? (Patrz tabela 4.2 „przybliżone długości wiązań niektórych pojedynczych wiązań”.)
-
Nanometr wynosi 10-9 m. wykorzystując dane z tabeli 4.2 „przybliżone długości wiązań niektórych pojedynczych wiązań” i Tabeli 4.3 „porównanie długości wiązań dla wiązań pojedynczych i wielokrotnych”, określenie długości każdego wiązania w nanometrach.
- A C–O bond
- A C=O bond
- an h–N bond
- a c≡n bond
-
angstrom (Å) jest zdefiniowany jako 10-10 m. korzystając z tabeli 4.2 „przybliżone długości wiązań niektórych pojedynczych wiązań” i tabeli 4.3 „porównanie długości wiązań dla pojedynczych i wielu wiązań”, określ długość każdego wiązania w angstromach.
- A C–C bond
- A C=C bond
- an n≡n bond
- an H–O bond
-
Zobacz ćwiczenie 3. Dlaczego Jednostka nanometru jest przydatna jako jednostka do wyrażania długości wiązania?
-
Zobacz ćwiczenie 4. Dlaczego Jednostka angstrom jest użyteczna jako jednostka do wyrażania długości wiązania?
-
korzystając z rysunku 4.4 „elektroujemność różnych elementów”, określ, który atom w każdej parze ma wyższą elektroujemność.
- H lub c
- O lub Br
- Na lub RB
- I lub Cl
-
korzystając z rysunku 4.4 „elektroujemność różnych elementów”, określ, który atom w każdej parze ma niższą elektroujemność.
- Mg lub o
- S lub F
- Al lub Ga
- O Lub I
-
czy elektrony będą dzielone równo lub nierównie w każdym wiązaniu kowalencyjnym? Jeśli nierównomiernie, do którego atomu silniej przyciągają elektrony?
- Wiązanie C–O
- Wiązanie F–F
- Wiązanie S–N
- wiązanie I–Cl
-
czy elektrony będą dzielone równo lub nierównie w każdym wiązaniu kowalencyjnym? Jeśli nierównomiernie, do którego atomu silniej przyciągają elektrony?
- Wiązanie C–C
- Wiązanie S–Cl
- Wiązanie O–H
- Wiązanie H–H
odpowiedzi
-
Wiązanie C–O jest dłuższe.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
rzeczywiste długości wiązania są bardzo małe, więc jednostka nanometru ułatwia zrozumienie ekspresji długości.
-
- C
- O
- Na
- Cl
-
- nierównie w kierunku O
- równo
- nierównie w kierunku N
- nierównie w kierunku Cl
