pierwszym podejściem do opracowania antagonistów kannabinoidowych pod koniec lat 80.było zmodyfikowanie struktury THC, ale wyniki były rozczarowujące. Na początku lat 90. odkryto nową rodzinę agonistów kannabinoidów z NLPZ (niesteroidowy lek przeciwzapalny) pravadoline, który doprowadził do odkrycia antagonistów aminoalkil indolu z pewnym, ale ograniczonym sukcesem. Ponieważ poszukiwania oparte na strukturze agonistów były rozczarowujące, nie było zaskoczeniem, że pierwszy silny i selektywny antagonista kannabinoidów należał do zupełnie nowej rodziny chemicznej. W 1994 roku pierwszy selektywny antagonista kannabinoidów, SR141716 (rymonabant), został wprowadzony przez Sanofi należące do rodziny 1,5-diarylopirazoli.
RimonabantEdit



Rymonabant, znany również pod nazwą systematyczną , jest antagonistą receptora CB1 1,5-diarylopirazolu (ryc. 2). Rymonabant jest nie tylko silnym i wysoce selektywnym ligandem receptora CB1, ale jest również aktywny doustnie i antagonizuje większość efektów agonistów kannabinoidów, takich jak THC, zarówno in vitro, jak i In vivo. Rymonabant wykazał wyraźną skuteczność kliniczną w leczeniu otyłości.
Wiązanie
Wiązanie ligandu agonistycznego z receptorem CB1 wywołuje zmianę konformacyjną i prowadzi do stanu aktywnego receptora, który jest odpowiedzialny za transdukcję sygnału. Istnieje jednak dodatkowy mechanizm, który może prowadzić do stanu aktywnego w przypadku braku ligandu. Podobnie jak wiele innych GPCR, receptor CB1 wykazuje wysoki poziom konstytutywnej aktywności, a zatem może spontanicznie przyjąć aktywny stan konformacyjny w przypadku braku wiązania agonistycznego, utrzymując podwyższone podstawowe poziomy sygnalizacji wewnątrzkomórkowej. Można to wyjaśnić dwoma modelami stanu aktywacji receptora, w których receptory znajdują się w równowadze między dwoma stanami, aktywnymi i nieaktywnymi (R* i R). Agonista stabilizuje stan aktywny prowadzący do aktywacji, neutralny antagonista wiąże się w równym stopniu ze Stanami aktywnymi i nieaktywnymi, podczas gdy odwrotny agonista preferencyjnie stabilizuje stan nieaktywny (Fig.3).
Rymonabant w wielu przypadkach zachowuje się jako odwrotny agonista, a nie jako neutralny antagonista i jest prawdopodobne, że wiąże się preferencyjnie ze stanem nieaktywnym CB1, zmniejszając w ten sposób aktywację szlaku sygnałowego. Kluczową interakcją wiązania jest wiązanie wodorowe utworzone między grupą karbonylową rymonabantu a pozostałością Lys192 receptora CB1. Wiązanie to stabilizuje mostek solny Lys192-Asp366 wewnątrzkomórkowego końca Helis transbłonowych 3 i 6 (Fig.4). Ten specyficzny mostek solny jest obecny w stanie nieaktywnym receptora, ale nieobecny w stanie aktywnym.
w stanie nieaktywnym CB1 rymonabant wiąże się w obrębie transmembrany-3-4-5-6 aromatyczna mikrodomena. Wiązanie rymonabantu wiąże się z bezpośrednimi interakcjami aromatycznymi między pierścieniem 2,4-dichlorofenylowym i pozostałościami Trp279/Phe200/Trp356 po jednej stronie a pierścieniem parachlorofenylowym i pozostałościami Tyr275/Trp255/Phe278 po drugiej stronie. Lipofilowa Grupa piperydynylowa dobrze pasuje do jamy utworzonej przez reszty aminokwasowe Val196 / Phe170 / Leu387 i Met384 (Fig.4).
Farmakoforeedit
Większość dotychczas zgłoszonych antagonistów CB1 to bliskie analogi lub izostery rymonabantu. Ogólny model farmakoforu odwrotnego agonisty CB1 można wyekstrahować ze wspólnych cech tych analogów, diarylopirazoli(Fig. 4). Ten farmakofor zawiera cykliczny rdzeń, C, (np. pirazol w rymonabancie) podstawiony przez dwie grupy aromatyczne, A I B. Jednostka akceptująca wiązanie wodorowe, d, łączy C z cykliczną częścią lipofilową, E. w niektórych przypadkach jednostka E łączy się bezpośrednio z C. na fig.4 jako przykład podano rymonabant. Jednostka a reprezentuje grupę 4-chlorofenylową, a jednostka B pierścień 2,4-dichlorofenylowy. Jednostka C jest centralnym pierścieniem pirazolowym, a jednostka D reprezentuje grupę karbonylową, która pełni funkcję akceptora wiązania wodorowego. Jednostka E reprezentuje lipofilową grupę aminopiperydynylową.
związek struktura-aktywność
optymalne Wiązanie na receptorze CB1 wymaga para-podstawionego pierścienia fenylowego w pirazolu w pozycji 5. 5-podstawnik pirazolu bierze udział w rozpoznawaniu receptorów i antagonizmie. Para podstawnikiem pierścienia fenylowego może być chlor, brom lub jod, ale wykazano, że łańcuch alkilowy może być również tolerowany. Numeracja centralnego pierścienia pirazolowego przedstawiona jest na fig. 2.
2,4-dichloro-podstawiony pierścień fenylowy w pozycji 1-pirazolu jest korzystny zarówno dla powinowactwa, jak i dla aktywności. Wykazano, że dodatkowe halogeny na tym pierścieniu fenylowym zmniejszają powinowactwo.
korzystnie jest również mieć podstawienie pierścieniowe w grupie 3-karboksyamidowej, takiej jak Grupa 1-piperydynylowa w rymonabancie. Zastąpienie podstawnika aminopiperydynylu amidami alkilowymi, eterami, ketonami, alkoholami lub alkanami powodowało głównie zmniejszenie powinowactwa. Zastąpienie piperydynylu przez pentyl lub łańcuch heptylowy dało związkom właściwości agonistyczne. Na podstawie tych wyników stwierdzono, że pozycja 3-pirazolu wydaje się być zaangażowana w agonizm,podczas gdy pozycje 1 -, 4 -, 5-wydają się być zaangażowane w antagonizm.
badania wykazały, że brak tlenu karboksyamidowego powoduje zmniejszenie powinowactwa. Ponadto obecność tlenu karboksyamidowego przyczynia się do nadania odwrotnych właściwości agonistycznych, podczas gdy analogi pozbawione tego tlenu są obojętnymi antagonistami. Wyniki te potwierdzają hipotezę, że tlen karboksyamidowy tworzy wiązanie wodorowe z resztką Lys192 na receptorze CB1.
pochodne Diarylopirazoluedytuj
analogi SR141716 (rymonabant) zostały niedawno opisane przez kilka grup, co doprowadziło do dobrego zrozumienia relacji struktura-aktywność (SAR) w tej grupie chemicznej. Podczas gdy większość opisanych związków jest słabsza niż SR141716, warto wspomnieć o dwóch z nich, SR147778 i AM251, chociaż oba mogą mieć również działanie na receptory opioidowe mu.
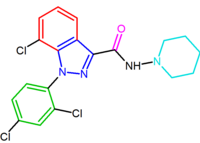
SR147778 (surinabant), antagonista drugiej generacji, ma dłuższy czas działania niż rymonabant i zwiększoną aktywność doustną. Ten zwiększony czas działania jest prawdopodobnie spowodowany obecnością bardziej stabilnej metabolicznie grupy etylowej w pozycji 4 pierścienia pirazolowego. Inną zmianą jest zastąpienie podstawnika 5-fenylochloru bromem.
pochodna diarylopirazolu, AM251, została opisana, gdzie podstawnik chloru został zastąpiony jodem w pozycji para pierścienia 5-fenylowego. Ta pochodna okazała się silniejsza i bardziej selektywna niż rymonabant.
zsyntetyzowano 21 analogów posiadających albo amid alkilowy, albo hydrazyd alkilowy o różnej długości w pozycji 3. Zaobserwowano, że powinowactwo wzrasta wraz ze zwiększeniem długości łańcucha węglowego do pięciu atomów węgla. Również analogi amidowe wykazywały większe powinowactwo niż analogi hydrazydowe. Jednak żaden z tych analogów nie posiadał znacznie większego powinowactwa niż rymonabant, ale mimo to były nieco bardziej selektywne niż rymonabant dla receptora CB1 nad receptorem CB2.
podjęto kilka prób zwiększenia powinowactwa pochodnych diarylopirazolu poprzez sztywnienie struktury rymonabantu. W ogólnym modelu farmakoforowym jednostki A, B i / lub C są połączone dodatkowymi wiązaniami prowadzącymi do sztywnych cząsteczek. Na przykład, skondensowany policykliczny pirazol NESS – 0327 wykazywał 5000 razy większe powinowactwo do receptora CB1 niż rymonabant. Jednak związek ten ma słabą biodostępność ośrodkową.
inny związek, pochodna indazolu O-1248, można uznać za analog rymonabantu, w którym jego grupa 5-arylowa jest skondensowana z ugrupowaniem pirazolowym. Jednak ta modyfikacja strukturalna spowodowała 67-krotne zmniejszenie powinowactwa do receptora CB1.
te diarylopirazolowe pochodne rymonabantu podsumowano w tabeli 1.

|
 |
| SR147778 | AM251 |
 |
 |
| NESS-0327 | O-1248 |
Other derivativesEdit
Structurally different from the 1,5-diarylpyrazoles are the chemical series of the 3,4-diarylpyrazolines. W tej serii znajduje się SLV-319 (ibipinabant), silny antagonista CB1, który jest około 1000 razy bardziej selektywny dla CB1 w porównaniu z CB2 i wykazuje aktywność in vivo podobną do rymonabantu.
innym podejściem stosowanym do opracowania analogów rymonabantu było zastąpienie centralnego pierścienia pirazolowego innym heterocyklem. Przykładem takiego podejścia są 4,5-diaryloimidazole i 1,5-diarylopirolo-3-karboksyamidy.
donoszono o dużej liczbie skondensowanych bicyklicznych pochodnych diarylo-pirazolu i imidazoli. Przykładem jest pochodna purynowa, w której pierścień pirymidynowy łączy się z pierścieniem imidazolowym. Otenabant (CP-945,598) jest przykładem skondensowanej pochodnej bicyklicznej opracowanej przez firmę Pfizer.
kilka grup badawczych badało bioizostery pirazolowe o sześcioczłonowym pierścieniu. Na przykład, wykazano, że jedna pochodna 2,3-diarylopirydyny jest silnym i selektywnym odwrotnym agonistą CB1. Struktura tego związku pokazuje możliwość, że ugrupowanie amidowe rymonabantu można podzielić na lipofilowe (benzyloksy) i polarne (nitrylowe). Innymi sześcioczłonowymi analogami pierścieni są np. pirymidyny i pirazyny.
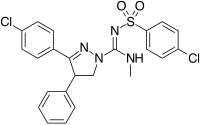
oprócz pięcio-i sześcioczłonowych analogów pierścieniowych istnieją inne cykliczne pochodne, takie jak azetydyny. Jednym z przykładów jest pochodna azetydyny metylosulfonamidu, która ma grupę 1,1-diarylową naśladującą ugrupowanie 1,5-diarylowe diarylopirazoli. Grupa sulfonylowa służy jako akceptor wiązania wodorowego. Grupa 1,1-diaryl jest również obecna w pochodnych, takich jak benzodioksole i hydantoiny.
donoszono również o analogach acyklicznych. Analogi te zawierają motyw 1,2-diarylu, który odpowiada podstawnikom 1,5-diarylu rymonabantu. Przykładem acyklicznego analogu jest taranabant (MK-0364) opracowany przez Merck.
przedstawiciele tych analogów są podsumowani w tabeli 2.
 |

|
 |
|
| Type of derivative |
3,4-Diarylpyrazoline (Ibipinabant) | 4,5-Diarylimidazole | 1,5-Diarylpyrrole-3-carboxamides |
 |
 |
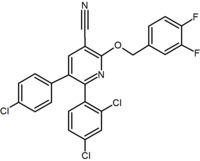 |
|
| Type of derivative |
Purine (pyrimidine ring fused to an imidazole ring) |
Purine derivative (Otenabant) | 2,3-Diarylpyridine |
 |
 |
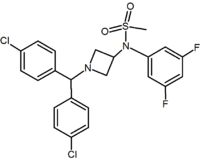 |
|
| Type of derivative |
Pyrimidine | Pyrazine | Methylsulfonamide azetidine |
 |
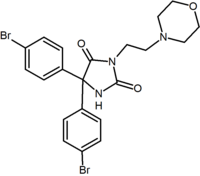 |
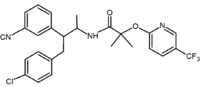 |
|
| rodzaj pochodnej |
Benzodioksolu | hydantoiny | pochodnej Acyklicznej (Taranabant) |
antybody receptora cb1edytuj
przeciwciała przeciwko receptorowi CB1 zostały opracowane i wprowadzone do użytku klinicznego w Rosji. Należą do nich brizantin (rosyjski: Бризантин®) i dietressa (rosyjski: Диетресса®). Brizantin jest wskazany w leczeniu odstawienia nikotyny i zaprzestania palenia, a dietressa jest wskazany w przypadku utraty wagi. Dietressa jest dostępny bez recepty w Rosji.
