cele nauki
- napisz wzór chemiczny na prosty związek jonowy.
- Rozpoznaj jony poliatomowe we wzorach chemicznych.
napotkaliśmy już pewne wzory chemiczne dla prostych związków jonowych. Wzór chemiczny jest zwięzłą listą pierwiastków w związku i proporcjami tych pierwiastków. Aby lepiej zrozumieć, co oznacza wzór chemiczny, musimy rozważyć, w jaki sposób związek jonowy jest zbudowany z jego jonów.
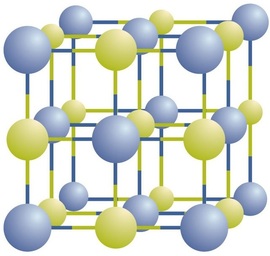
związki jonowe istnieją jako naprzemienne jony dodatnie i ujemne w regularnych, trójwymiarowych układach zwanych Kryształami (rysunek \(\PageIndex{1}\)). Jak widać, nie ma pojedynczych \(\ce{NaCl}\) „cząstek” w tablicy; zamiast tego istnieje ciągła siatka naprzemiennych jonów sodu i chlorku. Jako sposób opisu związku możemy jednak wykorzystać stosunek jonów sodu do jonów chlorkowych, wyrażony w możliwie najniższych liczbach całkowitych. W przypadku chlorku sodu stosunek jonów sodu do jonów chlorkowych, wyrażony w najmniejszych liczbach całkowitych, wynosi 1:1, więc używamy \(\ce{NaCl}\) (jeden symbol \(\ce{Na}\) i jeden symbol \(\ce{Cl}\)) do reprezentowania związku. Zatem \(\ce{NaCl}\) jest wzorem chemicznym chlorku sodu, który jest zwięzłym sposobem opisu względnej liczby różnych jonów w związku. Makroskopowa próbka składa się z miriadów par NaCl; każda pojedyncza para nazywana jest jednostką formula_1. Chociaż wygodnie jest myśleć, że kryształy \(\ce{NaCl}\) składają się z pojedynczych jednostek \(\ce{NaCl}\), rysunek \(\PageIndex{1}\) pokazuje, że żaden pojedynczy jon nie jest związany wyłącznie z żadnym innym pojedynczym Jonem. Każdy jon jest otoczony przez jony o przeciwnym ładunku.
wzór na związek jonowy jest zgodny z kilkoma konwencjami. Po pierwsze, kation jest zapisywany przed anionem. Ponieważ większość metali tworzy kationy, a większość niemetali tworzy aniony, formuły Zwykle wymieniają najpierw metal, a następnie niemetal. Po drugie, opłaty nie są zapisane we wzorze. Pamiętaj, że w związku jonowym składnikiem są jony, a nie obojętne Atomy, mimo że wzór nie zawiera ładunków. Wreszcie, właściwy wzór dla związku jonowego zawsze ma ładunek zerowy netto, co oznacza, że całkowity ładunek dodatni musi być równy całkowitemu ładunkowi ujemnemu. Aby określić właściwy wzór dowolnej kombinacji jonów, określ, ile każdego jonu jest potrzebnych do zrównoważenia całkowitych dodatnich i ujemnych ładunków w związku.
reguła ta opiera się ostatecznie na tym, że materia jest ogólnie neutralna elektrycznie.
zgodnie z konwencją, Załóżmy, że istnieje tylko jeden atom, jeśli indeks dolny nie jest obecny. Nie używamy 1 jako indeksu dolnego.
Jeśli spojrzymy na związek jonowy składający się z jonów litu i jonów bromkowych, zobaczymy, że Jon litu ma ładunek 1+, A jon bromkowy ma ładunek 1−. Tylko jeden Jon Z Każdego jest potrzebny do zrównoważenia tych ładunków. Wzór na bromek litu to \(\ce{LiBr}\).
gdy związek jonowy powstaje z magnezu i tlenu, jon magnezu ma ładunek 2+, a atom tlenu ma ładunek 2. Chociaż oba te jony mają większe ładunki niż jony w bromku litu, nadal równoważą się w stosunku jeden do jednego. Dlatego właściwym wzorem dla tego związku jonowego jest \(\ce{MgO}\).
teraz rozważmy związek jonowy utworzony przez magnez i chlor. Jon magnezu ma ładunek 2+, podczas gdy jon chloru ma ładunek 1:
\
połączenie jednego jonu z każdego nie równoważy całkowicie ładunku dodatniego i ujemnego. Najprostszym sposobem zrównoważenia tych ładunków jest założenie obecności dwóch jonów chlorkowych dla każdego jonu magnezu:
\
teraz ładunki dodatnie i ujemne są zrównoważone. Moglibyśmy napisać wzór chemiczny dla tego związku jonowego jako \(\ce{MgClCl}\), ale konwencją jest użycie numerycznego indeksu dolnego, gdy istnieje więcej niż jeden jon danego typu – \(\ce{MgCl2}\). Ten wzór chemiczny mówi, że w tym wzorze jest jeden jon magnezu i dwa jony chlorkowe. (Nie czytaj części „Cl2” wzoru jako cząsteczki dwuatomowego pierwiastkowego chloru. Chlor nie występuje w tym związku jako pierwiastek dwuatomowy. Istnieje raczej jako dwa pojedyncze jony chlorkowe.) Zgodnie z konwencją najniższy stosunek liczby całkowitej jest stosowany we wzorach związków jonowych. Wzór \(\ce{Mg2Cl4}\) ma zrównoważone ładunki z jonami w stosunku 1:2, ale nie jest to najniższy stosunek liczby całkowitej.
dla związków, w których stosunek jonów nie jest tak oczywisty, indeksy dolne we wzorze można uzyskać przez przekroczenie ładunków: użyj wartości bezwzględnej ładunku dla jednego jonu jako indeksu dolnego dla drugiego jonu. Metoda ta przedstawiona jest schematycznie na rysunku 3.3.2.
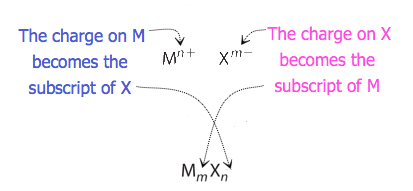
przy przekraczaniu ładunków, czasami konieczne jest zmniejszenie indeksów do ich najprostszego stosunku, aby zapisać wzór empiryczny. Rozważmy na przykład związek utworzony przez Pb4+ i O2−. Używając wartości bezwzględnych ładunków na jonach jako indeksów dolnych daje wzór Pb2O4. Upraszcza to jego poprawny empiryczny wzór PbO2. Wzór empiryczny zawiera jeden jon Pb4+ i dwa jony O2−.
przykład \(\PageIndex{1}\)
napisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon sodu i Jon siarki
- Jon glinu i Jon fluorku
- Jon żelaza 3+ i Jon tlenu
roztwór
- aby uzyskać oktet powłoki walencyjnej, sód tworzy Jon Z 1+ ładunek, podczas gdy jon siarki ma ładunek 2. Dwa jony sodu 1+ są potrzebne do zrównoważenia ładunku 2 na Jonie siarki. Zamiast zapisywać formułę jako \(\ce{NaNaS}\), skracamy ją zgodnie z konwencją do \(\ce{Na2S}\).
- Jon glinu ma ładunek 3+, podczas gdy jon fluorkowy utworzony przez fluor ma ładunek 1. Trzy jony 1-fluoru są potrzebne do zrównoważenia ładunku 3+ na Jonie aluminium. Ta kombinacja jest zapisana jako \(\ce{AlF3}\).
- żelazo może tworzyć dwa możliwe jony, ale Jon z ładunkiem 3+ jest tutaj określony. Atom tlenu ma ładunek 2 jako Jon. Aby zrównoważyć ładunki dodatnie i ujemne, patrzymy na najmniejszą wspólną wielokrotność-6: dwa jony żelaza 3+ dadzą 6+, podczas gdy trzy jony tlenu 2 dadzą 6 -, równoważąc w ten sposób ogólne ładunki dodatnie i ujemne. Zatem wzór na ten związek jonowy to \(\ce{Fe2O3}\). Alternatywnie należy zastosować metodę opłat krzyżowych przedstawioną na rysunku 3.3.2.
ćwiczenie \(\PageIndex{1}\)
napisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon wapnia i Jon tlenu
- Jon miedzi 2+ i Jon siarki
- Jon miedzi 1+ i Jon siarki
odpowiedź A:
Cao
odpowiedź b:
CuS
odpowiedź c:
Cu2S
jony Poliatomowe
niektóre jony składają się z grup atomów kowalencyjnie połączonych ze sobą i mają ogólny ładunek elektryczny. Ponieważ jony te zawierają więcej niż jeden atom, nazywane są jonami poliatomowymi. Struktury Lewisa, nazwy i wzory niektórych jonów poliatomowych znajdują się w tabeli 3.3.1.
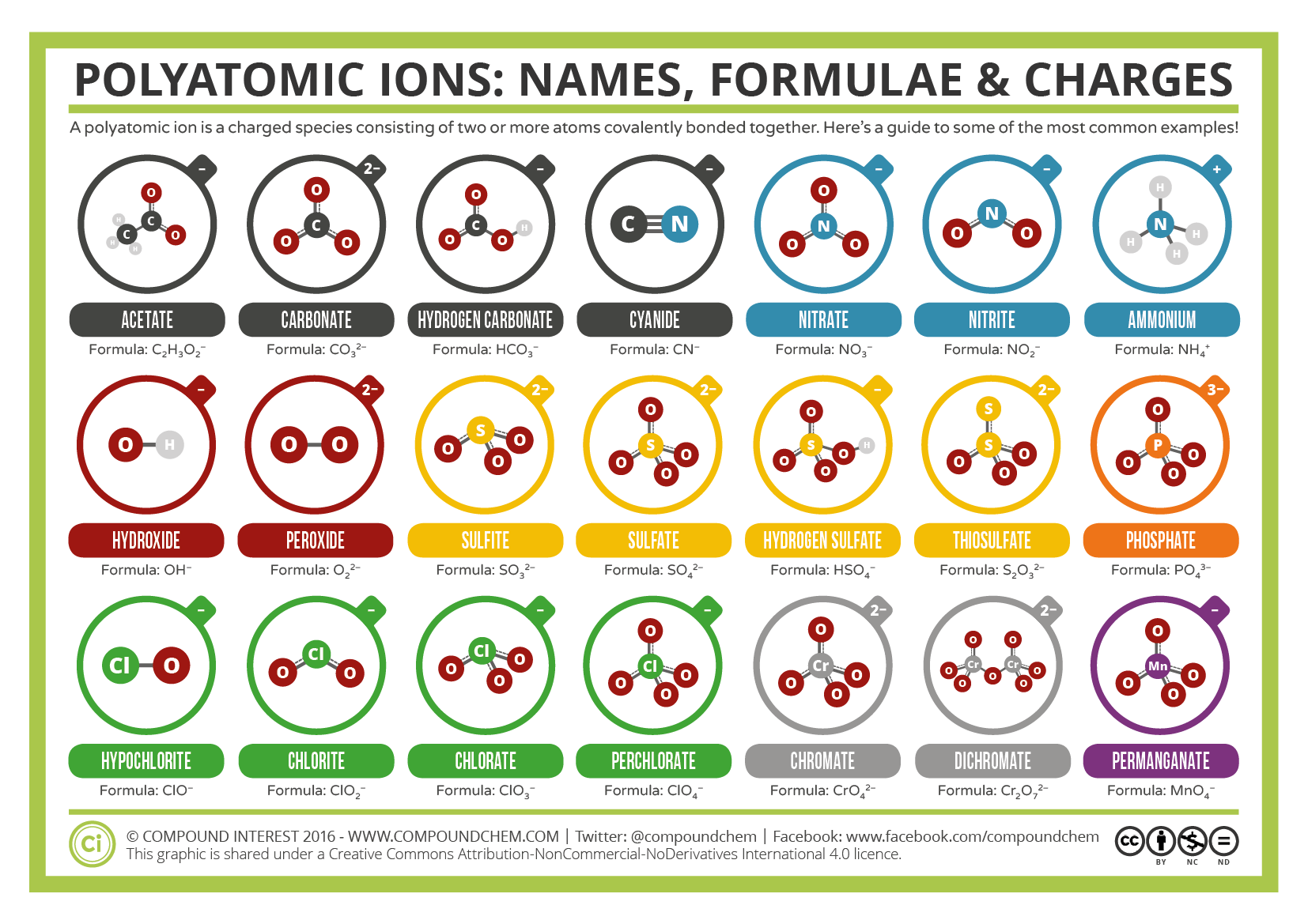
Table \(\PageIndex{1}\): Niektóre jony Poliatomowe
mają zdefiniowane wzory, nazwy i ładunki, których nie można modyfikować w żaden sposób. Table \(\PageIndex{2}\) wymienia nazwy jonów i wzory jonów najczęstszych jonów poliatomowych. Na przykład \(\ce{NO3^ { – }}\) to jon azotanowy; ma jeden atom azotu i trzy atomy tlenu oraz ogólny ładunek 1. Rysunek \(\PageIndex{2}\) zawiera listę najczęstszych jonów poliatomowych.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Pozostałe jony poliatomowe są naładowane ujemnie i dlatego są klasyfikowane jako aniony. Jednak tylko dwa z nich, jon wodorotlenku i Jon cyjanku, są nazwane przy użyciu przyrostka „- ide”, który zazwyczaj wskazuje na ujemnie naładowane cząstki. Pozostałe aniony poliatomowe, które zawierają tlen, w połączeniu z innym niemetalem, istnieją jako część serii, w której liczba tlenu w jednostce poliatomowej może się różnić. Jak wielokrotnie podkreślano w kilku częściach tego tekstu, żadne dwa wzory chemiczne nie powinny mieć wspólnej nazwy chemicznej. Pojedynczy przyrostek, „- ide”, jest niewystarczający do odróżnienia nazw anionów w pokrewnych seriach poliatomicznych. W związku z tym stosuje się przyrostki „-ate” i „-ite” w celu oznaczenia, że odpowiadające im jony poliatomowe należą do szeregu. Dodatkowo, przyrostki te wskazują również względną liczbę tlenu, które są zawarte w jonach poliatomowych. Zauważ, że wszystkie jony poliatomowe, których nazwy kończą się na „-ate”, zawierają o jeden więcej tlenu niż aniony poliatomowe, których nazwy kończą się na „-ITE.”Niestety, podobnie jak w powszechnym systemie nazewnictwa metali przejściowych, przyrostki te wskazują jedynie względną liczbę tlenków zawartych w jonach poliatomowych. Na przykład jon azotanowy, który jest symbolizowany jako NO3−1, mA o jeden więcej tlenu niż jon azotynowy, który jest symbolizowany jako NO2−1. Jednak jon siarczanowy jest symbolizowany jako SO4−2. Podczas gdy zarówno jon azotanowy, jak i Jon siarczanowy mają wspólny przyrostek „- ate”, pierwszy zawiera trzy tlenki, ale drugi zawiera cztery. Ponadto zarówno jon azotanowy, jak i Jon siarczynowy zawierają trzy tlenki, ale te poliatomowe jony nie mają wspólnego przyrostka. Niestety, względna natura tych przyrostków nakazuje, że kombinacje jonów formula_1/nazw jonów jonów poliatomowych muszą być po prostu zapamiętane.
zasada konstruowania wzorów dla związków jonowych zawierających jony poliatomowe jest taka sama jak dla wzorów zawierających jony jednoatomowe: ładunki dodatnie i ujemne muszą się równoważyć. Jeśli więcej niż jeden z jonów poliatomowych jest potrzebny do zrównoważenia ładunku, cały wzór dla jonu poliatomowego musi być ujęty w nawiasach, A Indeks liczbowy jest umieszczony poza nawiasem. Ma to na celu pokazanie, że indeks dolny odnosi się do całego jonu poliatomowego. Poniżej przedstawiono dwa przykłady:

przykład \(\PageIndex{2}\)
napisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon potasu i Jon siarczanowy
- jon wapnia i Jon azotanowy
roztwór
- jony potasu mają ładunek 1+, podczas gdy jony siarczanowe mają ładunek 2−. Będziemy potrzebować dwóch jonów potasu do zrównoważenia ładunku na Jonie siarczanowym, więc właściwy wzór chemiczny to \(\ce{k_2so_4}\).
- jony wapnia mają ładunek 2+, podczas gdy jony azotanowe mają ładunek 1−. Będziemy potrzebować dwóch jonów azotanowych, aby zrównoważyć ładunek na każdym Jonie wapnia. W nawiasach należy podać wzór azotanu. Tak więc zapisujemy \(\ce{Ca (NO3)2}\) jako wzór dla tego związku jonowego.
ćwiczenie \(\PageIndex{2}\)
napisz wzór chemiczny związku jonowego złożonego z każdej pary jonów.
- jon magnezu i Jon węglanu
- Jon glinu i Jon octanu
odpowiedź A:
Mg2+ i Co32- = MgCO3
odpowiedź B:
Al3+ i C2H3O2- = Al(C2H3O2)3
rozpoznawanie związków jonowych
istnieją dwa sposoby rozpoznawania związków jonowych. Po pierwsze, związki między pierwiastkami metalowymi i niemetalowymi są zwykle jonowe. Na przykład CaBr2 zawiera pierwiastek metaliczny (wapń, metal z grupy 2A) i niemetalowy (brom, niemetal z grupy 7A). Dlatego jest to najprawdopodobniej związek jonowy. (W rzeczywistości jest jonowy.) Natomiast związek NO2 zawiera dwa pierwiastki, które są niemetalami (azot z grupy 5A i tlen z grupy 6A). Nie jest związkiem jonowym, należy do kategorii związków kowalencyjnych. Należy również zauważyć, że ta kombinacja azotu i tlenu nie ma określonego ładunku elektrycznego, więc nie jest to jon azotynowy.
Po drugie, jeśli rozpoznasz wzór jonu poliatomowego w związku, związek jest jonowy. Na przykład, jeśli widzisz wzór \(\ce{Ba (NO3)2}\), możesz rozpoznać część „NO3” jako Jon azotanowy, \(\rm{NO_3^−}\). (Pamiętaj, że konwencja pisania wzorów dla związków jonowych nie obejmuje ładunku jonowego.) Jest to wskazówka, że druga część wzoru, \(\ce{Ba}\), jest w rzeczywistości Jonem \(\ce{Ba^{2+}}\), z ładunkiem 2+ równoważącym całkowity ładunek 2 z dwóch jonów azotanowych. Tak więc związek ten jest również jonowy.
przykład \(\PageIndex{3}\)
identyfikuje każdy związek jako jonowy lub nie jonowy.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
rozwiązanie
- sód jest metalem, a tlen niemetalem; dlatego oczekuje się, że \(\ce{Na2O}\) będzie jonowy.
- zarówno fosfor, jak i chlor są niemetalami. Dlatego \(\ce{PCl3}\) nie jest jonowe.
- \(\ce{NH4}\) we wzorze reprezentuje jon amonowy, \(\ce{NH4^ {+}}\), co oznacza, że związek ten jest jonowy.
- zarówno tlen, jak i fluor są niemetalami. Dlatego \(\ce{OF2}\) nie jest jonowe.
ćwiczenie \(\PageIndex{3}\)
identyfikuje każdy związek jako jonowy lub nie jonowy.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3po4}\)
- \(\ce{SOCl2}\)
odpowiedź a:
nie jonowa
odpowiedź B:
jonowy
odpowiedź c:
jonowy
odpowiedź D:
nie jonowy
patrząc bliżej: krew i woda morska
Nauka od dawna uznaje, że krew i woda morska mają podobne składy. Wszakże oba ciecze mają rozpuszczone w nich związki jonowe. Podobieństwo może być czymś więcej niż tylko przypadkiem; wielu naukowców uważa, że pierwsze formy życia na Ziemi powstały w oceanach. Jednak bliższe spojrzenie pokazuje, że krew i woda morska są zupełnie inne. 0,9% roztwór chlorku sodu jest zbliżony do stężenia soli we krwi. Natomiast woda morska jest głównie 3% roztworem chlorku sodu, ponad trzykrotnym stężeniem we krwi. Oto porównanie ilości jonów we krwi i wodzie morskiej:
| Jon | procent w wodzie morskiej | procent we krwi |
|---|---|---|
| na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Różnica ta jest znacząca, ponieważ jon wodorowęglanu i niektóre związane z nim jony odgrywają kluczową rolę w kontrolowaniu właściwości kwasowo-zasadowych krwi. Ilość jonów wodorofosforanu – \(\ce{HPO4^{2 -}}\) i \(\ce{H2PO4^{ – }}\) – w wodzie morskiej jest bardzo niska, ale występują w większych ilościach we krwi, gdzie wpływają również na właściwości kwasowo-zasadowe. Inną zauważalną różnicą jest to, że krew nie ma znacznych ilości jonu siarczanowego (\(\ce{SO4^{2−}}\)), ale ten jon jest obecny w wodzie morskiej.
najważniejsze informacje
- właściwe wzory chemiczne związków jonowych równoważą całkowity ładunek dodatni z całkowitym ładunkiem ujemnym.
- istnieją również grupy atomów o ładunku ogólnym, zwane jonami poliatomowymi.
ćwiczenia
-
Jakie informacje zawarte są we wzorze związku jonowego?
-
Dlaczego wzory chemiczne dla niektórych związków jonowych zawierają indeksy, podczas gdy inne nie?
3. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- Mg2+ i I−
- Na+ I O2−
4. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- na+ I Br−
- Mg2+ i Br−
- Mg2+ i S2−
5. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- K+ i CL−
- Mg2+ i CL−
- Mg2+ i Se2−
6. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- na+ I N3−
- Mg2+ i N3−
- Al3+ i S2−
7. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- Li+ i N3−
- Mg2+ i P3−
- Li+ i P3−
8. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- Fe3+ i Br−
- Fe2+ i Br−
- Au3+ i S2−
- Au+ i S2−
9. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- Cr3+ i O2−
- Cr2+ i O2−
- Pb2+ i Cl−
- Pb4+ i Cl−
10. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- Cr3+ i NO3−
- Fe2+ i PO43−
- Ca2+ i CrO42−
- Al3+ i OH−
11. Napisz wzór chemiczny dla związku jonowego utworzonego przez każdą parę jonów.
- NH4+ i NO3−
- H+ I Cr2O72−
- Cu+ i CO32−
- Na+ I HCO3−
12. Dla każdej pary pierwiastków określ ładunek dla ich jonów i napisz odpowiedni wzór na powstały między nimi związek jonowy.
- Ba I S
- Cs I I
13. Dla każdej pary pierwiastków określ ładunek dla ich jonów i napisz odpowiedni wzór na powstały między nimi związek jonowy.
- K I S
- Sc I Br
14. Które związki według pana są jonowe?
- Li2O
- (NH4)2o
- CO2
- FeSO3
- C6H6
- C2H6O
15. Które związki według pana są jonowe?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CRO4
- C8H18
- NH3
odpowiedzi
1. stosunek każdego rodzaju jonów w związku
2. Czasami więcej niż jeden jon jest potrzebny do zrównoważenia ładunku na drugim Jonie w związku jonowym.
- MgI2
- Na2O
- Nab.
- MgBr2
- MgS
- KCl
- MgCl2
- MgSe
- Na3N
- Mg3N2
- Al2S3
- Li3N
- Mg3P2
- Li3P
- FeBr3
- FeBr2
- Au2S3
- Au2S
- Cr2O3
- Crm
- PbCl2
- PbCl4
- Cr(NO3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- H2Cr2O7
- Cu2CO3
- NaHCO3
- Ba2+, S2−, BaS
- Cs+, I−, Lpg
- K+, S2−, K2S
- Sc3+, Br−, ScBr3
- ionic
- ionic
- not ionic
- ionic
- not ionic
- not ionic
- Ion
nie Ion nie ion - Ion
nie Ion nie ion
