istnieje wiele sposobów, w jakie komórka może przemieszczać się z jednego punktu w przestrzeni do drugiego. W ciekłym medium, metoda ta może być jakiś rodzaj pływania, wykorzystując rzęskowy lub flagellar ruchu do napędzania komórki. Na powierzchniach stałych mechanizmy te najwyraźniej nie będą działać wydajnie, a komórka przechodzi proces pełzania. W tej sekcji zaczynamy od omówienia ruchu rzęskowego/flagellar, a następnie rozważamy bardziej skomplikowane wymagania pełzania komórkowego.
rzęski i wiciowce, które różnią się przede wszystkim długością, a nie budową, są organellami na bazie mikrotubul, które poruszają się ruchem do tyłu i do przodu. Przekłada się to na „wiosłowanie” przez stosunkowo krótkie rzęski, ale w dłuższej wici elastyczność struktury powoduje, że ruch w przód iw tył jest propagowany jako fala, więc ruch wiciowy jest bardziej pofałdowany lub podobny do whiplike (zastanów się, co się dzieje, gdy szybko machasz wężem ogrodowym z boku na bok w porównaniu z krótkim kawałkiem tego samego węża). Rdzeń obu struktur nazywa się aksonemem, który składa się z 9 mikrotubul połączonych ze sobą za pomocą białek motorycznych dyneiny rzęskowej i otaczających centralny rdzeń dwóch oddzielnych mikrotubul.
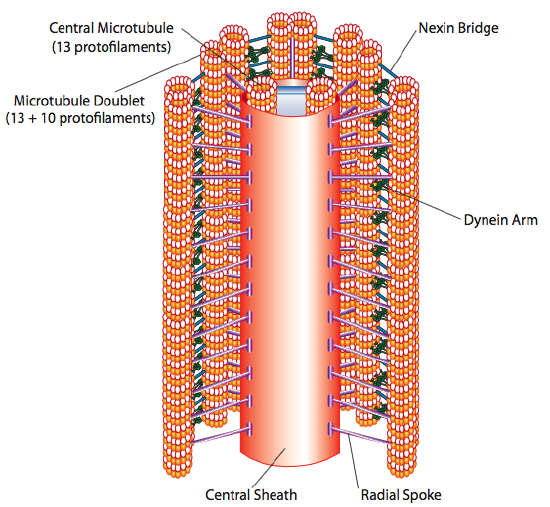
jest to formacja „9+2”, chociaż dziewięć dubletów nie jest tym samym, co dwie Centralne mikrotubule. Kanalik A jest pełnym 13-protofilamentem, ale kanalik B połączony z nim zawiera tylko 10 protofilamentów. Każda z centralnych mikrotubul stanowi pełne 13 protofilamentów. Aksoneme 9+2 wydłuża długość cilium lub wici od czubka, aż osiągnie podstawę, i łączy się z ciałem komórkowym przez korpus podstawowy, który składa się z 9 trojaczków mikrotubulowych rozmieszczonych w krótkiej beczce, podobnie jak centriole, z których pochodzą.
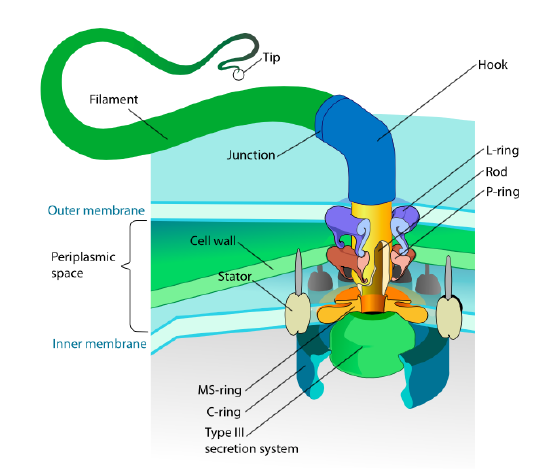
Ta sekcja odnosi się tylko do eukariotów. Niektóre prokarioty mają również ruchome wyrostki zwane flagellą, ale są zupełnie inne zarówno pod względem struktury, jak i mechanizmu. Same wici są długimi spiralnymi polimerami białka wici, a podstawa włókien wici jest połączona z białkiem silnika obrotowego, a nie z silnikiem translacyjnym. Ten silnik (rysunek \(\PageIndex{18}\)) wykorzystuje jon (H+ lub Na + w zależności od gatunku) w dół gradientu elektrochemicznego, aby zapewnić energię do obracania się aż 100000 obrotów na minutę. Uważa się, że obrót jest napędzany przez zmiany konformacyjne w pierścieniu stojana, zagnieżdżonym w błonie komórkowej.
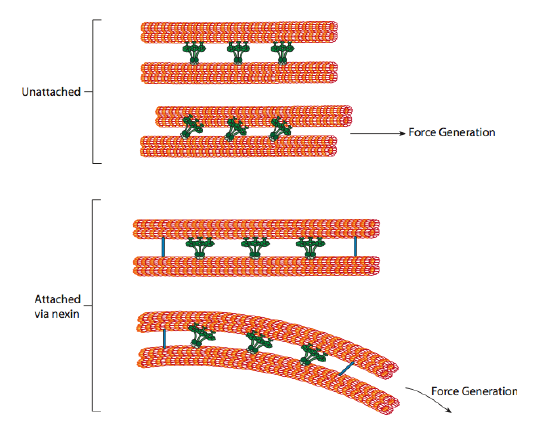
dyneiny rzęskowe zapewniają zdolność motoryczną, ale w aksonemie są również dwa inne białka wiążące. Istnieją nexiny, które łączą a-tubule jednego dubleta z B-tubule jego sąsiedniego dubleta, łącząc w ten sposób pierścień zewnętrzny. I, istnieją radialne szprychy, które rozciągają się od kanalika a każdego dubleta do centralnej pary mikrotubul w jądrze aksonu. Żadna z nich nie wykazuje aktywności ruchowej. Jednak są one kluczowe dla ruchu rzęsek i wici, ponieważ pomagają przekształcić ruch ślizgowy w ruch zginający. Gdy rzęskowa dyneina (bardzo podobna do cytoplazmatycznych dynein, ale ma trzy głowy zamiast dwóch) jest zaangażowana, wiąże mikrotubulę a z jednej strony, mikrotubulę B z sąsiedniego dubleta i porusza się jeden względem drugiego. Linia tych dynein poruszających się w porozumieniu przesuwałaby się w ten sposób jeden dublet w stosunku do drugiego, gdyby (i to jest duże „jeśli”) dwa dublety miały całkowitą swobodę ruchu. Jednakże, ponieważ dublety są połączone ze sobą przez białka nexin, to co się dzieje, gdy jeden dublet próbuje się ześlizgnąć, polega na tym, że zamiast tego wygina połączoną strukturę (rysunek \(\PageIndex{17}\)). To zgięcie odpowiada za ruch wiosłowania rzęsek, które są stosunkowo krótkie,a także ruch biczowania długiej wici, które propagują ruch zginający w dół aksonem.
chociaż myślimy o ruchu rzęskowym i wiciowym jako metodach napędu komórki, takich jak wiciowe Pływanie plemników w kierunku komórki jajowej, istnieje również wiele ważnych miejsc, w których komórka jest nieruchoma, a rzęski są używane do przemieszczania płynu przez komórkę. W rzeczywistości istnieją komórki z rzęskami w większości głównych narządów ciała. Odnotowano kilka dyskinez rzęskowych, z których najbardziej widoczna, pierwotna dyskineza rzęskowa (PCD), która obejmuje zespół Kartagenera (KS), jest spowodowana mutacją genu DNAI1, który koduje podjednostkę (pośredni łańcuch 1) aksonemalnej (rzęskowej) dyneiny. PCD charakteryzuje się niewydolnością oddechową z powodu nawracających infekcji, a diagnoza KS jest dokonywana, jeśli istnieje również situs inversus, stan, w którym normalna lewa-prawa asymetria ciała (np żołądek po lewej, wątroba po prawej) jest odwrócona. Pierwszym objawem jest brak aktywności licznych rzęsek komórek nabłonkowych w płucach. Ich normalną funkcją jest utrzymywanie śluzu w torze oddechowym w ciągłym ruchu. Zwykle śluz pomaga utrzymać wilgotność płuc, aby ułatwić funkcjonowanie, ale jeśli śluz staje się nieruchomy, staje się pożywką dla bakterii, a także staje się drażniącym i przeszkodą w prawidłowej wymianie gazowej.
situs inversus jest interesującą deformacją, ponieważ powstaje w rozwoju embrionalnym i dotyczy tylko 50% pacjentów z PCD, ponieważ upośledzenie funkcji rzęsek powoduje randomizację asymetrii lewo-prawo, a nie odwrócenie. W bardzo prostych słowach, podczas wczesnego rozwoju embrionalnego, asymetria lewo-prawa jest spowodowana częściowo ruchem sygnałów molekularnych w lewym ow przez węzeł embrionalny. Przepływ ten jest spowodowany skoordynowanym biciem rzęsek, więc gdy nie działają, przepływ jest zakłócany i następuje randomizacja.
inne objawy pacjentów z PCD wskazują również na pracę rzęsek i wici w organizmie. Niepłodność męska jest powszechne ze względu na immotyle plemników. Niepłodność kobiet, choć mniej powszechne, może również wystąpić, ze względu na dysfunkcję rzęsek jajowodu i jajowodu, które normalnie przenieść jajko wzdłuż od jajnika do macicy. Co ciekawe, istnieje również niski związek wodogłowia internus (przepełnienie komór mózgu płynem mózgowo-rdzeniowym, powodując ich powiększenie, które kompresuje tkankę mózgową wokół nich) z PCD. Jest to prawdopodobnie spowodowane dysfunkcją rzęsek w komórkach wyściółki wyściełających komory, a które pomagają krążyć w płynie mózgowo-rdzeniowym, ale najwyraźniej nie są całkowicie konieczne. Ponieważ uważa się, że przepływ luzem w płynie mózgowo-rdzeniowym jest napędzany głównie przez zmianę ciśnienia skurczowego/ rozkurczowego w mózgu, niektórzy przypuszczają, że rzęski mogą być zaangażowane głównie w ow przez niektóre z ciaśniejszych kanałów w mózgu.
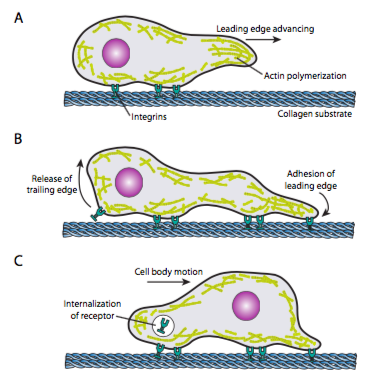
indeksowanie komórek (rysunek \(\PageIndex{19}\)) wymaga skoordynowanego uporządkowania sieci mikrofilamentów krawędzi czołowej, rozciągania (zarówno przez polimeryzację, jak i przesuwne włókna), a następnie tworzenia zrostów w nowym punkcie najbardziej wysuniętym do przodu. Może to przybrać formę filopodii lub lamellipodii, a często zarówno jednocześnie. Filopodia są długimi i bardzo cienkimi projekcjami z rdzeniowymi wiązkami równoległych mikrofilamentów i wysokimi stężeniami receptorów powierzchniowych komórek. Ich celem jest przede wszystkim wyczucie środowiska. Lamellipodia często rozciągają się między dwoma lopodiami i są bardziej szerokie niż palec. Wewnętrznie aktyna tworzy więcej siatek niż wiązek, a szersza krawędź pozwala na więcej zrostów do podłoża. Sieć mikrofilamentów następnie ponownie się zmienia, tym razem otwierając przestrzeń w cytoplazmie, która działa jako kanał dla ruchu mikrotubul w kierunku przedniej części komórki. Dzięki temu sieć transportowa jest w stanie pomóc w przemieszczaniu wewnątrzkomórkowego materiału sypkiego do przodu. W takim przypadku stare zrosty na końcu ogona komórki są uwalniane. Uwalnianie to może nastąpić poprzez dwa podstawowe mechanizmy: endocytozę receptora lub dezaktywację receptora przez zmianę sygnałową / konformacyjną. OczywiĹ „cie, to zbytnie uproszczenie przeczy zawiĺ’ oĹ „ciom w koordynowaniu i kontrolowaniu wszystkich tych dziaĹ’ aĹ ” dla osiÄ … gniÄ ™ cia ukierunkowanego ruchu komórki.
jeden z modeli generowania siły mikrofilamentu, elastyczny model Zapadkowy Browna (Mogilner and Oster, 1996), proponuje, że z powodu ruchu Browna błony komórkowej wynikającego z ciągłych minutowych fluktuacji termicznych, włókna aktyny, które wypychają się w kierunku krawędzi membrany, są zginane w różnym stopniu. Jeśli flex jest wystarczająco duży, nowy monomer aktyny może zmieścić się między membraną a końcówką filamentu, a gdy TERAZ dłuższy filament wygina się z powrotem, może wywierać większy nacisk na membranę. Oczywiście pojedynczy filament nie generuje dużej siły, ale skoordynowane przedłużenie wielu włókien może popchnąć membranę do przodu.
gdy komórka otrzymuje sygnał do ruchu, początkowa odpowiedź cytoszkieletu polega na polimeryzacji aktyny, budując więcej mikrofilamentów, aby włączyć się do krawędzi natarcia. W zależności od sygnału (atrakcyjnego lub odpychającego) polimeryzacja może wystąpić po tej samej lub przeciwnej stronie komórki od punktu aktywacji sygnału-receptora. Co istotne, polimeryzacja samej nowej f-aktyny może wygenerować wystarczającą siłę, aby przesunąć membranę do przodu, nawet bez udziału silników miozyny! Modele generowania siły są dyskutowane, ale na ogół zaczynają się od włączenia nowej g-aktyny do włókna na jego czubku; to jest na interfejsie włókno-membrana. Nawet jeśli to technicznie wystarczy, w żywej komórce zaangażowane są miozyny, które pomagają popychać i układać włókna w kierunku, aby ustawić nową krawędź wiodącą. Ponadto niektóre włókna i sieci muszą być szybko zerwane i nowe połączenia wykonane, zarówno między włóknami, jak i między włóknami i innymi białkami, takimi jak cząsteczki adhezyjne lub mikrotubule.
w jaki sposób kontrolowana jest polimeryzacja i rearanżacja aktyny? Receptory, które sygnalizują ruch komórkowy, mogą inicjować nieco inne szlaki, ale wiele z nich ma pewne podobieństwa w aktywacji jednego lub więcej członków rodziny Ras małych Gtpaz. Te cząsteczki sygnalizacyjne, takie jak Rac, Rho i cdc42 mogą być aktywowane przez receptorowe kinazy tyrozynowe (patrz ścieżki aktywacji RTK-Ras, Chap. 14). Każda z nich ma nieco inną rolę w ruchliwości komórek: aktywacja cdc42 prowadzi do tworzenia filopodii, Rac aktywuje szlak, który obejmuje Arp2 / 3 i kofilinę do tworzenia lamellipodii, a RHO aktywuje miosynę II do kontrolowania adhezji ogniskowej i tworzenia włókien naprężeniowych. Inny typ kaskady receptora, kaskada sygnałowa białka G (również Rozdział 14), Może prowadzić do aktywacji PLC, a następnie rozszczepiania PIP2 i wzrostu Cytozolicznego Ca2+. Zmiany te, jak wspomniano wcześniej, mogą również aktywować miosynę II, a także enzymy przebudowujące gelsolin, kofilin i profilin. Rozkłada to istniejące struktury aktyny, aby uczynić komórkę bardziej płynną, jednocześnie przyczyniając się do powstania nowego cytoszkieletu wiodącego.
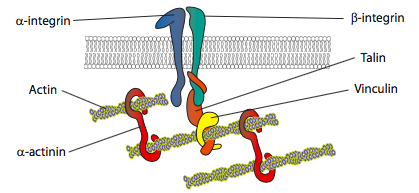
eksperymenty in vitro pokazują, że gdy membrana popycha do przodu, nowe styki adhezyjne są tworzone przez cząsteczki adhezyjne lub receptory, które wiążą podłoże (często szkiełka lub naczynia do hodowli komórkowej są pokryte kolagenem, filamininą lub innymi białkami macierzy pozakomórkowej). Kontakty następnie rekrutuj elementy cytoszkieletu dla większej stabilności, tworząc adhezję ogniskową (rysunek \(\PageIndex{20}\)). Jednak tworzenie ogniskowych zrostów wydaje się być artefaktem kultury komórkowej i nie jest jasne, czy rodzaje zrostów, które tworzą in vivo, rekrutują te same typy składników cytoszkieletu.
trzecim krokiem do poruszania się komórek jest masowy ruch treści komórkowej do przodu. Mechanizmy tej fazy są niejasne, ale istnieją pewne dowody na to, że wykorzystując powiązania między cytoszkieletem aktyny na krawędzi czołowej a przednią częścią cytoszkieletu mikrotubul, mikrotubule są przestawiane w celu utworzenia wydajnej ścieżki transportu dla ruchu masowego. Innym aspektem może być efekt „corralling” przez sieci aktynowe, które kierunkowo otwierają przestrzeń w kierunku krawędzi natarcia. Mikrotubule następnie wchodzą do tej przestrzeni łatwiej niż praca przez ciasną siatkę aktynową, wymuszając przepływ we właściwym kierunku.
wiele prac nad interakcjami mikrotubule-aktyna w ruchliwości komórek zostało wykonanych poprzez badania nad neuronalnym stożkiem wzrostu, który jest czasami określany jako komórka na smyczy, ponieważ działa prawie niezależnie jak pełzająca komórka, szukając właściwej ścieżki prowadzącej jego Akson z ciała komórki do właściwego połączenia synaptycznego (A. W. Schaefer et al, Dev. Cell 15: 146-62, 2008).
wreszcie komórka musi cofnąć swoje stare zrosty na krawędzi spływu. Może się to zdarzyć na wiele różnych sposobów. In vitro zaobserwowano, że komórki pełzające odrywają się od podłoża, pozostawiając w tym procesie drobne fragmenty błony i związane z nią białka adhezyjne. Przypuszcza się, że wytworzona siła pochodzi z włókien naprężeniowych aktyna-miozyna, prowadzących z bardziej wysuniętych zrostów ogniskowych. Istnieją jednak mniej destrukcyjne mechanizmy dostępne dla komórek. W niektórych przypadkach przyczepność receptora komórkowego do substratu zewnątrzkomórkowego może być regulowana wewnętrznie, być może przez fosforylację lub defosforylację receptora. Inną możliwością jest endocytoza receptora, oderwanie go od powierzchni komórki. Transcytoza) lub jeśli nie jest już potrzebna lub uszkodzona, może zostać rozbita w lizosomie.
